解题方法
1 . 配平下列反应方程式。
(1)正向配平类
①___ HCl(浓)+___ MnO2
___ Cl2↑+___ MnCl2+___ H2O
②___ KI+___ KIO3+___ H2SO4=____ I2+___ K2SO4+___ H2O
③___ MnO +
+___ H++___ Cl-=___ Mn2++___ Cl2↑+___ H2O
(2)逆向配平类
①___ S+___ KOH=___ K2S+___ K2SO3+___ H2O
②___ P4+___ KOH+___ H2O=___ K3PO4+___ PH3↑
(3)缺项配平类
①___ ClO-+___ Fe(OH)3+___ =___ Cl-+___ FeO +
+___ H2O
②___ MnO +
+___ H2O2+___ =___ Mn2++___ O2↑+___ H2O
③某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有Al2O3、C、N2、AlN、CO。请将反应物与生成物分别填入以下空格内,并配平。___

(1)正向配平类
①

②
③
 +
+(2)逆向配平类
①
②
(3)缺项配平类
①
 +
+②
 +
+③某高温还原法制备新型陶瓷氮化铝(AlN)的反应体系中的物质有Al2O3、C、N2、AlN、CO。请将反应物与生成物分别填入以下空格内,并配平。

您最近一年使用:0次
2020-09-02更新
|
2216次组卷
|
3卷引用:苏教版(2020)高一必修第一册专题4 突破3 氧化还原反应与离子反应的综合应用
苏教版(2020)高一必修第一册专题4 突破3 氧化还原反应与离子反应的综合应用鲁科版(2019)高一必修第一册第2章 元素与物质世界 第3节 氧化还原反应 专题4 氧化还原反应的计算及方程式的配平(已下线)易错专题07 氧化还原反应电子转移的表示及方程式的书写-【突破易错·冲刺满分】2021-2022学年高一上学期化学期中期末易错专题(人教版2019)
解题方法
2 . 1887年,英国人赫勒森发明了最早的干电池,如今干电池已经发展成为一个庞大的家族,种类达100多种。应用广泛的是Zn—MnO2干电池,其电解质溶液是ZnCl2—NH4Cl混合溶液。电池工作一段时间后,电池内存在7种物质:NH3、Mn2O3、ZnCl2、MnO2、NH4Cl、Zn和H2O。请回答下列问题
(1)该电池的负极材料是__ ;电池工作时,电子流向__ (填“正极”或“负极”,下同);放电时NH4+向___ 移动。
(2)该氧化还原反应的化学方程式为__ ,发生还原反应的物质是__ ,被氧化的元素是__ 。若有17.4g氧化剂参与反应,则电子转移数目为__ NA(NA表示阿伏加 德罗常数的值)。
(3)普通锌锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是___ 。
(4)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是__ 。欲除去Cu2+,最好选用下列试剂中的__ (填序号)。
a.NaOH b.Zn c.Fe d.NH3·H2O
(1)该电池的负极材料是
(2)该氧化还原反应的化学方程式为
(3)普通锌锰电池的缺点是电量小、放电电流弱。为增大放电电流,可把负极锌片改为锌粉,其理由是
(4)若ZnCl2—NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的腐蚀,其主要原因是
a.NaOH b.Zn c.Fe d.NH3·H2O
您最近一年使用:0次
名校
3 . 三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为_______
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______
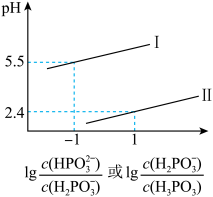
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg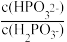 的是曲线
的是曲线_____ (填“Ⅰ”或“Ⅱ”),亚磷酸(H3PO3)的Ka1=_____ ,反应HPO32-+H2O H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是_____ 。
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=_____ mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示,则表示lg
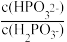 的是曲线
的是曲线 H2PO3-+OH-的平衡常数的值是
H2PO3-+OH-的平衡常数的值是
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=

您最近一年使用:0次
2020-04-03更新
|
791次组卷
|
4卷引用:湖北省武汉市武昌区武汉中学2019-2020学年高二上学期化学(人教版选修4)期末复习试题:专题19 大题综合训练
4 . MnO2是一种重要的无机功能材料,可由MnSO4和NaClO3溶液反应制得,反应原理为: MnSO4+ NaClO3+ H2O Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
 Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是
Cl2↑ + Na2SO4 + MnO2 ↓+ (未配平),则关于此反应的叙述不正确的是| A.NaClO3中Cl的化合价为+5 |
| B.每生成8.7 g氧化产物,反应中转移的电子数约为0.2×6.02×1023 |
| C.NaClO3的氧化性强于MnO2的氧化性 |
| D.该反应右边方框内的产物是NaOH |
您最近一年使用:0次
2020-01-19更新
|
364次组卷
|
2卷引用:甘肃省武威第六中学2020届高三上学期第六次诊断考试化学试题
名校
5 . 用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是

下列说法错误的是
| A.标准状况下,11.2 L CO2中含C=O键的数目为6.02×1023 |
| B.反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O |
| C.理论上吸收HCHO与消耗Fe3+的物质的量之比为4:1 |
| D.30 g HCHO被氧化时转移电子数目为4×6.02×1023 |
您最近一年使用:0次
2020-01-09更新
|
290次组卷
|
3卷引用:安徽省濉溪县2020届高三上学期第一次月考化学试题
6 . 金属的回收是工业生产中的重要课题,利用某工业冶炼废渣 主要成分为
主要成分为 和铁、锡、铅、铜的氧化物
和铁、锡、铅、铜的氧化物 回收锡、铜、铅的工艺流程如图所示:
回收锡、铜、铅的工艺流程如图所示:
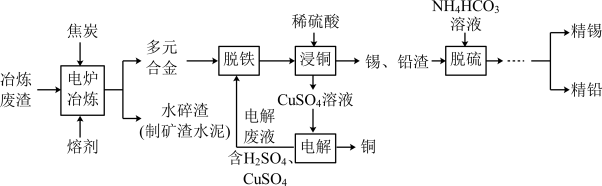
回答下列问题:
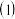 电炉冶炼时,焦炭的作用是
电炉冶炼时,焦炭的作用是______  填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂” ,将焦炭粉碎的目的是
,将焦炭粉碎的目的是______ 。熔剂的主要成分是氟石 ,高温下能与
,高温下能与 反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为
反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为______ 。
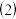 脱铁后的溶液中含有少量的
脱铁后的溶液中含有少量的  ,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为
,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为______ 。
 已知
已知  可表示为:
可表示为: ,则
,则  也可用氧化物表示为:
也可用氧化物表示为:______ 。
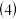 脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是
脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是______ 。
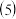 若该冶炼废渣中锡的质量分数为
若该冶炼废渣中锡的质量分数为  ,30t 废渣制得精锡
,30t 废渣制得精锡  ,则锡的回收率为
,则锡的回收率为______ 。
 主要成分为
主要成分为 和铁、锡、铅、铜的氧化物
和铁、锡、铅、铜的氧化物 回收锡、铜、铅的工艺流程如图所示:
回收锡、铜、铅的工艺流程如图所示:
回答下列问题:
 电炉冶炼时,焦炭的作用是
电炉冶炼时,焦炭的作用是 填“氧化剂”或“还原剂”
填“氧化剂”或“还原剂” ,将焦炭粉碎的目的是
,将焦炭粉碎的目的是 ,高温下能与
,高温下能与 反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为
反应生成两种钙盐,其中之一为CaSiF6,该反应的化学方程式为 脱铁后的溶液中含有少量的
脱铁后的溶液中含有少量的  ,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为
,为减少锡的损失,可用锡、铜、铅、铁多元合金回收处理,反应的离子方程式为 已知
已知  可表示为:
可表示为: ,则
,则  也可用氧化物表示为:
也可用氧化物表示为: 脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是
脱硫后需过滤、洗涤再进入下一步工序,检验滤渣是否洗涤干净的方法是 若该冶炼废渣中锡的质量分数为
若该冶炼废渣中锡的质量分数为  ,30t 废渣制得精锡
,30t 废渣制得精锡  ,则锡的回收率为
,则锡的回收率为
您最近一年使用:0次
解题方法
7 . (1)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。完成下列填空:
①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体. 若As2S3和SnCl2恰好完全反应,As2S3和SnCl2的物质的量之比为_______ .该反应的氧化剂是_____ ,反应产生的气体可用_______ 吸收.
②As2S3和HNO3有如下反应:__ As2S3+__ NO3-+__ ___ =__ H3AsO4+__ S+__ NO2↑+__ _____
A.将方程式补充完整并配平
B.若生成1 mol H3AsO4,则反应中转移电子的物质的量为________ .
(2)某温度下将Cl2通入KOH溶液中,反应后得到KCl,KClO和KClO3的混合溶液,经测定ClO-和 的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为
的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为___ .若5mol Cl2参加反应,转移电子数为______________ (用NA表示阿伏加 德罗常数)
(3)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O. 该反应的化学方程式为______________________ ;若反应过程中转移了0.3mol电子,则氧化产物的质量是______ g;
①As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体. 若As2S3和SnCl2恰好完全反应,As2S3和SnCl2的物质的量之比为
②As2S3和HNO3有如下反应:
A.将方程式补充完整并配平
B.若生成1 mol H3AsO4,则反应中转移电子的物质的量为
(2)某温度下将Cl2通入KOH溶液中,反应后得到KCl,KClO和KClO3的混合溶液,经测定ClO-和
 的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为
的物质的量浓度之比为7:1,则Cl2与KOH反应时,氧化剂和还原剂物质的量之比为(3)某一反应体系中有反应物和生成物共五种物质:S,H2S,HNO3,NO,H2O. 该反应的化学方程式为
您最近一年使用:0次
8 . 硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取含硝基的炸药等。试回答下列问题:
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:__ 。
②写出过量铁与稀硝酸反应的离子方程式:__ 。
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为__ 。上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为__ g。
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:__ Al+__ NO3-+__ OH-+__ =__ [Al(OH)4]-+__ N2↑。
②上述反应中,还原剂与还原产物的物质的量之比是__ ,反应中转移电子0.3mol,生成__ mL(标准状况下)N2。
(1)某同学对铁与稀硝酸的反应进行探究,若HNO3只被还原成NO,则:
①写出铁与过量稀硝酸反应的离子方程式:
②写出过量铁与稀硝酸反应的离子方程式:
③若28g铁与含1.6mol硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比为
(2)饮用水中NO3-对人类健康会产生危害,为了降低饮用水中NO3-的浓度,某饮用水研究人员提出,可在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:
②上述反应中,还原剂与还原产物的物质的量之比是
您最近一年使用:0次
2019-12-05更新
|
616次组卷
|
5卷引用:鲁科版必修一2019—2020学年第三章检测试题
鲁科版必修一2019—2020学年第三章检测试题云南省广南县二中2019-2020学年高一上学期期末考试化学试题云南省贡山县第三中学2017-2018学年高一上学期期末考试化学试题贵州省独山县第四中学2019-2020学年高一上学期期末考试化学试题(已下线)第三单元 物质的性质与转化(能力提升)-2020-2021学年高一化学必修第一册单元测试定心卷 (鲁科版2019)
9 . 亚硝酸钠易溶于水,水溶液显碱性,有氧化性,也有还原性。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。处理方法之一如下:
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+____
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:_____
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是__ 。从环保角度来讲,要处理NaNO2,所用的物质的___ (填“氧化性”或“还原性”)应该比KI更__ (填“强”或“弱”)。
(4)简便鉴别亚硝酸钠和氯化钠的方法是____ 。
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。___
NaNO2+KI+ →NO↑+I2+K2SO4+Na2SO4+
(1)请完成该化学方程式并配平。
(2)将上述反应方程式改写为离子反应方程式:
(3)用上述反应来处理NaNO2并不是最佳方法,其原因是
(4)简便鉴别亚硝酸钠和氯化钠的方法是
(5)已知亚硝酸钠可以与氯化铵反应生成氮气和氯化钠,写出该反应的化学反应方程式并用单线桥表示其电子转移的方向和数目。
您最近一年使用:0次
2019-09-17更新
|
2974次组卷
|
7卷引用:第一章 章末检测(2)《高中新教材同步备课》(人教版 必修第一册)
名校
10 . 铜是与人类关系非常密切的有色金属。已知:常温下,在溶液中 稳定,
稳定,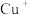 易在酸性条件下发生反应:
易在酸性条件下发生反应: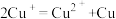 。大多数+1价铜的化合物是难溶物,
。大多数+1价铜的化合物是难溶物,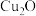 、CuI、CuCl、CuH等。
、CuI、CuCl、CuH等。
(1)在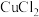 溶液中逐滴加入过量KI溶液可能发生以下反应:
溶液中逐滴加入过量KI溶液可能发生以下反应:
a.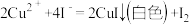
b.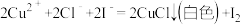 。
。
为顺利观察到白色沉淀可以加入的最佳试剂是________ 。
A.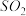 B.苯 C.NaOH溶液 D.乙醇
B.苯 C.NaOH溶液 D.乙醇
(2)一定条件下,在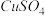 中加入
中加入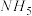 反应生成氢化亚铜(CuH)。
反应生成氢化亚铜(CuH)。
①已知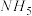 是离子化合物且所有原子都达到稀有气体的稳定结构,写出
是离子化合物且所有原子都达到稀有气体的稳定结构,写出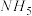 的电子式:
的电子式:__________ 。
②写出CuH在过量稀盐酸中有气体生成的离子方程式:____________ 。
(3)纳米级 具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。
具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。
方法一:在新制 浊液中滴入
浊液中滴入 水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。
水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。
①写出上述制备过程中的总反应方程式:_____________ 。
方法二:以铜作阳极,石墨作阴极电解。已知:铜作阳极时,铜先被氧化生成 ,后
,后 继续氧化生成
继续氧化生成 ;在碱性溶液中CuCl浊液易转化为
;在碱性溶液中CuCl浊液易转化为 。
。
②以NaOH溶液作为电解质溶液时需添加NaCl,其目的是______________ ,写出阳极反应式:______________ 。
③写出在碱性溶液中CuCl浊液转化为 的离子方程式:
的离子方程式:____________ 。
④这样制得的 中往往含有CuCl,请设计实验证明CuCl的存在:
中往往含有CuCl,请设计实验证明CuCl的存在:_________ 。
 稳定,
稳定,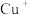 易在酸性条件下发生反应:
易在酸性条件下发生反应: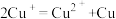 。大多数+1价铜的化合物是难溶物,
。大多数+1价铜的化合物是难溶物,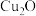 、CuI、CuCl、CuH等。
、CuI、CuCl、CuH等。(1)在
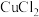 溶液中逐滴加入过量KI溶液可能发生以下反应:
溶液中逐滴加入过量KI溶液可能发生以下反应:a.
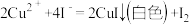
b.
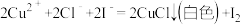 。
。为顺利观察到白色沉淀可以加入的最佳试剂是
A.
 B.苯 C.NaOH溶液 D.乙醇
B.苯 C.NaOH溶液 D.乙醇(2)一定条件下,在
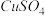 中加入
中加入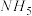 反应生成氢化亚铜(CuH)。
反应生成氢化亚铜(CuH)。①已知
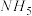 是离子化合物且所有原子都达到稀有气体的稳定结构,写出
是离子化合物且所有原子都达到稀有气体的稳定结构,写出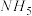 的电子式:
的电子式:②写出CuH在过量稀盐酸中有气体生成的离子方程式:
(3)纳米级
 具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。
具有特殊的光学、电学及光电化学性质,在太阳能电池、传感器、超导体等方面有着潜在的应用,研究制备纳米氧化亚铜的方法已成为当前的热点研究之一。方法一:在新制
 浊液中滴入
浊液中滴入 水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。
水溶液,蓝色沉淀逐渐转化为砖红色,同时产生无色无味的气体。①写出上述制备过程中的总反应方程式:
方法二:以铜作阳极,石墨作阴极电解。已知:铜作阳极时,铜先被氧化生成
 ,后
,后 继续氧化生成
继续氧化生成 ;在碱性溶液中CuCl浊液易转化为
;在碱性溶液中CuCl浊液易转化为 。
。②以NaOH溶液作为电解质溶液时需添加NaCl,其目的是
③写出在碱性溶液中CuCl浊液转化为
 的离子方程式:
的离子方程式:④这样制得的
 中往往含有CuCl,请设计实验证明CuCl的存在:
中往往含有CuCl,请设计实验证明CuCl的存在:
您最近一年使用:0次



