1 . 在恒温恒容密闭容器中充入一定量W(g),发生如下反应:

反应②和③的速率方程分别为 和
和 ,其中
,其中 、
、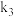 分别为反应②和③的速率常数、反应③的活化能大于反应②,测得W(g)的浓度随时间的变化如下表:
分别为反应②和③的速率常数、反应③的活化能大于反应②,测得W(g)的浓度随时间的变化如下表:
下列说法正确的是

反应②和③的速率方程分别为
 和
和 ,其中
,其中 、
、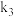 分别为反应②和③的速率常数、反应③的活化能大于反应②,测得W(g)的浓度随时间的变化如下表:
分别为反应②和③的速率常数、反应③的活化能大于反应②,测得W(g)的浓度随时间的变化如下表:| t/min | 0 | 1 | 2 | 3 | 4 | 5 |
 | 0.160 | 0.113 | 0.080 | 0.056 | 0.040 | 0.028 |
A. 内,W的平均反应速率为 内,W的平均反应速率为 |
B.若升高温度,平衡时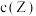 减小 减小 |
C.若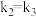 ,平衡时 ,平衡时 |
| D.若增大容器容积,平衡时Y的产率增大 |
您最近一年使用:0次
名校
2 . 臭氧是理想的烟气脱硝剂,其脱硝反应为: ,反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是
,反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是
 ,反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是
,反应在恒容密闭容器中进行,下列由该反应相关图象作出的判断正确的是| A | B | C | D |
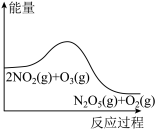 |  | 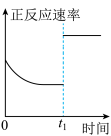 | 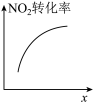 |
| 降低温度,平衡常数变大 |  内,反应速率为 内,反应速率为 |  时仅加入催化剂,平衡向正方向移动 时仅加入催化剂,平衡向正方向移动 | 达平衡时,仅改变x,则x为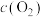 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
3 . 2023年7月1日我国开始实施汽车尾气排放“国六b”标准,研究汽车尾气中 等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用
等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用 将
将 氧化为高价态氮氧化物
氧化为高价态氮氧化物 反应机理如下:
反应机理如下:
ⅰ)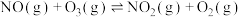
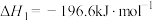
ⅱ)

(1)已知反应ⅱ的逆反应活化能为 ,则其正反应的活化能为
,则其正反应的活化能为___________  。
。
(2)在一恒温恒容的容器中发生上述反应ⅰ、ⅱ,若降低 的浓度,
的浓度, 的转化率
的转化率___________ (填“增大”、“减小”或“不变”);保持恒温恒容,下列描述不能说明反应已达到平衡的是___________ 。
A.
B.容器中气体的平均相对分子质量不随时间变化
C.某时刻容器中 与
与 的物质的量之比为
的物质的量之比为
D.容器中气体的总压强不随时间而变化
(3)将 、
、 充入恒容密闭容器中,起始时浓度均为
充入恒容密闭容器中,起始时浓度均为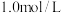 ,下图是温度为
,下图是温度为 、
、 时,
时,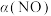 随时间变化图。
随时间变化图。 温度下,
温度下, ,反应的平均速率
,反应的平均速率
___________ 。若只发生反应ⅰ,反应速率 ,其中
,其中 、
、 只与温度及活化能有关,若加入正催化剂,
只与温度及活化能有关,若加入正催化剂, 和
和 均
均___________ (填“变大”、“变小”或“不变”)。M点与N点对应的 的大小关系:M
的大小关系:M___________ N(填“>”、“<”或“=”),N点时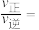
___________ 。

(4)用惰性电极电解食盐水对烟气脱氮,将含NO的烟气通入电解池,其中NO被阳极产生的 氧化为
氧化为 ,则电解池中发生的总的离子反应方程式为
,则电解池中发生的总的离子反应方程式为___________ 。
 等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用
等污染物的转化对环境保护具有重要意义。一种脱硝方法是利用 将
将 氧化为高价态氮氧化物
氧化为高价态氮氧化物 反应机理如下:
反应机理如下:ⅰ)
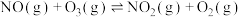
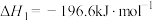
ⅱ)


(1)已知反应ⅱ的逆反应活化能为
 ,则其正反应的活化能为
,则其正反应的活化能为 。
。(2)在一恒温恒容的容器中发生上述反应ⅰ、ⅱ,若降低
 的浓度,
的浓度, 的转化率
的转化率A.

B.容器中气体的平均相对分子质量不随时间变化
C.某时刻容器中
 与
与 的物质的量之比为
的物质的量之比为
D.容器中气体的总压强不随时间而变化
(3)将
 、
、 充入恒容密闭容器中,起始时浓度均为
充入恒容密闭容器中,起始时浓度均为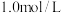 ,下图是温度为
,下图是温度为 、
、 时,
时,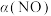 随时间变化图。
随时间变化图。 温度下,
温度下, ,反应的平均速率
,反应的平均速率
 ,其中
,其中 、
、 只与温度及活化能有关,若加入正催化剂,
只与温度及活化能有关,若加入正催化剂, 和
和 均
均 的大小关系:M
的大小关系:M

(4)用惰性电极电解食盐水对烟气脱氮,将含NO的烟气通入电解池,其中NO被阳极产生的
 氧化为
氧化为 ,则电解池中发生的总的离子反应方程式为
,则电解池中发生的总的离子反应方程式为
您最近一年使用:0次
解题方法
4 . 我国力争2030年前实现碳达峰, 的捕集、利用已成为科学家研究的热点。
的捕集、利用已成为科学家研究的热点。 在固体催化剂表面加氢合成甲烷过程中发生如下反应:
在固体催化剂表面加氢合成甲烷过程中发生如下反应:
主反应Ⅰ:
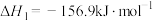
副反应Ⅱ:

(1) 的
的
___________  ,从化学平衡移动的角度分析,为了提高甲烷的产率,反应适宜在
,从化学平衡移动的角度分析,为了提高甲烷的产率,反应适宜在___________ 条件下进行。
A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
(2)若在恒容绝热的容器中只发生副反应Ⅱ,下列能说明该反应一定达到平衡状态的是___________。
(3)在一定条件下,在某催化剂作用下,向恒容密闭容器中充入一定量的 和
和 ,若只发生主反应Ⅰ,测得在相同时间内,不同温度下
,若只发生主反应Ⅰ,测得在相同时间内,不同温度下 的转化率如图所示,已知
的转化率如图所示,已知 时已达平衡状态。
时已达平衡状态。
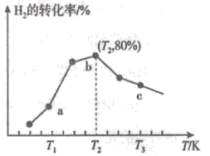
①a点
___________ 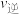 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);
②c点的转化率比b点低的原因是___________ ;
③温度为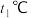 时,将等物质的量的
时,将等物质的量的 和
和 充入体积为1L的密闭容器中,若只发生主反应Ⅰ,该反应的平衡常数K=2.实验测得:
充入体积为1L的密闭容器中,若只发生主反应Ⅰ,该反应的平衡常数K=2.实验测得: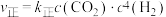 、
、 ,
, 、
、 为速率常数。温度为
为速率常数。温度为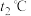 ,达平衡时:
,达平衡时: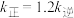 ,则
,则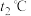
___________ (填“>”、“<”或“=”)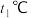 。
。
(4)500℃时,向IL恒容密闭容器中充入 和
和 ,初始压强为p,20min时主、副反应都达到平衡状态,测得
,初始压强为p,20min时主、副反应都达到平衡状态,测得 ,体系压强为
,体系压强为 ,则0~20min内
,则0~20min内
___________  ;500℃,副反应Ⅱ的压强平衡常数Kp=
;500℃,副反应Ⅱ的压强平衡常数Kp=___________ (用平衡分压代替平衡浓度来计算,分压=总压×物质的量分数,计算结果保留2位有效数字)。
 的捕集、利用已成为科学家研究的热点。
的捕集、利用已成为科学家研究的热点。 在固体催化剂表面加氢合成甲烷过程中发生如下反应:
在固体催化剂表面加氢合成甲烷过程中发生如下反应:主反应Ⅰ:

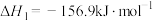
副反应Ⅱ:


(1)
 的
的
 ,从化学平衡移动的角度分析,为了提高甲烷的产率,反应适宜在
,从化学平衡移动的角度分析,为了提高甲烷的产率,反应适宜在A.低温、低压 B.低温、高压 C.高温、高压 D.高温、低压
(2)若在恒容绝热的容器中只发生副反应Ⅱ,下列能说明该反应一定达到平衡状态的是___________。
| A.容器内气体密度不再改变 |
| B.容器内的压强不再改变 |
C.容器内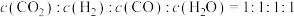 |
| D.单位时间内,断开H-H键的数目和断开H-O键的数目之比为1∶2 |
 和
和 ,若只发生主反应Ⅰ,测得在相同时间内,不同温度下
,若只发生主反应Ⅰ,测得在相同时间内,不同温度下 的转化率如图所示,已知
的转化率如图所示,已知 时已达平衡状态。
时已达平衡状态。
①a点

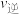 (填“>”、“<”或“=”);
(填“>”、“<”或“=”);②c点的转化率比b点低的原因是
③温度为
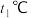 时,将等物质的量的
时,将等物质的量的 和
和 充入体积为1L的密闭容器中,若只发生主反应Ⅰ,该反应的平衡常数K=2.实验测得:
充入体积为1L的密闭容器中,若只发生主反应Ⅰ,该反应的平衡常数K=2.实验测得: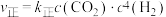 、
、 ,
, 、
、 为速率常数。温度为
为速率常数。温度为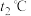 ,达平衡时:
,达平衡时: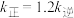 ,则
,则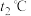
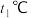 。
。(4)500℃时,向IL恒容密闭容器中充入
 和
和 ,初始压强为p,20min时主、副反应都达到平衡状态,测得
,初始压强为p,20min时主、副反应都达到平衡状态,测得 ,体系压强为
,体系压强为 ,则0~20min内
,则0~20min内
 ;500℃,副反应Ⅱ的压强平衡常数Kp=
;500℃,副反应Ⅱ的压强平衡常数Kp=
您最近一年使用:0次
解题方法
5 . 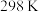 时,测得溶液中反应
时,测得溶液中反应 在不同浓度时的速率如下表所示:
在不同浓度时的速率如下表所示:
下列说法正确的是
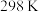 时,测得溶液中反应
时,测得溶液中反应 在不同浓度时的速率如下表所示:
在不同浓度时的速率如下表所示:| 实验编号 | 1 | 2 | 3 | 4 | 5 |
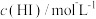 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
 | 0.00760 | 0.0153 | 0.0227 | 0.0151 | 0.0228 |
A.该反应的速率方程可表示为 |
B.反应开始后的某一时刻存在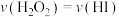 |
C.反应速率常数 与浓度有关 与浓度有关 |
D.温度越高,该反应的反应速率常数 越大 越大 |
您最近一年使用:0次
解题方法
6 . 氮及其化合物在工农业生产、生活中有着重要作用。合成氨工业中:化学平衡常数K与温度t的关系如表,已知:
(1)试比较 、
、 的大小,
的大小,
___________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
(2) 时当测得
时当测得 和
和 、
、 的物质的量浓度分别为
的物质的量浓度分别为 和
和 、
、 时,则该反应
时,则该反应
____________  (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)
(3)在恒温恒容的密闭容器中,下列能作为合成氨反应达到平衡的依据的是______________ 。
a.
b.容器内密度保持不变
c.混合气体的压强保持不变
d. 断裂时有
断裂时有 生成
生成
e. 、
、 、
、 的浓度之比为
的浓度之比为
(4)将 和
和 充入到
充入到 的恒容密闭容器中模拟合成氨反应。反应中某些物质浓度随时间变化的曲线如图所示。
的恒容密闭容器中模拟合成氨反应。反应中某些物质浓度随时间变化的曲线如图所示。
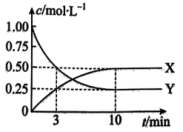
①曲线Y表示___________ (填写“ ”、“
”、“ ”或“
”或“ ”)的物质的量浓度随时间变化。
”)的物质的量浓度随时间变化。
② 内,氢气的反应速率为
内,氢气的反应速率为_____________ (保留2位有效数字)。
③平衡时氮气的转化率
_______________ 。
(5)如图是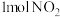 和
和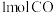 反应生成
反应生成 和
和 过程中能量变化示意图,请写出
过程中能量变化示意图,请写出 和
和 反应的热化学方程式
反应的热化学方程式________________________________ 。


| 600 | 500 | 400 |
K |
|
| 0.5 |
(1)试比较
 、
、 的大小,
的大小,
 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)(2)
 时当测得
时当测得 和
和 、
、 的物质的量浓度分别为
的物质的量浓度分别为 和
和 、
、 时,则该反应
时,则该反应
 (填写“>”、“=”或“<”)
(填写“>”、“=”或“<”)(3)在恒温恒容的密闭容器中,下列能作为合成氨反应达到平衡的依据的是
a.

b.容器内密度保持不变
c.混合气体的压强保持不变
d.
 断裂时有
断裂时有 生成
生成e.
 、
、 、
、 的浓度之比为
的浓度之比为
(4)将
 和
和 充入到
充入到 的恒容密闭容器中模拟合成氨反应。反应中某些物质浓度随时间变化的曲线如图所示。
的恒容密闭容器中模拟合成氨反应。反应中某些物质浓度随时间变化的曲线如图所示。
①曲线Y表示
 ”、“
”、“ ”或“
”或“ ”)的物质的量浓度随时间变化。
”)的物质的量浓度随时间变化。②
 内,氢气的反应速率为
内,氢气的反应速率为③平衡时氮气的转化率

(5)如图是
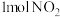 和
和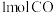 反应生成
反应生成 和
和 过程中能量变化示意图,请写出
过程中能量变化示意图,请写出 和
和 反应的热化学方程式
反应的热化学方程式
您最近一年使用:0次
名校
7 . CO、SO2等烟道气对环境有污染,需经处理后才能排放,处理含CO、SO2烟道气的一种方法是将其在催化剂作用下转化为单质 :
:
 。回答下列问题:
。回答下列问题:
(1)已知CO的燃烧热1为任意常数283.0 kJ⋅mol-1,
 kJ⋅mol-1。则上述反应的
kJ⋅mol-1。则上述反应的
___________ kJ⋅mol-1。
(2)其他条件相同、催化剂不同时发生上述反应。SO2的转化率随反应温度的变化如图1所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是___________ 。某种铁镍合金的立方晶胞如图2所示,铁原子的配位数为___________ ,晶体中,铁与镍数目之比为___________ 。
___________ mol⋅L-1⋅min-1。
②2 min后改变下列条件能使上述反应的速率增大,且平衡向正向移动的是___________ (填字母)。
a.选用更高效的催化剂 b.升高温度
c.及时分离出CO2 d.增加CO的浓度的平衡转化率
(4)在密闭容器中,充入2 mol CO和1 mol SO2,发生上述反应,SO2的平衡转化率随温度、压强的变化如图4所示。 、
、 、
、 由大到小的关系是
由大到小的关系是___________ 。
②B点对应条件下
___________ [对于反应 ,
, ,x为物质的量分数]。
,x为物质的量分数]。
③A点和C点压强平衡常数之比为___________ (用分压代替浓度,分压=总压×物质的量分数)。
 :
:
 。回答下列问题:
。回答下列问题:(1)已知CO的燃烧热1为任意常数283.0 kJ⋅mol-1,

 kJ⋅mol-1。则上述反应的
kJ⋅mol-1。则上述反应的
(2)其他条件相同、催化剂不同时发生上述反应。SO2的转化率随反应温度的变化如图1所示。Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是



②2 min后改变下列条件能使上述反应的速率增大,且平衡向正向移动的是
a.选用更高效的催化剂 b.升高温度
c.及时分离出CO2 d.增加CO的浓度的平衡转化率
(4)在密闭容器中,充入2 mol CO和1 mol SO2,发生上述反应,SO2的平衡转化率随温度、压强的变化如图4所示。

 、
、 、
、 由大到小的关系是
由大到小的关系是②B点对应条件下

 ,
, ,x为物质的量分数]。
,x为物质的量分数]。③A点和C点压强平衡常数之比为
您最近一年使用:0次
2024-02-01更新
|
289次组卷
|
3卷引用:江西省宜春市第一中学2023-2024学年高三上学期1月质量检测化学试题
江西省宜春市第一中学2023-2024学年高三上学期1月质量检测化学试题(已下线)专题10 化学反应原理综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)山西省忻州市2023-2024学年高三上学期1月期末理综试题-高中化学
解题方法
8 . 稀土被称为新材料的宝库。稀土中的镧系离于可用离子交换法分离,其反应可表示为: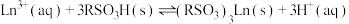 。某温度时,
。某温度时, 随时间变化关系如图所示。下列说法正确的是
随时间变化关系如图所示。下列说法正确的是
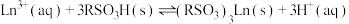 。某温度时,
。某温度时, 随时间变化关系如图所示。下列说法正确的是
随时间变化关系如图所示。下列说法正确的是
A. 时的正反应速率大于 时的正反应速率大于 时的逆反应速率 时的逆反应速率 |
B. 时间段的平均反应速率为: 时间段的平均反应速率为: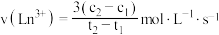 |
C. 时增大 时增大 ,该平衡左移,平衡常数减小 ,该平衡左移,平衡常数减小 |
D. 时离子交换反应停止 时离子交换反应停止 |
您最近一年使用:0次
2024-01-22更新
|
810次组卷
|
6卷引用:江西省宜春市丰城市第九中学2023-2024学年高三(复读班)上学期期末考试化学试题
江西省宜春市丰城市第九中学2023-2024学年高三(复读班)上学期期末考试化学试题2024年1月安徽普通高等学校招生考试适应性测试化学试题(已下线)选择题6-10(已下线)2024年1月“九省联考”安徽真题完全解读与考后提升(已下线)热点13 化学反应速率与化学平衡(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
解题方法
9 . 根据化学反应与能量情景综合应用。
(1)一定条件下,将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌mC(g)+2D(g),经过5min后,反应达到平衡。此时测得,D的浓度为0.5mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1mol·L-1·min-1。根据已知条件填空:
①m的值为___________ 。
②A在5min末的浓度___________ 。
(2)①已知:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。现将体积比为1:2的NO2和SO2的混合气体置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是___________ (填序号)
a.混合气体总物质的量保持不变b.混合气体密度保持不变
c.NO2(g)和SO2(g)的体积比保持不变
d.每消耗1molSO2,同时消耗0.5molSO3(g)
e.混合气体的平均相对分子质量保持不变
f.NO2的转化率保持不变
②在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)⇌C(g)+D(g),下列描述中能表明反应已达到平衡状态的有___________ (填序号)
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
(3)在一定容密闭容器中,保持一定的温度,在一定条件下进行以下反应:A(g)+2B(g)⇌3C(g),已知加入1molA和3molB,达到平衡后,生成amolC。在相同的实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合物中的百分含量不变,则还应加入C___________ mol。
(4)现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当增大压强时,混合体系中C的质量分数增大,则:
①若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色___________ (填变深、变浅或不变,下同)。
②若维持容器内压强不变,充入Ne时,混合物的颜色___________ 。
(5)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH
已知几种化学键的键能数据如表:
根据键能数据估算上述反应中反应热数值为___________ kJ。
(6)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

则c电极的反应方程式为___________ 。若线路中转移2mol电子,则上述CH3OH燃料电池,消耗的O2在标准状况下的体积为___________ L。
(7))2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为___________ 。
(1)一定条件下,将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)⇌mC(g)+2D(g),经过5min后,反应达到平衡。此时测得,D的浓度为0.5mol/L,c(A)∶c(B)=1∶3,C的反应速率是0.1mol·L-1·min-1。根据已知条件填空:
①m的值为
②A在5min末的浓度
(2)①已知:NO2(g)+SO2(g)⇌SO3(g)+NO(g)。现将体积比为1:2的NO2和SO2的混合气体置于恒温恒容的密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.混合气体总物质的量保持不变b.混合气体密度保持不变
c.NO2(g)和SO2(g)的体积比保持不变
d.每消耗1molSO2,同时消耗0.5molSO3(g)
e.混合气体的平均相对分子质量保持不变
f.NO2的转化率保持不变
②在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s)⇌C(g)+D(g),下列描述中能表明反应已达到平衡状态的有
①容器内温度不变
②混合气体的密度不变
③混合气体的压强不变
④混合气体的平均相对分子质量不变
⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1
⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成nmolD,同时生成2nmolA
(3)在一定容密闭容器中,保持一定的温度,在一定条件下进行以下反应:A(g)+2B(g)⇌3C(g),已知加入1molA和3molB,达到平衡后,生成amolC。在相同的实验条件下,若在同一容器中改为加入2molA和8molB,若要求平衡后C在反应混合物中的百分含量不变,则还应加入C
(4)现有反应mA(g)+nB(g)⇌pC(g),达到平衡后,当升高温度时,B的转化率变大;当增大压强时,混合体系中C的质量分数增大,则:
①若B是有色物质,A、C均无色,则加入C(容积不变)时混合物颜色
②若维持容器内压强不变,充入Ne时,混合物的颜色
(5)NH3和NO都是有毒气体,但在催化剂条件下,它们可通过反应得到对环境无害的N2和H2O:4NH3(g)+6NO(g)⇌5N2(g)+6H2O(g) ΔH
已知几种化学键的键能数据如表:
| 共价键 | N≡N | N-H | N≡O | H-O |
| 键能/kJ/mol | 946 | 391 | 607 | 464 |
(6)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图如下:

则c电极的反应方程式为
(7))2023年12月丰城顺利通过了创文明城的验收,文明驾驶就是其中的一条。一种基于碱性燃料电池原理设计的酒精检测仪,负极上的反应为
您最近一年使用:0次
名校
解题方法
10 . 某研究团队以NO和H2为原料,在Fe基催化下有效地合成NH3.回答下列问题:
已知:①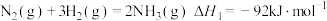
②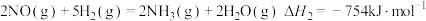
(1)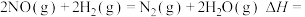
___________  。
。
(2)在一定温度下,向一恒容密闭容器中充入0.2molNO(g)和0.5molH2(g),只发生反应②,达到平衡时生成1.7gNH3(g)。下列叙述正确的是___________ (填标号)。
A.当容器内总压强不变时,该反应达到平衡
B.达到平衡时,反应体系放出的热量为37.7kJ
C.平衡后再充入0.2molNO(g)和0.5molH2(g),NO平衡转化率减小
(3)研究发现, 分两步进行:
分两步进行:
第1步: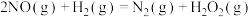 (慢反应);
(慢反应);
第2步:___________ (补充)(快反应)。
加入催化剂,主要是降低第___________ (填“1”或“2”)步反应活化能。
(4) 的反应速率方程式为
的反应速率方程式为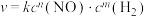 (其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
(其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
根据上述数据计算:m=___________ ,n=___________ ,c=___________ 。
(5)在一密闭反应器中充入2molNO(g)和5molH2(g),在催化剂10Fe﹣8Cu/TiO2作用下发生反应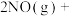
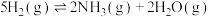 ,
, ,实验测得NO转化率和NH3选择性与温度的关系如图所示。
,实验测得NO转化率和NH3选择性与温度的关系如图所示。

温度高于350℃时,NO转化率增大,但NH3选择性降低,主要原因是___________ 。a点时生成NH3的物质的量为___________ (结果保留3位有效数字)。
(6)某温度下,保持总压强为100kPa,向反应器中充入2molNO(g)和6molH2(g),只发生反应:(a)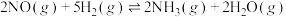 ,(b)
,(b) ,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
___________  (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。
已知:①
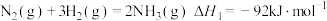
②
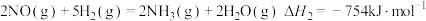
(1)
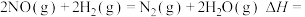
 。
。(2)在一定温度下,向一恒容密闭容器中充入0.2molNO(g)和0.5molH2(g),只发生反应②,达到平衡时生成1.7gNH3(g)。下列叙述正确的是
A.当容器内总压强不变时,该反应达到平衡
B.达到平衡时,反应体系放出的热量为37.7kJ
C.平衡后再充入0.2molNO(g)和0.5molH2(g),NO平衡转化率减小
(3)研究发现,
 分两步进行:
分两步进行:第1步:
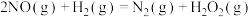 (慢反应);
(慢反应);第2步:
加入催化剂,主要是降低第
(4)
 的反应速率方程式为
的反应速率方程式为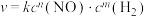 (其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:
(其中,k为常数,只与温度和催化剂有关)。为了测定反应级数m、n,实验结果如下:| 序号 | 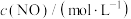 | 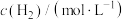 | 速率 |
| I | 0.1 | 0.1 | v |
| II | 0.2 | 0.1 | 4v |
| III | 0.2 | 0.2 | 8v |
| IV | c | 0.4 | 36v |
(5)在一密闭反应器中充入2molNO(g)和5molH2(g),在催化剂10Fe﹣8Cu/TiO2作用下发生反应
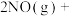
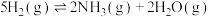 ,
, ,实验测得NO转化率和NH3选择性与温度的关系如图所示。
,实验测得NO转化率和NH3选择性与温度的关系如图所示。
温度高于350℃时,NO转化率增大,但NH3选择性降低,主要原因是
(6)某温度下,保持总压强为100kPa,向反应器中充入2molNO(g)和6molH2(g),只发生反应:(a)
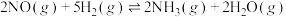 ,(b)
,(b) ,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
,达到平衡时NO转化率为60%,NH3选择性为80%。反应(b)的平衡常数
 (计算结果保留三位有效数字)。
(计算结果保留三位有效数字)。
您最近一年使用:0次
2024-01-19更新
|
164次组卷
|
3卷引用:江西省部分学校2023-2024学年高三上学期12月月考化学试题




