名校
解题方法
1 . 合成氨技术的创立开辟了人工固氮的重要途径。回答下列问题:
(1)德国化学家F.Haber从1902年开始研究 和
和 直接合成
直接合成 在
在 、
、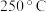 时,将
时,将 和
和 加入
加入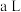 刚性容器中充分反应,测得
刚性容器中充分反应,测得 体积分数为
体积分数为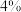 ,其他条件不变,温度升高至
,其他条件不变,温度升高至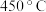 ,测得
,测得 体积分数为
体积分数为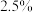 ,则可判断合成氨反应
,则可判断合成氨反应
___________ 0(填“>”或“<”)。
(2)在2L密闭绝热容器中,投入 和
和 ,在一定条件下生成
,在一定条件下生成 ,测得不同温度下,平衡时
,测得不同温度下,平衡时 的物质的量数据如表:
的物质的量数据如表:
①下列能说明该反应已达到平衡状态的是___________ 。
A.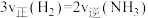 B.容器内气体压强不变
B.容器内气体压强不变
C.混合气体的密度不变 D.混合气的温度保持不变
②温度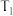
___________ (填“>”“<”或“=”) 。
。
③在 温度下,达到平衡时
温度下,达到平衡时 的体积分数
的体积分数___________ 。
(3)T℃时,在恒温恒容的密闭条件下发生反应: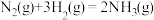 ,反应过程中各物质浓度的变化曲线如图所示:
,反应过程中各物质浓度的变化曲线如图所示:
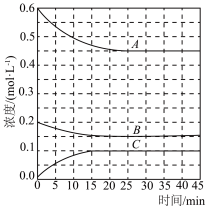
①表示 浓度变化的曲线是
浓度变化的曲线是___________ (填“A”、“B”或“C”)。与(1)中的实验条件( 、
、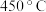 )相比,改变的条件可能是
)相比,改变的条件可能是___________ 。
②在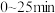 内
内 的平均反应速率为
的平均反应速率为___________ 。在该条件下反应的平衡常数为___________ 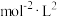 (保留两位有效数字)。
(保留两位有效数字)。
(1)德国化学家F.Haber从1902年开始研究
 和
和 直接合成
直接合成 在
在 、
、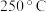 时,将
时,将 和
和 加入
加入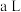 刚性容器中充分反应,测得
刚性容器中充分反应,测得 体积分数为
体积分数为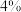 ,其他条件不变,温度升高至
,其他条件不变,温度升高至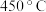 ,测得
,测得 体积分数为
体积分数为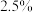 ,则可判断合成氨反应
,则可判断合成氨反应
(2)在2L密闭绝热容器中,投入
 和
和 ,在一定条件下生成
,在一定条件下生成 ,测得不同温度下,平衡时
,测得不同温度下,平衡时 的物质的量数据如表:
的物质的量数据如表:| 温度/K |  |  |  |  |
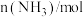 | 3.6 | 3.2 | 2.8 | 2.0 |
A.
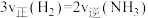 B.容器内气体压强不变
B.容器内气体压强不变C.混合气体的密度不变 D.混合气的温度保持不变
②温度
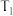
 。
。③在
 温度下,达到平衡时
温度下,达到平衡时 的体积分数
的体积分数(3)T℃时,在恒温恒容的密闭条件下发生反应:
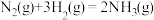 ,反应过程中各物质浓度的变化曲线如图所示:
,反应过程中各物质浓度的变化曲线如图所示:
①表示
 浓度变化的曲线是
浓度变化的曲线是 、
、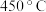 )相比,改变的条件可能是
)相比,改变的条件可能是②在
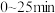 内
内 的平均反应速率为
的平均反应速率为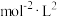 (保留两位有效数字)。
(保留两位有效数字)。
您最近一年使用:0次
名校
2 . 某研究性学习小组利用 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
(1)通过实验_______ (填实验序号)可探究出温度变化对化学反应速率的影响,其中
_______ 。
(2)已知反应后 转化为
转化为 逸出,
逸出, 转化为
转化为 ,每消耗
,每消耗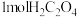 转移
转移_______ mol电子。
(3)若 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是_______ 。忽略溶液体积的变化,利用实验B中0~8s内,用 的浓度变化表示的反应速率
的浓度变化表示的反应速率
_______ 。
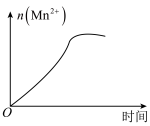
(4)该小组的一位同学通过查阅资料发现,上述实验过程中 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是_______ 。设计实验证明,分别取等体积等浓度的 和
和 混合,平均分成两份,一份中不加任何试剂,一份加入少量
混合,平均分成两份,一份中不加任何试剂,一份加入少量 固体,观察到两溶液都没有褪色,原因是:
固体,观察到两溶液都没有褪色,原因是:_______ 。
 溶液和酸性
溶液和酸性 溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:
溶液的反应探究“外界条件的改变对化学反应速率的影响”,进行了如下实验:| 实验序号 | 实验温度/K | 溶液颜色褪至无色所需时间/s | |||||
酸性 溶液 溶液 |  溶液 溶液 |  | |||||
 |  | 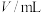 | 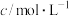 | 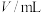 | |||
| A | 293 | 2 | 0.02 | 4 | 0.1 | 0 |  |
| B | T | 2 | 0.02 | 3 | 0.1 |  | 8 |
| C | 313 | 2 | 0.02 |  | 0.1 | 1 |  |
(1)通过实验

(2)已知反应后
 转化为
转化为 逸出,
逸出, 转化为
转化为 ,每消耗
,每消耗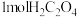 转移
转移(3)若
 ,则由此实验可以得出的结论是
,则由此实验可以得出的结论是 的浓度变化表示的反应速率
的浓度变化表示的反应速率
(4)该小组的一位同学通过查阅资料发现,上述实验过程中
 随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对
随时间的变化情况如图所示,并认为造成这种变化的原因是反应体系中的某种粒子对 与草酸之间的反应有某种特殊作用,则该作用是
与草酸之间的反应有某种特殊作用,则该作用是 和
和 混合,平均分成两份,一份中不加任何试剂,一份加入少量
混合,平均分成两份,一份中不加任何试剂,一份加入少量 固体,观察到两溶液都没有褪色,原因是:
固体,观察到两溶液都没有褪色,原因是:
您最近一年使用:0次
名校
3 . 甲醇、乙醇来源丰富、价格低廉、运输贮存方便,都是重要的化工原料,有着重要的用途和应用前景,可以用多种方法合成。用 生产甲醇、乙醇。
生产甲醇、乙醇。
(1)已知: 的燃烧热为
的燃烧热为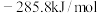 ,
, 的燃烧热为
的燃烧热为 ,
,
 ,则
,则

_______ kJ/mol。
(2)为探究用 生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入
生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入 和
和 在一定条件下发生反应,测得
在一定条件下发生反应,测得 、
、 和
和 的物质的量(n)随时间的变化如图所示:
的物质的量(n)随时间的变化如图所示:

①从反应开始到平衡,氢气的平均反应速率
_______ 。
②下列措施能使 的平衡转化率增大的是
的平衡转化率增大的是_______ (填序号)。
A.在原容器中再充入
B.在原容器中再充入
C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
(3) 也可通过催化加氢合成乙醇,其反应原理为
也可通过催化加氢合成乙醇,其反应原理为
 。设m为起始时的投料比,即
。设m为起始时的投料比,即 。通过实验得到如图所示图象:
。通过实验得到如图所示图象:

①图甲中投料比相同,温度从高到低的顺序为_______ 。
②图乙中 、
、 、
、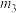 从大到小的顺序为
从大到小的顺序为_______ 。
③图丙表示在总压为5MPa的恒压条件下,且 时,平衡状态时各物质的物质的量分数与温度的关系,
时,平衡状态时各物质的物质的量分数与温度的关系, 温度时,该反应压强平衡常数
温度时,该反应压强平衡常数 的计算表达式为
的计算表达式为_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,代入数据,不用计算)。
 生产甲醇、乙醇。
生产甲醇、乙醇。(1)已知:
 的燃烧热为
的燃烧热为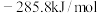 ,
, 的燃烧热为
的燃烧热为 ,
,
 ,则
,则

(2)为探究用
 生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入
生产燃料甲醇的反应原理,在容积为2L的密闭容器中,充入 和
和 在一定条件下发生反应,测得
在一定条件下发生反应,测得 、
、 和
和 的物质的量(n)随时间的变化如图所示:
的物质的量(n)随时间的变化如图所示:
①从反应开始到平衡,氢气的平均反应速率

②下列措施能使
 的平衡转化率增大的是
的平衡转化率增大的是A.在原容器中再充入

B.在原容器中再充入

C.在原容器中充入1mol氦气
D.使用更有效的催化剂
E.缩小容器的容积
(3)
 也可通过催化加氢合成乙醇,其反应原理为
也可通过催化加氢合成乙醇,其反应原理为
 。设m为起始时的投料比,即
。设m为起始时的投料比,即 。通过实验得到如图所示图象:
。通过实验得到如图所示图象:
①图甲中投料比相同,温度从高到低的顺序为
②图乙中
 、
、 、
、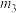 从大到小的顺序为
从大到小的顺序为③图丙表示在总压为5MPa的恒压条件下,且
 时,平衡状态时各物质的物质的量分数与温度的关系,
时,平衡状态时各物质的物质的量分数与温度的关系, 温度时,该反应压强平衡常数
温度时,该反应压强平衡常数 的计算表达式为
的计算表达式为
您最近一年使用:0次
解答题-原理综合题
|
适中(0.65)
|
4 . 我国氢能源汽车已经开始销售,氢能源的热值高、无污染,使其成为理想的能源,工业上量产化制氢原理是:CH4(g)+2H2O(g)  CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。
(1)相关化学键键能数据如下表所示。
则a=___________ 。
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。

①220℃时,经过2min达到M点,则该条件下0~2min内的平均反应速率
___________ ;无分子筛膜时,升高温度,反应速率 将
将___________ (选填“增大”、“减小” 或“不变”)。
②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是___________ 。
(3)工业上利用 CO2和H2制备甲醇的容器中存在的反应有:
反应Ⅰ:CO2(g) + 3H2(g) H2O(g) + CH3OH(g)
H2O(g) + CH3OH(g)
反应Ⅱ:CO2(g) + 4H2(g) 2H2O(g) + CH4(g)
2H2O(g) + CH4(g)
反应Ⅲ:2CO2(g) + 6H2(g) 4H2O(g) + C2H4(g)
4H2O(g) + C2H4(g)
为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol CO2和5.3mol H2。若测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:

①该催化剂在较低温度时主要选择反应___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
②研究发现,若温度过高,三种含碳产物的物质的量均会迅速降低,其主要原因可能是___________ 。
③在一定温度下达到平衡,此时测得容器中部分物质的含量 ,
,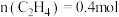 ,
,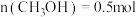 。则该温度下反应Ⅰ的平衡常数K=
。则该温度下反应Ⅰ的平衡常数K=_______  (结果保留两位小数)。
(结果保留两位小数)。
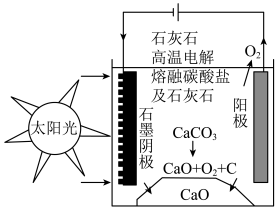
(4)研究人员研究出一种方法,可实现水泥生产时 零排放,其基本原理如图所示。温度小于
零排放,其基本原理如图所示。温度小于 时进行电解反应,碳酸钙先分解为
时进行电解反应,碳酸钙先分解为 和
和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为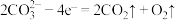 ,则阴极的电极反应为
,则阴极的电极反应为___________ 。
 CO2(g)+4H2(g) ΔH=akJ/mol。
CO2(g)+4H2(g) ΔH=akJ/mol。(1)相关化学键键能数据如下表所示。
| 化学键 | H-H | C=O | H-O | C-H |
 | 435 | 745 | 463 | 415 |
(2)关于上述反应中CO2产物的再利用一直是科研工作者研究的重点。工业上利用 CO2和
 制备甲醇的原理是:CO2(g) + 3H2(g)
制备甲醇的原理是:CO2(g) + 3H2(g) H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和
H2O(g) + CH3OH(g),现研究温度及分子筛膜(用分子筛膜代替容器器壁,该膜只允许极性分子通过)对甲醇平衡产率的影响。将CO2和 初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
初始投料分别按1.0mol/L和4.0mol/L充入恒容容器中,温度及分子筛膜对甲醇平衡产率的影响如图所示。
①220℃时,经过2min达到M点,则该条件下0~2min内的平均反应速率

 将
将②其他条件不变,有分子筛膜时甲醇的平衡产率总是高于没有分子筛膜,其原因可能是
(3)工业上利用 CO2和H2制备甲醇的容器中存在的反应有:
反应Ⅰ:CO2(g) + 3H2(g)
 H2O(g) + CH3OH(g)
H2O(g) + CH3OH(g) 反应Ⅱ:CO2(g) + 4H2(g)
 2H2O(g) + CH4(g)
2H2O(g) + CH4(g)反应Ⅲ:2CO2(g) + 6H2(g)
 4H2O(g) + C2H4(g)
4H2O(g) + C2H4(g) 为分析催化剂对反应的选择性,在1L恒容密闭容器中充入2.0 mol CO2和5.3mol H2。若测得反应进行相同时间后,有关物质的物质的量随温度变化如图所示:

①该催化剂在较低温度时主要选择反应
②研究发现,若温度过高,三种含碳产物的物质的量均会迅速降低,其主要原因可能是
③在一定温度下达到平衡,此时测得容器中部分物质的含量
 ,
,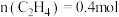 ,
,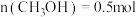 。则该温度下反应Ⅰ的平衡常数K=
。则该温度下反应Ⅰ的平衡常数K= (结果保留两位小数)。
(结果保留两位小数)。(4)研究人员研究出一种方法,可实现水泥生产时
 零排放,其基本原理如图所示。温度小于
零排放,其基本原理如图所示。温度小于 时进行电解反应,碳酸钙先分解为
时进行电解反应,碳酸钙先分解为 和
和 ,电解质为熔融碳酸钠,阳极的电极反应为
,电解质为熔融碳酸钠,阳极的电极反应为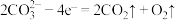 ,则阴极的电极反应为
,则阴极的电极反应为
您最近一年使用:0次
名校
5 . 将2molA和2molB混合于2L的密闭容器中,发生如下反应:3A(g)+B(s) xC(g)+2D(g),反应5min后,测得D的浓度为0.5mol/L,以C表示的平均反应速率v(C)=0.1mol/(L·min),下列说法正确的是
xC(g)+2D(g),反应5min后,测得D的浓度为0.5mol/L,以C表示的平均反应速率v(C)=0.1mol/(L·min),下列说法正确的是
 xC(g)+2D(g),反应5min后,测得D的浓度为0.5mol/L,以C表示的平均反应速率v(C)=0.1mol/(L·min),下列说法正确的是
xC(g)+2D(g),反应5min后,测得D的浓度为0.5mol/L,以C表示的平均反应速率v(C)=0.1mol/(L·min),下列说法正确的是| A.该反应方程式中,x=1 |
| B.5min时,A的物质的量为0.5mol |
| C.以B表示的平均反应速率为v(B)=0.05mol/(L·min) |
| D.5min后,向容器中再添加2molB,会使反应速率加快 |
您最近一年使用:0次
6 . 甲醇、二甲醚(CH3OCH3)是一种可再生能源,具有广泛的开发和应用前景。工业上一般采用下列两种反应合成甲醇。
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
(1)在一定条件下将2molCO和6molH2充入2L的密闭容器中发生反应Ⅰ,5min后测得c(CO)=0.4mol·L-1,计算可得此段时间的反应速率(用H2表示)为_______ mol·L-1·min-1。
(2)由表中数据判断ΔH1_______ (填“>”“<”或“=”)0;反应CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH3=_______ (用ΔH1和ΔH2表示)。
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO平衡转化率的是_______ (填序号)。
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)⇌CH3CHO(g)。反应速率 =
= 正-
正- 逆=k正P(CO)·P(CH4)-k逆P(CH3CHO),
逆=k正P(CO)·P(CH4)-k逆P(CH3CHO), 、
、 分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5(kPa)-1,则CO的转化率为20%时,
分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5(kPa)-1,则CO的转化率为20%时,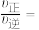
_______ 。
反应Ⅰ:CO(g)+2H2(g)⇌CH3OH(g) ΔH1
反应Ⅱ:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(KⅠ):
| 温度 | 250℃ | 300℃ | 350℃ |
| KⅠ | 2.0 | 0.27 | 0.012 |
(2)由表中数据判断ΔH1
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO平衡转化率的是
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)在T2K、1.0×104kPa下,等物质的量的CO与CH4混合气体发生如下反应:CO(g)+CH4(g)⇌CH3CHO(g)。反应速率
 =
= 正-
正- 逆=k正P(CO)·P(CH4)-k逆P(CH3CHO),
逆=k正P(CO)·P(CH4)-k逆P(CH3CHO), 、
、 分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5(kPa)-1,则CO的转化率为20%时,
分别为正、逆向反应速率常数,p为气体的分压(气体分压p=气体总压p总×体积分数)。用气体分压表示的平衡常数KP=4.5×10-5(kPa)-1,则CO的转化率为20%时,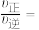
您最近一年使用:0次
名校
解题方法
7 . 丙烯是重要的有机化工原料,丙烷脱氢是工业生产丙烯的重要途径,其化学方程式为 。回答下列相关问题:
。回答下列相关问题:
(1)已知:I.
II.
则丙烷脱氢制丙烯反应 的
的 为
为___________  ,该反应在
,该反应在___________ (填“高温”“低温”“任何温度”)条件下可以自发进行。
(2)一定温度下,向1L的密闭容器中充入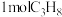 发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.5倍。
发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.5倍。
① 丙烯的化学反应速率
丙烯的化学反应速率
___________  。
。
②欲提高丙烷转化率,采取的措施是___________ 。
A.降低温度 B.升高温度 C.加催化剂 D.及时分离出
③若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是___________ 。
(3)一定温度下,向1L恒容密闭容器中充入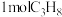 ,开始压强为
,开始压强为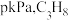 的气体体积分数与反应时间的关系如图:
的气体体积分数与反应时间的关系如图:

此温度下该反应的平衡常数
___________ (用含字母p的代数式表示, 是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×气体的体积分数)。保持温度不变,若此时将混合体系中各组分各物质的量均增加0.1mol,则V正
是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×气体的体积分数)。保持温度不变,若此时将混合体系中各组分各物质的量均增加0.1mol,则V正___________ V逆(填“大于”“小于”“等于”)。
 。回答下列相关问题:
。回答下列相关问题:(1)已知:I.

II.

则丙烷脱氢制丙烯反应
 的
的 为
为 ,该反应在
,该反应在(2)一定温度下,向1L的密闭容器中充入
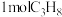 发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.5倍。
发生脱氢反应,经过10min达到平衡状态,测得平衡时气体压强是开始的1.5倍。①
 丙烯的化学反应速率
丙烯的化学反应速率
 。
。②欲提高丙烷转化率,采取的措施是
A.降低温度 B.升高温度 C.加催化剂 D.及时分离出

③若在恒温、恒压的密闭容器中充入丙烷和氩气发生脱氢反应,起始
 越大,丙烷的平衡转化率越大,其原因是
越大,丙烷的平衡转化率越大,其原因是(3)一定温度下,向1L恒容密闭容器中充入
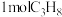 ,开始压强为
,开始压强为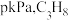 的气体体积分数与反应时间的关系如图:
的气体体积分数与反应时间的关系如图:
此温度下该反应的平衡常数

 是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×气体的体积分数)。保持温度不变,若此时将混合体系中各组分各物质的量均增加0.1mol,则V正
是用反应体系中气体物质的分压表示的平衡常数,平衡分压=总压×气体的体积分数)。保持温度不变,若此时将混合体系中各组分各物质的量均增加0.1mol,则V正
您最近一年使用:0次
2023-12-03更新
|
53次组卷
|
2卷引用:四川省广安市华蓥中学2023-2024学年高二上学期11月期中化学试题
名校
解题方法
8 . 合成氨工业对化工发展和国防工业具有重要意义,可以进一步获取氮肥和硝酸。工业合成氨生产流程如图所示。已知 。回答下列问题。
。回答下列问题。

(1)工业合成氨中对原料气必须净化的原因是___________ 。铁触媒为 的原因是
的原因是___________ 。
(2)Y气体是___________ ,分离X气体的目的是___________ 。
(3)某实验小组在实验室中模拟合成氨过程,在 时,将
时,将 和
和 置于恒温、体积为
置于恒温、体积为 的容器中反应。测得氨气的浓度随时间变化的曲线如图所示。
的容器中反应。测得氨气的浓度随时间变化的曲线如图所示。

①则用氢气表示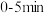 的化学反应速率为
的化学反应速率为
___________ 。反应结束时 的转化率为
的转化率为___________ 。
②下列情况能判断反应已达平衡的是___________ 。
A. 与
与 浓度比为
浓度比为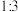
B.混合气体密度不变
C.混合气体压强不变
D.生成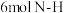 键同时生成
键同时生成 键
键
(4)工业上采取以下措施提高原料利用率,其中能用勒夏特列原理解释的是___________。
 。回答下列问题。
。回答下列问题。
(1)工业合成氨中对原料气必须净化的原因是
 的原因是
的原因是(2)Y气体是
(3)某实验小组在实验室中模拟合成氨过程,在
 时,将
时,将 和
和 置于恒温、体积为
置于恒温、体积为 的容器中反应。测得氨气的浓度随时间变化的曲线如图所示。
的容器中反应。测得氨气的浓度随时间变化的曲线如图所示。
①则用氢气表示
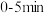 的化学反应速率为
的化学反应速率为
 的转化率为
的转化率为②下列情况能判断反应已达平衡的是
A.
 与
与 浓度比为
浓度比为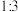
B.混合气体密度不变
C.混合气体压强不变
D.生成
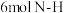 键同时生成
键同时生成 键
键(4)工业上采取以下措施提高原料利用率,其中能用勒夏特列原理解释的是___________。
| A.加入催化剂 | B.增大反应容器的压强 |
| C.升高温度 | D.设法分离产生的氨 |
您最近一年使用:0次
名校
解题方法
9 . 相同温度下,分别在起始体积均为 的两个密闭容器中发生反应:
的两个密闭容器中发生反应: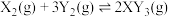
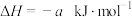 ,实验测得反应的有关数据如下表。
,实验测得反应的有关数据如下表。
下列叙述正确的是
 的两个密闭容器中发生反应:
的两个密闭容器中发生反应: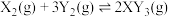
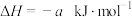 ,实验测得反应的有关数据如下表。
,实验测得反应的有关数据如下表。| 容器 | 反应条件 | 起始物质的量/mol | 达到平衡所用时间/min | 达到平衡过程中的能量变化 | ||
| X2 | Y2 | XY3 | ||||
| ① | 恒容 | 1 | 3 | 0 | 10 | 放热0.1akJ |
| ② | 恒压 | 1 | 3 | 0 | t | 放热bkJ |
| A.反应②的平衡常数K约为0.0046 |
| B.①中:从开始至10min内的平均反应速率v(X2)=0.1mol-1·L·min-1 |
| C.②中:X2的平衡转化率小于10% |
| D.b>0.1a |
您最近一年使用:0次
名校
解题方法
10 . 在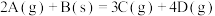 反应中,表示反应速率最快的是
反应中,表示反应速率最快的是
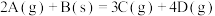 反应中,表示反应速率最快的是
反应中,表示反应速率最快的是A. | B. |
C. | D. |
您最近一年使用:0次
2023-11-28更新
|
142次组卷
|
2卷引用:四川省泸县第一中学2023-2024学年高二上学期12月月考化学试题



