1 . 我国考古人员在秦陵挖掘的宝剑,到现们还是锋利无比,原因是剑锋上面覆盖了一层铬。
(1)写出Cr的外围电子排布式_______ 。与铬同周期的所有元素中基态原子最外层电子数与铬原子相同的元素是__________ 。
(2)根据下表Cr原子的能级电离能(I:k]/mol)数据,解释原子逐级电离能增大的原因:_______ 。
(2)CrCl3·6H2O有三种水合异构体,蓝绿色的[Cr(H2O)5C1]Cl2·6H2O,绿色的[Cr(H2O)4C12]Cl·6H2O和紫色的______ ,其中Cr的配体水分子也可以被NH3置换,如[Cr(NH3)5Cl]2+,则NH3的VSEPR模型为_____ ,N的杂化方式为________ ,写出NH3的一种等电子体___________ 。
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是___________ 。
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是__________
A.Na B.Po C.Mg D.Cu
②晶胞中Cr的配位数为_________
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏伽德罗常数用NA表示,则Cr的原子半径是__ pm.(写出表达式即可)
(1)写出Cr的外围电子排布式
(2)根据下表Cr原子的能级电离能(I:k]/mol)数据,解释原子逐级电离能增大的原因:
| I1 | I2 | I3 | I4 | I5 | I6 | I7 |
| 652.9 | 1590.6 | 2987 | 4743 | 6702 | 8744.9 | 15455 |
(4)CrO3能将CH3CH2OH氧化为乙醛,二者的相对分子质量相近,但乙醇的沸点比乙醛高,原因是
(5)Cr晶体的堆积模型是体心立方堆积。
①下列金属晶体也采取这种堆积模型的是
A.Na B.Po C.Mg D.Cu
②晶胞中Cr的配位数为
③已知Cr的相对原子质量为M,Cr的密度为ρg/cm3,阿伏伽德罗常数用NA表示,则Cr的原子半径是
您最近一年使用:0次
2 . 物质的组成与结构决定了物质的性质与变化。请回答下列问题:
(1)C、H、N、O四种元素中电负性最大的是____ (填元素符号),写出Fe2+的最外层电子排布式____ 。
(2)根据等电子原理,写出CN-的电子式___ ,CNO-中心原子的杂化方式为 ________ 。
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是___ (用化学式表示),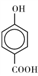 的沸点比
的沸点比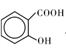
____ (填“高”或“低”);原因是______________________ .
(4)铁有δ、γ、α三种同素异形体,如下图所示。
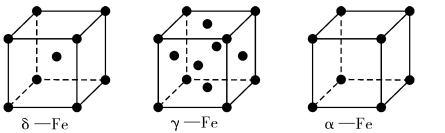
γ -Fe晶体的一个晶胞中所含有的铁原子数为____ ,δ一Fe、α- Fe两种晶胞中铁原子的配位数之比为____ 。已知δ-Fe晶体的密度为dg/cm3,NA表示阿伏伽德罗常数的数值,则Fe原子半径为____ pm(列表达式)。
(1)C、H、N、O四种元素中电负性最大的是
(2)根据等电子原理,写出CN-的电子式
(3)MgO、CaO两种晶体的结构与NaCl晶体结构相似,则两种离子晶体的熔点由高到低顺序是
 的沸点比
的沸点比
(4)铁有δ、γ、α三种同素异形体,如下图所示。

γ -Fe晶体的一个晶胞中所含有的铁原子数为
您最近一年使用:0次
3 . 某硅酸盐研究所在硅酸盐材料和闪烁晶体等领域研究上取得了重大的成就。
(1)[SiO4]4-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子的轨道表示式是_____________ 。
②与[SiO4]4-互为等电子体的微粒符号是_____________ 任写一种)。
③下图为一种硅氧组群的结构示意图,其离子符号为_____________ ,其中Si原子的杂化方式为_____________ 。
④电负性:Si______ O(填“>”、 “=”或“<” )。
(2)钨酸铅(PWO)是一种闪烁晶体,晶胞结构如图所示。
PWO中钨酸根结构式为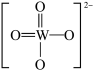 ,该离子中,σ键和π键的个数比是
,该离子中,σ键和π键的个数比是_____________ 。
②PWO晶体中含有的微粒间作用力是___________________
A.范德华力 B.离子键 C.共价键 D.金属键
③已知PWO的摩尔质量为Mg·mol-1,则该晶体的密度d=_____________ g·cm-3。
(1)[SiO4]4-是构成硅酸盐的基本结构单元,通过共用氧相连可形成硅氧组群。
①基态硅原子价电子的轨道表示式是
②与[SiO4]4-互为等电子体的微粒符号是
③下图为一种硅氧组群的结构示意图,其离子符号为

④电负性:Si
(2)钨酸铅(PWO)是一种闪烁晶体,晶胞结构如图所示。
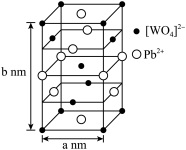
PWO中钨酸根结构式为
 ,该离子中,σ键和π键的个数比是
,该离子中,σ键和π键的个数比是②PWO晶体中含有的微粒间作用力是
A.范德华力 B.离子键 C.共价键 D.金属键
③已知PWO的摩尔质量为Mg·mol-1,则该晶体的密度d=
您最近一年使用:0次
2017-05-11更新
|
430次组卷
|
4卷引用:福建省宁德市2017届高三毕业班第二次质量检查理科综合化学试题
4 . 黑火药是我国古代的四大发明之一,距今已有1000多年的历史,其成分是木炭(C)、硫粉(S)和硝酸钾(KNO3)。回答下列有关问题:
(1)黑火药爆炸生成无毒的气体和K2S,该反应的化学方程式为________________ 。
(2)Se与S同主族,则Se原子的核外电子排布式为〔Ar〕________ ,有____ 对成对电子。
(3)C、N、O、K的电负性由大到小的顺序是_________________ 。
(4)黑火药爆炸除生成K2S外,还生成少量K2S2,其结构类似于Na2O2。则K2S2中含有的化学键类型为_______________ 。
(5)K2S遇酸生成H2S,H2S分子中,S原子的杂化轨道类型是_________ ;KNO3可电离出NO3-,NO3-的空间构型是______________ 。
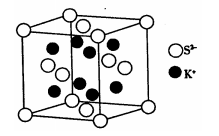
(6)K2S的晶胞结构如图所示。其中K+的配位数为_______ ,若K2S晶体的密度为ρg·cm-3,则晶胞中距离最近的两个S2-核间距为_________ cm(用NA表示阿伏伽德罗常数的值)
(1)黑火药爆炸生成无毒的气体和K2S,该反应的化学方程式为
(2)Se与S同主族,则Se原子的核外电子排布式为〔Ar〕
(3)C、N、O、K的电负性由大到小的顺序是
(4)黑火药爆炸除生成K2S外,还生成少量K2S2,其结构类似于Na2O2。则K2S2中含有的化学键类型为
(5)K2S遇酸生成H2S,H2S分子中,S原子的杂化轨道类型是
(6)K2S的晶胞结构如图所示。其中K+的配位数为
您最近一年使用:0次
填空题
|
较难(0.4)
|
名校
5 . 铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______ 族,其基态原子中未成对电子个数为________ 。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________ ,所含非金属元素的电负性由大到小的顺序是_____________________________ 。
(3)尿素[CO(NH2)2]分子中,碳原子为_______ 杂化,分子中σ键与π键的数目之比为_________ 。
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是________________________________________ 。
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为___________________ 。
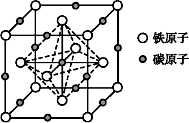
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________ 。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为___________________ pm(阿伏伽德罗常数的值用NA表示,写出简化后的计算式即可)。
(1)钴位于元素周期表的第
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为
(3)尿素[CO(NH2)2]分子中,碳原子为
(4)FeO晶体与NaCl晶体结构相似,比较FeO与NaCl的晶格能大小,还需知道的数据是
(5)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为
(6)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为

您最近一年使用:0次
2017-02-24更新
|
2502次组卷
|
11卷引用:2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷
2017届河南省洛阳市高三第二次统一考试(3月)理综化学试卷江西省上饶市重点中学2018届高三六校第一次联考理综化学试题2020年全国卷Ⅰ理综化学高考真题变式题2017届安徽省A10联盟高三下学期开年考试理综化学试卷吉林省实验中学2018届高三第八次月考(第四次模拟)理科综合化学试题【全国百强校】四川省棠湖中学2019届高三上学期第二次月考理科综合化学试题(已下线)2018年12月9日 《每日一题》一轮复习- 每周一测湖北省黄冈市罗田县第一中学2019届高三上学期12月月考理科综合化学试题(已下线)2019年12月8日 《每日一题》2020年高考化学一轮复习——每周一测陕西省泾干中学2021-2022学年高三上学期第一次月考化学试题广西钦州市第四中学2021-2022学年高三上学期期中考试理综化学试题
名校
解题方法
6 . 新型储氢材料是开发利用氢能的重要研究方向.
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为_____ ,该能层具有的原子轨道数为_____ .
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是_____ ,B原子的杂化轨道类型是_____ .
Li、B、H元素的电负性由大到小排列顺序为_____ .
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+_____ H﹣(填“>”、“=”或“<”).②某储氢材料是第三周期金属元素M的氢化物.M的部分电离能如表所示:
M是_____ (填元素符号).
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为_____ ,NaH的理论密度是___________ g•cm﹣3(只列算式,不必计算出数值,阿伏加德罗常数为NA)
(1)Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得.
①基态Cl原子中,电子占据的最高能层符号为
②LiBH4由Li+和BH4﹣构成,BH4﹣的立体结构是
Li、B、H元素的电负性由大到小排列顺序为
(2)金属氢化物是具有良好发展前景的储氢材料.
①LiH中,离子半径Li+
| I1/kJ•mol﹣1 | I2/kJ•mol﹣1 | I3/kJ•mol﹣1 | I4/kJ•mol﹣1 | I5/kJ•mol﹣1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
M是
(3)NaH具有NaCl型晶体结构,已知NaH晶体的晶胞参数a=488pm(棱长),Na+半径为102pm,H﹣的半径为
您最近一年使用:0次
2016-12-09更新
|
390次组卷
|
7卷引用:2016届山东省邹城一中高三下学期4月模拟考试理科综合化学试卷
7 . 氢能的存储是其应用的主要瓶颈,配位氢化物、富氢载体化合物是目前所采用的主要储氢材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为________ ,该能层具有的原子轨道数为________ 。
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2 2NH3实现储氢和输氢。下列说法正确的是
2NH3实现储氢和输氢。下列说法正确的是( )
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是___________ 。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。在基态Ti2+中,电子占据的最高能层符号为
(2)液氨是富氢物质,是氢能的理想载体,利用N2+3H2
 2NH3实现储氢和输氢。下列说法正确的是
2NH3实现储氢和输氢。下列说法正确的是| A.NH3分子中氮原子的轨道杂化方式为sp2杂化 |
| B.NH4+与PH4+、CH4、BH4-、ClO4-互为等电子体 |
| C.相同压强下,NH3沸点比PH3的沸点高 |
| D.[Cu(NH3)4]2+中,N原子是配位原子 |
(3)已知NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子,其原因是
您最近一年使用:0次
8 . 物质结构与性质》从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质。
(1)下列说法正确的是_______ (填序号)。
A.元素电负性由大到小的顺序为O>N>C
B.一个乙烯分子含2个π键和4个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Al>Mg>Na
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为_______ ;光气(COCl2)各原子最外层都满 足8电子稳定结构,则光气分子的空间构型为_______ (用文字描述);
(3)Cu 2+基态的电子排布式为_______ ;向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中会析出深蓝色的[Cu(NH3)4]SO4晶体,硫酸根离子中硫原子的杂化方式为_______ ;不考虑空间构型,其内界结构可用示意图表示为_______ 。
(1)下列说法正确的是

A.元素电负性由大到小的顺序为O>N>C
B.一个乙烯分子含2个π键和4个σ键
C.氯化钠和氯化铯晶体中氯离子的配位数相同
D.第一电离能的大小为Al>Mg>Na
(2)根据等电子体原理,羰基硫(OCS)分子的结构式为
(3)Cu 2+基态的电子排布式为
您最近一年使用:0次
2013·河北邯郸·二模
9 . 冰晶石(Na3AlF6)是工业上冶炼铝的助熔剂,制取冰晶石(Na3AlF6)的化学方程式为2Al(OH)3+12HF+3A =2Na3AlFs+3CO2+9H2O。
(1)熔融晶体A时痛要破坏的作用力是_______ ,冰晶石中的配位体是______ 。
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为________________ ,该分子的空间构型为___________ 。
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小:____________ ;写出含有其中电负性较小元素的原子,且形成的分子的空间构型呈“V”形的物质的化学式(单质和化合物各写一种)_______________ 、________________ 。
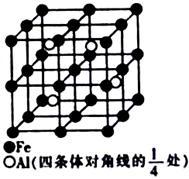
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为_________ 。若晶胞的边长为a nm,则合金的密度为______ g• cm-3。
(1)熔融晶体A时痛要破坏的作用力是
(2)上述反应的生成物中属于非极性分子的中心原子的杂化轨道类型为
(3)上述反应的反应物中有两种元素在元素周期表中的位置相邻,用化学方程式表示二者的电负性大小:
(4)某种Al—Fe合金的晶胞如图所示,该合金的化学式为

您最近一年使用:0次
2012·河南焦作·一模
10 . (15分) 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题:
(1)请写出元素O的基态原子电子排布式_____________ 。
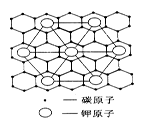
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图,则x值为_____ 。
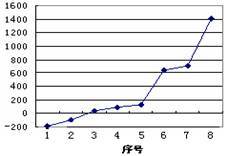
(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表________ (填元素符号);其中电负性最大的是___________ (填图中的序号)。
(4)由i原子跟d原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为__________ ,d原子的杂化类型为_______ 。
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。
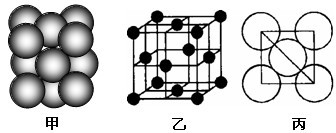
若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,
则该晶体的密度为__________________ g/cm3(用字母表示)。
| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
试回答下列问题:
(1)请写出元素O的基态原子电子排布式
(2)c元素的一种同素异形体与熔融的n单质形成石墨间隙化合物,比较常见的石墨间隙化合物是青铜色的化合物,其化学式可写作CxK,其平面图形见图,则x值为

(3)第三周期8种元素按单质熔点高低的顺序如图,其中序号“8”代表

(4)由i原子跟d原子以1 : 1相互交替结合而形成的晶体,晶型与晶体j相同。则i与d形成的晶体中一个晶胞中含有4个i原子;与同一个i原子相连的d原子构成的空间构型为
(5)i单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。

若已知i的原子半径为dcm,NA代表阿伏加德罗常数,i的相对原子质量为M,
则该晶体的密度为
您最近一年使用:0次



