名校
解题方法
1 . 高铁酸钾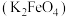 是一种环保、高效的饮用水处理剂。
是一种环保、高效的饮用水处理剂。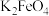 能溶于水,微溶于浓
能溶于水,微溶于浓 溶液,难溶于无水乙醇,在水处理时可转化为
溶液,难溶于无水乙醇,在水处理时可转化为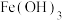 胶体。制备
胶体。制备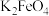 的流程如图所示,下列说法不正确的是
的流程如图所示,下列说法不正确的是
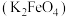 是一种环保、高效的饮用水处理剂。
是一种环保、高效的饮用水处理剂。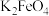 能溶于水,微溶于浓
能溶于水,微溶于浓 溶液,难溶于无水乙醇,在水处理时可转化为
溶液,难溶于无水乙醇,在水处理时可转化为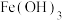 胶体。制备
胶体。制备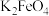 的流程如图所示,下列说法不正确的是
的流程如图所示,下列说法不正确的是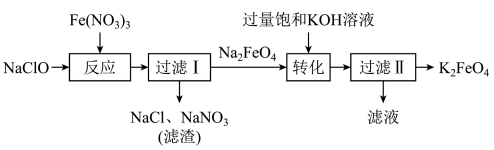
A.可以用滤纸分离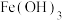 胶体和 胶体和 溶液 溶液 |
B.“反应”中,氧化剂和还原剂的物质的量之比为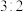 |
C.“转化”说明,该条件下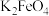 的溶解度小于 的溶解度小于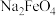 |
D.“过滤Ⅱ”所得的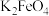 晶体可用无水乙醇洗涤 晶体可用无水乙醇洗涤 |
您最近半年使用:0次
名校
解题方法
2 . 镓被称为“电子工业脊梁”,与铝性质相似。以砷化镓废料(主要成分为 ,含少量
,含少量 等杂质)为原料生产
等杂质)为原料生产 ,工艺流程如图所示。已知砷化镓废料“溶解”后砷以
,工艺流程如图所示。已知砷化镓废料“溶解”后砷以 形式存在;
形式存在;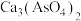 难溶于水。下列说法不正确的是
难溶于水。下列说法不正确的是
 ,含少量
,含少量 等杂质)为原料生产
等杂质)为原料生产 ,工艺流程如图所示。已知砷化镓废料“溶解”后砷以
,工艺流程如图所示。已知砷化镓废料“溶解”后砷以 形式存在;
形式存在;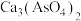 难溶于水。下列说法不正确的是
难溶于水。下列说法不正确的是
| A.砷化“溶解”时温度不宜过高 |
B.“滤渣2”的主要成分为 |
| C.实验室“蒸发结晶”时用到的硅酸盐仪器有酒精灯、烧杯、坩埚、玻璃棒 |
D.“转溶”时发生反应的离子方程式为 |
您最近半年使用:0次
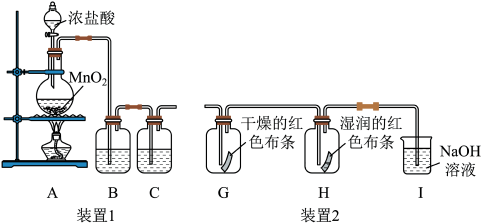
3 . 氯气是一种重要的化工原料,能与有机物和无机物发生反应生成多种氯化物。现用如图装置制取氯气并进行一系列的实验探究。
(1)装置1用来制备纯净、干燥的氯气。
①制备氯气的化学方程式:___________ 。
②B中溶液为___________ ,作用是___________ ,C中液体为___________ ,B和C的位置能否颠倒?___________ (填“能”或“不能”)。
(2)将装置1与装置2连接起来探究氯气是否具有漂白性。
①装置G和H中分别观察到的现象是___________ 。
② 溶液的作用是
溶液的作用是___________ ,写出相应反应的化学方程式:___________ 。工业上常用廉价的石灰乳吸收氯气制得漂白粉,漂白粉的有效成分是___________ (填化学式)。
(3)氯水具有多种成分(分子和离子):
①氯水呈浅黄绿色,是因为有___________ (写化学式)。
②将紫色石蕊溶液滴入新制氯水中,溶液显___________ 色,起作用的微粒是___________ ,一段时间后,溶液的颜色褪去,颜色褪去过程中起作用的微粒是___________ (写化学式)。
(1)装置1用来制备纯净、干燥的氯气。
①制备氯气的化学方程式:
②B中溶液为
(2)将装置1与装置2连接起来探究氯气是否具有漂白性。
①装置G和H中分别观察到的现象是
②
 溶液的作用是
溶液的作用是(3)氯水具有多种成分(分子和离子):
①氯水呈浅黄绿色,是因为有
②将紫色石蕊溶液滴入新制氯水中,溶液显
您最近半年使用:0次
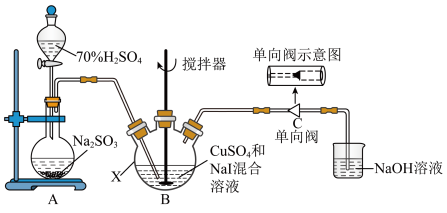
4 . 碘化亚铜(CuI)可用作有机合成催化剂,是一种白色粉末,不溶于水,在空气中相对稳定。实验室制备碘化亚铜的装置如图(部分夹持及加热装置已略去):
I.取50.0gCuSO4∙5H2O、80.0gNaI于仪器B中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
II.打开分液漏斗,将产生的SO2通向黄色沉淀,充分反应后得到白色沉淀;
III.将分离出的白色沉淀经过“系列操作”得到19.1g产品;
IV.测定产品中CuI的纯度。
回答下列问题:
(1)在使用分液漏斗组装发生装置之前必需进行的操作是_______ 。
(2)已知步骤I中的黄色沉淀含CuI和一种单质,制备CuI的化学方程式为_______ 。
(3)步骤II通入SO2的主要目的是_______ 。写出通入SO2所发生的离子方程式_______ 。
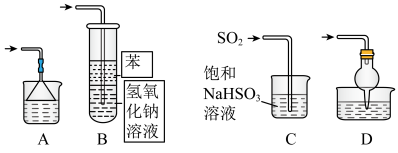
(4)下图中能起到与单向阀C相同作用的是_______ 。(下图容器中未标注的液体均为氢氧化钠溶液)_______ %(保留一位小数),据此推算CuI的产率接近于_______ (填标号)。
I.取50.0gCuSO4∙5H2O、80.0gNaI于仪器B中,加入适量蒸馏水溶解,搅拌,得到黄色沉淀;
II.打开分液漏斗,将产生的SO2通向黄色沉淀,充分反应后得到白色沉淀;
III.将分离出的白色沉淀经过“系列操作”得到19.1g产品;
IV.测定产品中CuI的纯度。
回答下列问题:
(1)在使用分液漏斗组装发生装置之前必需进行的操作是
(2)已知步骤I中的黄色沉淀含CuI和一种单质,制备CuI的化学方程式为
(3)步骤II通入SO2的主要目的是
(4)下图中能起到与单向阀C相同作用的是
您最近半年使用:0次
5 . 下列反应中电子转移的表示方法正确的是
A.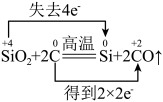 |
B.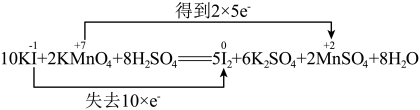 |
C. |
D.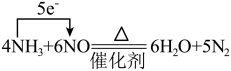 |
您最近半年使用:0次
解题方法
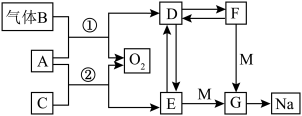
6 . A~G均代表常见化合物,且A、D、E、F、G均含同种金属阳离子,转化关系如图所示,C在常温下为液体,F俗称为小苏打,请回答下列问题:_______ ,F→D:_______ 。
(2)电解熔融G可得到钠和黄绿色气体,该反应的化学方程式为_______ 。
(3)请写出反应②的离子方程式:_____ ,该反应中的氧化剂与还原剂的质量之比为______ 。
(4)检验 溶液中是否存在
溶液中是否存在 的操作及现象为
的操作及现象为_______ 。
(5)取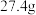 由
由 和
和 组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重
组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重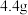 (不考虑气体的逸出),则加热时发生反应的化学方程式为
(不考虑气体的逸出),则加热时发生反应的化学方程式为_______ ,原固体粉末中 的质量分数为
的质量分数为_______ (保留三位有效数字)。
(2)电解熔融G可得到钠和黄绿色气体,该反应的化学方程式为
(3)请写出反应②的离子方程式:
(4)检验
 溶液中是否存在
溶液中是否存在 的操作及现象为
的操作及现象为(5)取
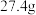 由
由 和
和 组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重
组成的某固体粉末充分加热,将产生的全部气体依次通过浓硫酸和碱石灰,碱石灰增重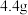 (不考虑气体的逸出),则加热时发生反应的化学方程式为
(不考虑气体的逸出),则加热时发生反应的化学方程式为 的质量分数为
的质量分数为
您最近半年使用:0次
名校
7 . 近年来,利用SRB(硫酸盐还原菌)治理废水中的有机物、 及重金属污染取得了新的进展。
及重金属污染取得了新的进展。
(1)图1表示 和
和 在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样
在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样 ,在SRB的作用下,废水中的有机物(主要为
,在SRB的作用下,废水中的有机物(主要为 )将
)将 还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化:
还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化:____________ 。 还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如图2所示。
还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如图2所示。______ 。
②负极附近的 的变化:
的变化:______ (“减小”或“增大”)。
(3)SRB可用于处理废水中含重金属锑(Sb)的离子。
①通过两步反应将 转化为
转化为 除去,转化过程中有单质生成。完成第一步反应的离子方程式。
除去,转化过程中有单质生成。完成第一步反应的离子方程式。
第一步________
______ ______
______ _______+______↓+______
_______+______↓+______
第二步:
 及重金属污染取得了新的进展。
及重金属污染取得了新的进展。(1)图1表示
 和
和 在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样
在水溶液中各种微粒物质的量分数随pH的变化曲线。某地下水样 ,在SRB的作用下,废水中的有机物(主要为
,在SRB的作用下,废水中的有机物(主要为 )将
)将 还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化:
还原为-2价硫的化合物,请用离子方程式表示该过程中的化学变化: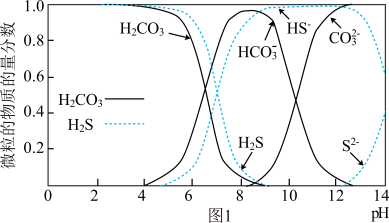
 还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如图2所示。
还能用于构造微生物电池,某pH下该微生物燃料电池的工作原理如图2所示。
②负极附近的
 的变化:
的变化:(3)SRB可用于处理废水中含重金属锑(Sb)的离子。
①通过两步反应将
 转化为
转化为 除去,转化过程中有单质生成。完成第一步反应的离子方程式。
除去,转化过程中有单质生成。完成第一步反应的离子方程式。第一步
______
 ______
______ _______+______↓+______
_______+______↓+______
第二步:

您最近半年使用:0次
解题方法
8 . 特殊的分散系——胶体
把一种或多种物质分散在另一种物质中所得到的体系称为分散系,接照分散质的大小可将分散系分为溶液、胶体和浊液三类。三者之间无明显界限。胶体是物质的一种分散状态,比较稳定,外观上胶体溶液不浑浊,用肉眼或普通显微镜均不能辨别。很多蛋白质、淀粉、血液、淋巴液等都属于胶体。胶体还可以按照分散剂的状态分为固溶胶如有色玻璃、气溶胶如雾、烟和液溶胶如FeOH3胶体。1.胶体可以稳定存在的主要原因是______。
| A.胶体粒子直径在1~100nm之间 | B.胶体具有丁达尔现象 |
| C.胶粒带电 | D.胶体外观均匀 |
| A.在豆浆中加入盐卤做豆腐 |
| B.河流入海处易形成沙洲 |
| C.一束平行光线照射蛋白质溶液时,从侧面可看到光亮的通路 |
| D.三氯化铁溶液中滴入氢氧化钠溶液出现红褐色沉淀 |
| A.蛋白质溶液 | B.氨水 | C.食盐水 | D.酒精溶液 |
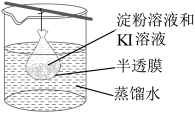
5.在小烧杯中加入20mL蒸馏水加热煮沸后,向沸水申滴入几滴饱和的FeCl3溶液,继续煮沸至溶液呈色即制得FeOH3胶体。
①写出上述胶体制备的化学反应方程式
②取制得的FeOH3胶体装入U形管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,说明氢氧化铁胶粒带
③另取制得的FeOH3胶体于洁净的试管中,向其中逐滴滴加过量稀硫酸,边滴边振荡,观察到的现象是
您最近半年使用:0次
名校
9 . 室温下,下列实验方案能达到探究目的的是
| 选项 | 实验方案 | 探究目的 |
| A | 向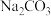 溶液中滴加稀硫酸,反应产生的气体通入 溶液中滴加稀硫酸,反应产生的气体通入 溶液中,观察现象 溶液中,观察现象 | 比较C和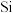 的非金属性 的非金属性 |
| B | 向久置的 溶液中滴加 溶液中滴加 溶液,观察现象 溶液,观察现象 |  溶液是否变质 溶液是否变质 |
| C | 每隔一段时间,用 试纸测定氯水的 试纸测定氯水的 值,记录数据并比较 值,记录数据并比较 | 久置氯水的 如何变化 如何变化 |
| D | 向 溶液中滴加淀粉溶液,再通入 溶液中滴加淀粉溶液,再通入 气体,观察现象 气体,观察现象 | 比较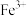 和 和 的氧化性强弱 的氧化性强弱 |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
名校
10 . 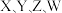 都属于短周期主族元素,
都属于短周期主族元素, 是空气中含量最高的元素,基态
是空气中含量最高的元素,基态 原子的最外层电子数是其电子层数的3倍,
原子的最外层电子数是其电子层数的3倍, 是短周期金属性最强的元素,
是短周期金属性最强的元素, 与
与 同主族。下列说法正确的是
同主族。下列说法正确的是
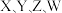 都属于短周期主族元素,
都属于短周期主族元素, 是空气中含量最高的元素,基态
是空气中含量最高的元素,基态 原子的最外层电子数是其电子层数的3倍,
原子的最外层电子数是其电子层数的3倍, 是短周期金属性最强的元素,
是短周期金属性最强的元素, 与
与 同主族。下列说法正确的是
同主族。下列说法正确的是A.原子半径: |
B. 和 和 只能形成一种化合物 只能形成一种化合物 |
C. 元素在周期表中位于第三周期第ⅠA族 元素在周期表中位于第三周期第ⅠA族 |
D. 最高价氧化物对应水化物的酸性在同周期最强 最高价氧化物对应水化物的酸性在同周期最强 |
您最近半年使用:0次



