名校
解题方法
1 . 氮化硅( )是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是
)是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是 在潮湿的空气中易水解,产生白雾,
在潮湿的空气中易水解,产生白雾, 中各元素的化合价与
中各元素的化合价与 相同。
相同。
 )是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是
)是一种高温结构陶瓷材料,它硬度大、熔点高、化学性质稳定。合成氮化硅的一种工艺流程如图所示,下列说法正确的是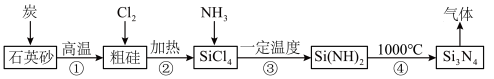
 在潮湿的空气中易水解,产生白雾,
在潮湿的空气中易水解,产生白雾, 中各元素的化合价与
中各元素的化合价与 相同。
相同。A.该流程中可循环使用的物质是 |
| B.第①步反应中产生的气体能使澄清石灰水变浑浊 |
| C.图示①~④的变化中,属于氧化还原反应的是①②③ |
D.第③步反应可用氨水代替 |
您最近半年使用:0次
解题方法
2 . 铝和铝合金是一类重要的金属材料。回答下列问题:
(1)除去镁粉中混有少量铝粉,应加入的试剂为___________ ,发生反应的离子方程式为___________ ,然后经过滤、洗涤、干燥。
(2)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得 在同温同压下的体积之比是
在同温同压下的体积之比是___________ 。
(3)某同学在实验室用铝土矿(含有 和
和 ,不考虑其他杂质)制取金属铝的流程如下:
,不考虑其他杂质)制取金属铝的流程如下: 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为___________ 。
②滤液Ⅱ中溶质的用途之一是___________ 。
(1)除去镁粉中混有少量铝粉,应加入的试剂为
(2)等质量的两份铝分别与足量的盐酸、氢氧化钠溶液反应,所得
 在同温同压下的体积之比是
在同温同压下的体积之比是(3)某同学在实验室用铝土矿(含有
 和
和 ,不考虑其他杂质)制取金属铝的流程如下:
,不考虑其他杂质)制取金属铝的流程如下: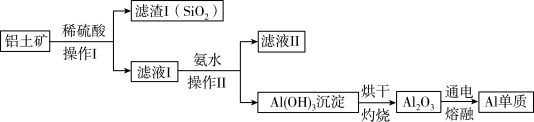
 与稀硫酸反应的离子方程式为
与稀硫酸反应的离子方程式为②滤液Ⅱ中溶质的用途之一是
您最近半年使用:0次
解题方法
3 . 甘肃马家窑遗址出土的青铜刀是我国最早冶炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜绿”,是铜和空气中的水蒸气、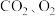 作用产生的,化学式为
作用产生的,化学式为 ,“铜绿”能跟酸反应生成铜盐、
,“铜绿”能跟酸反应生成铜盐、 和
和 。
。
(1) 属于
属于___________ (填“电解质”、“非电解质”)。
(2)从物质分类标准看,“铜绿”属于___________(填字母)。
(3)铜器表面有时会生成铜绿,这层铜绿可用化学方法除去。试写出用盐酸除去铜绿而不损伤器物的反应的离子方程式___________ 。
(4)古代人们高温灼烧孔雀石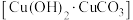 和木炭的混合物得到一种紫红色的金属铜,其化学反应式为
和木炭的混合物得到一种紫红色的金属铜,其化学反应式为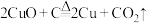 ,该反应属于___________(填序号)。
,该反应属于___________(填序号)。
(5)现代工业以黄铜矿为原料,在炼铜的过程中发生了多个反应,其中有如下两个反应: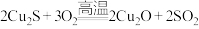 ;
; 。第一个反应中生成
。第一个反应中生成 时,转移的电子数是
时,转移的电子数是___________  ,第二个反应中氧化剂有
,第二个反应中氧化剂有___________ 。如把红色的 固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为:
固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为: 。请用双线桥表示该反应电子转移的方向和数目
。请用双线桥表示该反应电子转移的方向和数目___________ 。
(6)印刷电路板是电子元器件电气连接的提供者,制作印刷电路板主要原料是铜板。在制作过程中产生的铜粉,用稀硫酸和过氧化氢混合溶液溶解,可生成硫酸铜和水,其反应的离子方程式为___________ 。
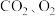 作用产生的,化学式为
作用产生的,化学式为 ,“铜绿”能跟酸反应生成铜盐、
,“铜绿”能跟酸反应生成铜盐、 和
和 。
。(1)
 属于
属于(2)从物质分类标准看,“铜绿”属于___________(填字母)。
| A.酸 | B.碱 | C.盐 | D.氧化物 |
(4)古代人们高温灼烧孔雀石
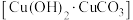 和木炭的混合物得到一种紫红色的金属铜,其化学反应式为
和木炭的混合物得到一种紫红色的金属铜,其化学反应式为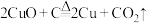 ,该反应属于___________(填序号)。
,该反应属于___________(填序号)。| A.化合反应 | B.置换反应 | C.氧化还原反应 | D.非氧化还原反应 |
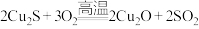 ;
; 。第一个反应中生成
。第一个反应中生成 时,转移的电子数是
时,转移的电子数是 ,第二个反应中氧化剂有
,第二个反应中氧化剂有 固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为:
固体放入稀硫酸中,溶液显蓝色,反应的离子方程式为: 。请用双线桥表示该反应电子转移的方向和数目
。请用双线桥表示该反应电子转移的方向和数目(6)印刷电路板是电子元器件电气连接的提供者,制作印刷电路板主要原料是铜板。在制作过程中产生的铜粉,用稀硫酸和过氧化氢混合溶液溶解,可生成硫酸铜和水,其反应的离子方程式为
您最近半年使用:0次
解题方法
4 . 已知密度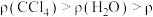 (苯),下列实验操作能够制取
(苯),下列实验操作能够制取 并能较长时间观察到白色沉淀的是
并能较长时间观察到白色沉淀的是
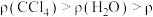 (苯),下列实验操作能够制取
(苯),下列实验操作能够制取 并能较长时间观察到白色沉淀的是
并能较长时间观察到白色沉淀的是A.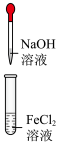 | B.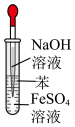 | C.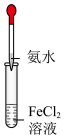 | D.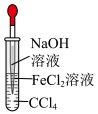 |
您最近半年使用:0次
解题方法
5 . 下列物质中,既含有离子键,又含极性共价键的是
A. | B. | C. | D. |
您最近半年使用:0次
今日更新
|
2次组卷
|
2卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高一上学期1月期末化学试题
解题方法
6 . 下列离子方程式书写错误 的是
A.向 溶液中滴加KI溶液: 溶液中滴加KI溶液: |
B.小苏打用于治疗胃酸过多: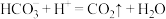 |
C.氯气溶于水: |
D.硫酸铜溶液中滴加氢氧化钡溶液: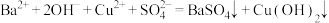 |
您最近半年使用:0次
今日更新
|
7次组卷
|
2卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高一上学期1月期末化学试题
解题方法
7 . 下列各组离子中,能在溶液中大量共存的是
A. 、 、 、 、 、 、 | B. 、 、 、 、 、 、 |
C. 、 、 、 、 、 、 | D. 、 、 、 、 、 、 |
您最近半年使用:0次
今日更新
|
5次组卷
|
2卷引用:黑龙江省绥化市绥棱县第一中学2023-2024学年高一上学期1月期末化学试题
8 . 某兴趣小组探究高锰酸钾和氨水的反应,实验如下:
注:实验中c(KMnO4) = 0.01 mol·L-1。
下列说法不正确 的是
| 序号 | 试剂 | 实验现象 |
| ① | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水+0.5 mL蒸馏水 | 溶液完全褪色所需时间:③<②<①。实验均产生棕褐色固体(经检验为MnO2),都伴有少量气泡产生(经检验为N2)。 |
| ② | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1稀硫酸 | |
| ③ | 2 mL KMnO4溶液 + 1 mL 10 mol·L-1氨水 + 0.5 mL 1 mol·L-1 Na2SO4溶液 | |
| ④ | 2 mL KMnO4溶液 + 1 mL 5 mol·L-1 (NH4)2SO4溶液 + 0.5 mL蒸馏水 | 无明显变化 |
下列说法
A.实验①中发生了反应2 MnO + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O + 2NH3 = 2MnO2 + N2↑ + 2OH- + 2H2O |
B.溶液完全褪色所需时间② < ①的主要原因:c(H+)增大,MnO 的氧化性增强 的氧化性增强 |
C.对比实验③④可得出,还原性:NH3 > NH |
| D.在实验④的试剂中,逐滴加入浓NaOH溶液,可观察到溶液褪色 |
您最近半年使用:0次
解答题-实验探究题
|
较易(0.85)
|
解题方法
9 . 实验室欲用质量分数为98%,密度为1.84 g•cm-3的浓硫酸配制180mL 1.0 mol•L-1稀硫酸。
(1)下列关于容量瓶在配制过程中的使用不正确的是___________ ;
A、可以在容量瓶中直接对浓硫酸进行稀释;
B、使用前不需要对容量瓶进行干燥;
C、可以将配好的稀硫酸保存在容量瓶中。
(2)实验中需要量取浓硫酸的体积为___________ mL,所用量筒的规格为___________ 。
A、5mL B、10mL C、25mL D、50mL
(3)玻璃棒在本实验中的两个作用为___________ 和___________ ;
(4)若出现如下情况,选填“偏高”、“偏低”或“无影响”。
若配制时量取浓硫酸的量筒没有洗涤,所配溶液浓度___________ ;若量取浓硫酸时俯视刻度,所配溶液浓度___________ ;若稀释浓硫酸时,有少许溶液溅到烧杯外面,所配溶液浓度___________ 。
(1)下列关于容量瓶在配制过程中的使用不正确的是
A、可以在容量瓶中直接对浓硫酸进行稀释;
B、使用前不需要对容量瓶进行干燥;
C、可以将配好的稀硫酸保存在容量瓶中。
(2)实验中需要量取浓硫酸的体积为
A、5mL B、10mL C、25mL D、50mL
(3)玻璃棒在本实验中的两个作用为
(4)若出现如下情况,选填“偏高”、“偏低”或“无影响”。
若配制时量取浓硫酸的量筒没有洗涤,所配溶液浓度
您最近半年使用:0次
解题方法
10 . 工业上用FeCl3溶液做印刷电路铜板的腐蚀液。化学小组设计如下流程对腐蚀废液(阳离子主要有H+、Fe3+、Fe2+和Cu2+)进行处理,实现FeCl3溶液再生并回收Cu。___________ ;
(2)步骤Ⅰ的目的是将Fe2+转化为Fe3+,发生反应的离子方程式为___________ ,
(3)步骤Ⅱ中发生反应的离子方程式为___________ ;
(4)调节pH时可选用下列哪些试剂___________。
(5)溶液C中的溶质为___________ (填化学式);
(6)步骤Ⅲ中发生反应的化学方程式为___________ 。
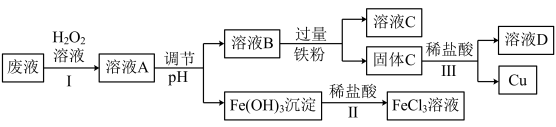
(2)步骤Ⅰ的目的是将Fe2+转化为Fe3+,发生反应的离子方程式为
(3)步骤Ⅱ中发生反应的离子方程式为
(4)调节pH时可选用下列哪些试剂___________。
| A.NaOH | B.Cu(OH)2 | C.Fe | D.CuO |
(5)溶液C中的溶质为
(6)步骤Ⅲ中发生反应的化学方程式为
您最近半年使用:0次



