名校
1 . 8.8 g某有机物C在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重7.2 g和17.6 g,经检验剩余气体为O2.已知C的质谱与红外光谱如图所示。下列说法错误的是

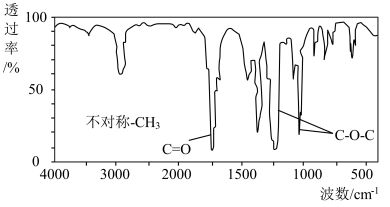
| A.符合C分子结构特征的有机物只有一种 | B.有机物C中含有C、H、O三种元素 |
| C.有机物C的分子式为C4H8O2 | D.有机物C在稀硫酸中可发生取代反应 |
您最近一年使用:0次
2024-05-04更新
|
255次组卷
|
2卷引用:四川省眉山市仁寿第一中学校(北校区)2023-2024学年高二下学期4月月考化学试题
名校
解题方法
2 . 化学推动着社会的进步和人类的发展。下列说法不正确的是
| A.“煤制烯现代化成套技术开发及应用”中煤的气化属于化学变化 |
| B.热压氮化硅具有高强度、低密度、耐高温等优点,是可用于制造汽车发动机的新型耐高温结构材料 |
| C.质检机构从某品牌液态奶中检测出违禁添加物丙二醇,丙二醇是乙醇的同系物 |
D.“嫦娥五号”采集的月壤样本中含有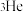 , ,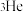 与 与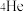 互为同位素 互为同位素 |
您最近一年使用:0次
2024-04-30更新
|
477次组卷
|
3卷引用:2024届四川省眉山市仁寿县四川省仁寿第一中学校(北校区)模拟预测理综试题-高中化学
3 . 研发二氧化碳的利用技术,将二氧化碳转化为能源是减轻环境污染和解决能源问题的方案之一、回答下列问题:
(1)利用CO2合成二甲醚有两种工艺。
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
反应Ⅱ.逆水汽变换:CO2(g)+H2(g) CO(g)+H2O(g) △H2=+41.0kJ/mol
CO(g)+H2O(g) △H2=+41.0kJ/mol
反应Ⅲ.甲醇脱水:2CH3OH(g) CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol
工艺2:反应Ⅳ.2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g) △H
CH3OCH3(g)+3H2O(g) △H
①△H=___________ kJ/mol,反应Ⅳ在___________ (填“低温”“高温”或“任意温度”)下自发进行。
②反应Ⅳ的活化能Ea(正)___________ (填“>”“<"或“=”)Ea(逆)。
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是___________ (填标号)。
A.气体物质中碳元素与氧元素的质量比不变
B.容器内CH3OCH3浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
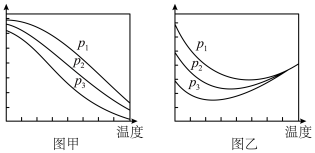
(2)在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇(反应Ⅰ),实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图甲、乙所示。___________ (填标号)。
A.图甲纵坐标表示CH3OH的平衡产率
B.p1<p2<p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是___________ 。
(3)在T1温度下,将3molCO2和7molH2充入2L的恒容密闭容器中发生反应Ⅰ和Ⅳ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为1mol和0.5mol。
①反应经过10min达到平衡,0~10min内CO2的平均反应速率v(CO2)=___________ mol/(L·min)。
②T1温度时反应Ⅰ的平衡常数K=___________ 。
(1)利用CO2合成二甲醚有两种工艺。
工艺1:
涉及以下主要反应:
反应Ⅰ.甲醇的合成:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.0kJ/mol
CH3OH(g)+H2O(g) △H1=-49.0kJ/mol反应Ⅱ.逆水汽变换:CO2(g)+H2(g)
 CO(g)+H2O(g) △H2=+41.0kJ/mol
CO(g)+H2O(g) △H2=+41.0kJ/mol反应Ⅲ.甲醇脱水:2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H3=-23.5kJ/mol工艺2:反应Ⅳ.2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g) △H
CH3OCH3(g)+3H2O(g) △H①△H=
②反应Ⅳ的活化能Ea(正)
③在恒温恒容的密闭容器中,下列说法能判断反应Ⅳ达到平衡的是
A.气体物质中碳元素与氧元素的质量比不变
B.容器内CH3OCH3浓度保持不变
C.容器内气体密度不变
D.容器内气体的平均摩尔质量不变
(2)在不同压强下,按照n(CO2):n(H2)=1:3投料合成甲醇(反应Ⅰ),实验测得CO2的平衡转化率和CH3OH的平衡产率随温度的变化关系如图甲、乙所示。
A.图甲纵坐标表示CH3OH的平衡产率
B.p1<p2<p3
C.为了同时提高CO2的平衡转化率和CH3OH的平衡产率,应选择低温、高压条件
D.一定温度、压强下,提高CO2的平衡转化率的主要方向是寻找活性更高的催化剂
②图乙中,某温度时,三条曲线几乎交于一点的原因是
(3)在T1温度下,将3molCO2和7molH2充入2L的恒容密闭容器中发生反应Ⅰ和Ⅳ,达到平衡状态时CH3OH(g)和CH3OCH3(g)的物质的量分别为1mol和0.5mol。
①反应经过10min达到平衡,0~10min内CO2的平均反应速率v(CO2)=
②T1温度时反应Ⅰ的平衡常数K=
您最近一年使用:0次
名校
解题方法
4 . I.在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出N2H4的电子式________ 。
(2)写出该反应的热化学方程式________ 。
(3)已知H2O(l)=H2O(g) △H=+44kJ/mol,则16g液态肼燃烧生成氮气和液态水时,放出的热量是______ kJ。
(4)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________ 。
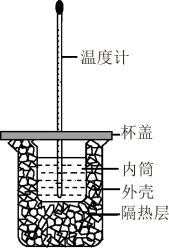
II.中和热的测定是高中重要的定量实验.取0.55moL/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:________ 。
(6)若改用60mL0.25mol•L-1H2SO4和50mL0.55mol•L-1NaOH溶液进行反应与上述实验相比,若实验操作均正确,则所求中和热________ (填“相等”、“不相等”)。
(7)若上述实验测出来的中和热比57.3kJ/mol更小,则产生偏差的原因可能是________ (填字母)。
a.实验装置保温、隔热效果差
b.量取硫酸溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(1)写出N2H4的电子式
(2)写出该反应的热化学方程式
(3)已知H2O(l)=H2O(g) △H=+44kJ/mol,则16g液态肼燃烧生成氮气和液态水时,放出的热量是
(4)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
II.中和热的测定是高中重要的定量实验.取0.55moL/L的NaOH溶液50mL与0.25mol/L的硫酸50mL置于如图所示的装置中进行中和热的测定实验,回答下列问题:
(6)若改用60mL0.25mol•L-1H2SO4和50mL0.55mol•L-1NaOH溶液进行反应与上述实验相比,若实验操作均正确,则所求中和热
(7)若上述实验测出来的中和热比57.3kJ/mol更小,则产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.量取硫酸溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
您最近一年使用:0次
名校
5 . 绿芦笋中含有天门冬氨酸(结构如图)和微量元素硒、铬、锰等,具有提高身体免疫力的功效。回答下列问题:___________ ,其中N原子的杂化轨道类型为___________ ,图中O—C—C的键角___________ C—C—N的键角(填“大于”或“小于”)。
(2) 和
和 热稳定性较好的是
热稳定性较好的是___________ ,从分子结构角度解释其原因:___________ 。
(3)分子结构修饰在药物设计与合成中有广泛的应用。若将天门冬氨酸中的 ,换成
,换成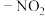 ,得到的新物质的酸性会增强,原因是
,得到的新物质的酸性会增强,原因是___________ 。
(4)四个主族元素部分简单氢化物沸点随周期序数的变化如图所示。其中表示第VIIA族元素简单氢化物沸点变化的是曲线___________ (填字母),O—H…O的键能小于F—H…F,但水的沸点高于HF的原因可能是___________ 。

(2)
 和
和 热稳定性较好的是
热稳定性较好的是(3)分子结构修饰在药物设计与合成中有广泛的应用。若将天门冬氨酸中的
 ,换成
,换成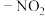 ,得到的新物质的酸性会增强,原因是
,得到的新物质的酸性会增强,原因是(4)四个主族元素部分简单氢化物沸点随周期序数的变化如图所示。其中表示第VIIA族元素简单氢化物沸点变化的是曲线

您最近一年使用:0次
名校
6 . 回答下列问题:
(1)氯化铁是常见的水处理剂,工业上制备无水 的一种工艺如图:
的一种工艺如图:___________ (用离子方程式表示)。
②试写出吸收塔中吸收剂Q是 溶液,反应的离子方程式:
溶液,反应的离子方程式:___________ 。
③温度超过400度,捕集器中收集到的物质的相对分子质量为325,该物质的分子式为___________ 。
④ 的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用
的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用 溶液滴定,用去
溶液滴定,用去 溶液VmL。(已知:
溶液VmL。(已知: )滴定终点的现象是:
)滴定终点的现象是:___________ ,样品中氯化铁的质量分数为___________ (用字母m、c、V来表示)。
(2)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入 和
和 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。___________ 。
②电解NaCl溶液的总反应为___________ 。
(1)氯化铁是常见的水处理剂,工业上制备无水
 的一种工艺如图:
的一种工艺如图: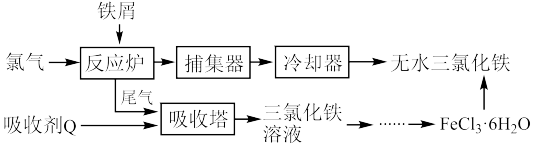
②试写出吸收塔中吸收剂Q是
 溶液,反应的离子方程式:
溶液,反应的离子方程式:③温度超过400度,捕集器中收集到的物质的相对分子质量为325,该物质的分子式为
④
 的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用
的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容后取出10.00mL于锥形瓶中,加入稍过量的KI溶液,充分反应后,滴入淀粉指示剂,用 溶液滴定,用去
溶液滴定,用去 溶液VmL。(已知:
溶液VmL。(已知: )滴定终点的现象是:
)滴定终点的现象是:(2)新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入
 和
和 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。
,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。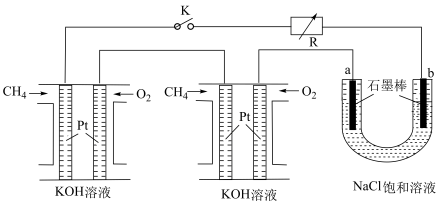
②电解NaCl溶液的总反应为
您最近一年使用:0次
名校
解题方法
7 . 研究发现,铜基催化剂可以促进二氧化碳( )转换成一氧化碳(CO)、甲醛(
)转换成一氧化碳(CO)、甲醛( )或乙烯(
)或乙烯( )及乙醇(
)及乙醇( )等多碳化合物,对于“碳达峰”和“碳中和”目标的顺利实现具有积极推动作用。
)等多碳化合物,对于“碳达峰”和“碳中和”目标的顺利实现具有积极推动作用。
(1)Cu基态原子核外电子排布式为___________ ,该元素位于元素周期表第___________ 族,属于___________ 区。
(2)下列说法正确是___________(填序号)
(3)已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”。根据等电子原理,写出两个与 具有相同空间构型的分子或者离子
具有相同空间构型的分子或者离子___________ 。
(4)在海洋生物作用下形成 ,亦是减缓大气中
,亦是减缓大气中 增加的主要途径。
增加的主要途径。 中的化学键除了σ键外,还存在
中的化学键除了σ键外,还存在___________ 和大π键
(5)已和 在高温高压下所形成的晶体的晶胞如图所示,
在高温高压下所形成的晶体的晶胞如图所示, 的晶胞参数(棱长)apm,其密度为
的晶胞参数(棱长)apm,其密度为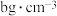 ,则阿伏伽德罗常数为
,则阿伏伽德罗常数为___________ /mol(列出计算式即可)。
 )转换成一氧化碳(CO)、甲醛(
)转换成一氧化碳(CO)、甲醛( )或乙烯(
)或乙烯( )及乙醇(
)及乙醇( )等多碳化合物,对于“碳达峰”和“碳中和”目标的顺利实现具有积极推动作用。
)等多碳化合物,对于“碳达峰”和“碳中和”目标的顺利实现具有积极推动作用。(1)Cu基态原子核外电子排布式为
(2)下列说法正确是___________(填序号)
A. , , , , 的沸点: 的沸点: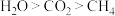 |
B. 分子中含有极性键,是极性分子 分子中含有极性键,是极性分子 |
C. 、 、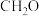 分子中碳原子的杂化方式不同 分子中碳原子的杂化方式不同 |
D.根据价层电子互斥理论,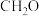 , , , , , , 分子中, 分子中, 的中心原子价层电子对数不同于其他分子 的中心原子价层电子对数不同于其他分子 |
(3)已知具有相同价电子数和相同原子数的分子或离子具有相同的结构,这一原理称为“等电子原理”。根据等电子原理,写出两个与
 具有相同空间构型的分子或者离子
具有相同空间构型的分子或者离子(4)在海洋生物作用下形成
 ,亦是减缓大气中
,亦是减缓大气中 增加的主要途径。
增加的主要途径。 中的化学键除了σ键外,还存在
中的化学键除了σ键外,还存在(5)已和
 在高温高压下所形成的晶体的晶胞如图所示,
在高温高压下所形成的晶体的晶胞如图所示, 的晶胞参数(棱长)apm,其密度为
的晶胞参数(棱长)apm,其密度为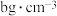 ,则阿伏伽德罗常数为
,则阿伏伽德罗常数为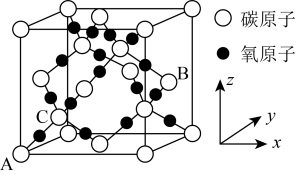
您最近一年使用:0次
名校
8 . X、Y、Z、Q、R、T、U分别代表原子序数依次增大的前20号元素。X原子中K层和L层电子数相等;Y的最高价氧化物对应的水化物化学式为 ;Z可形成氢化物
;Z可形成氢化物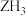 ;Q的一种核素的中子数为14,质量数为28;R最外层电子数为内层电子数的一半;T为同周期非金属性最强的元素;U可与T形成离子化合物
;Q的一种核素的中子数为14,质量数为28;R最外层电子数为内层电子数的一半;T为同周期非金属性最强的元素;U可与T形成离子化合物 。
。
(1)下列X原子的轨道表示式表示的状态中,能量最高的是___________(填序号)
(2) 、
、 中Z原子的杂化形式分别为
中Z原子的杂化形式分别为___________ 和___________ 。
(3)Y单质、Q单质、及QY化合物均为共价晶体,熔点由高到低的排序是___________ (填化学式)。
(4) 空间构型为正四面体形,键角为
空间构型为正四面体形,键角为___________ 度,R的氢化物的沸点低于同族Z的氢化物,其原因是___________ 。
(5)合成氨反应中,催化剂铁表面上铁原子吸附离解的Z原子局部示意图如图所示(图中小黑球代表Z原子,灰球代表铁原子)。则催化剂表面上Z/Fe原子数比为___________ 。
 ;Z可形成氢化物
;Z可形成氢化物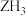 ;Q的一种核素的中子数为14,质量数为28;R最外层电子数为内层电子数的一半;T为同周期非金属性最强的元素;U可与T形成离子化合物
;Q的一种核素的中子数为14,质量数为28;R最外层电子数为内层电子数的一半;T为同周期非金属性最强的元素;U可与T形成离子化合物 。
。(1)下列X原子的轨道表示式表示的状态中,能量最高的是___________(填序号)
A.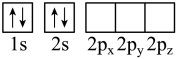 | B.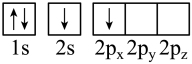 |
C. | D. |
(2)
 、
、 中Z原子的杂化形式分别为
中Z原子的杂化形式分别为(3)Y单质、Q单质、及QY化合物均为共价晶体,熔点由高到低的排序是
(4)
 空间构型为正四面体形,键角为
空间构型为正四面体形,键角为(5)合成氨反应中,催化剂铁表面上铁原子吸附离解的Z原子局部示意图如图所示(图中小黑球代表Z原子,灰球代表铁原子)。则催化剂表面上Z/Fe原子数比为

您最近一年使用:0次
名校
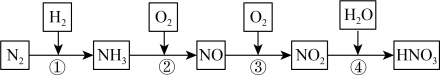
9 . 硝酸在生产生活及国防建设中非常重要,工业制备硝酸的流程如下:________ 填序号)
(2)②反应的化学方程式为_________ ,④反应中还原剂和氧化剂的物质的量之比为________ 。
(3) 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为________ 。
(4)硝酸工厂产生的氮氧化物的尾气需处理后才能排放,可用 溶液吸收。主要反应为
溶液吸收。主要反应为 ,
, 。下列措施能提高
。下列措施能提高 和
和 去除率的有
去除率的有________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(5)也可用 溶液吸收氮氧化物的尾气制备
溶液吸收氮氧化物的尾气制备 。工艺流程如下:
。工艺流程如下: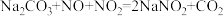
①母液Ⅰ进行转化时通入空气的目的是________ 。母液Ⅱ需回收利用,合理的处理方法是转入流程中________ (填“中和液”或“转化液”)。
②若将 两种产品的物质的量之比设为1:1,则生产
两种产品的物质的量之比设为1:1,则生产 时,
时, 的理论用量为
的理论用量为________ t(假定 恰好完全反应)。
恰好完全反应)。
(2)②反应的化学方程式为
(3)
 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为(4)硝酸工厂产生的氮氧化物的尾气需处理后才能排放,可用
 溶液吸收。主要反应为
溶液吸收。主要反应为 ,
, 。下列措施能提高
。下列措施能提高 和
和 去除率的有
去除率的有A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
(5)也可用
 溶液吸收氮氧化物的尾气制备
溶液吸收氮氧化物的尾气制备 。工艺流程如下:
。工艺流程如下: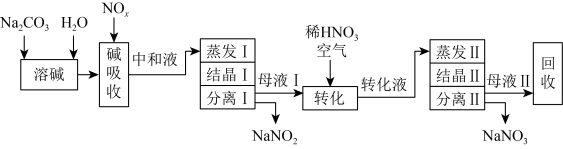
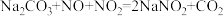
①母液Ⅰ进行转化时通入空气的目的是
②若将
 两种产品的物质的量之比设为1:1,则生产
两种产品的物质的量之比设为1:1,则生产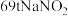 时,
时, 的理论用量为
的理论用量为 恰好完全反应)。
恰好完全反应)。
您最近一年使用:0次
名校
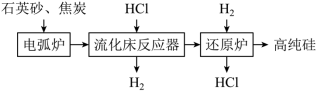
10 . 高纯硅用于制作光伏电池,如图是一种生产高纯硅的工艺流程图: ;
;
②还原炉的主反应: ;
;
③SiHCl3极易水解。回答下列问题:
(1)Si在元素周期表中的位置为________ 。石英砂的主要成分为SiO2,能溶于HF的水溶液,写出其化学方程式________ 。
(2)电弧炉中生成粗硅,反应的化学方程式为________ 。若电弧炉中焦炭过量,还会有SiC生成,石英砂和焦炭生成SiC的反应中,氧化剂和还原剂的物质的量之比为________ 。
(3)整个操作流程都需隔绝空气,原因是________ (答出两条 即可)。
(4)SiHCl3极易发生水解反应,其生成物之一是一种可燃性气体,则SiHCl3水解的化学方程式为________ 。
(5)上述操作流程中可以循环利用的物质是________ 。
 ;
;②还原炉的主反应:
 ;
;③SiHCl3极易水解。回答下列问题:
(1)Si在元素周期表中的位置为
(2)电弧炉中生成粗硅,反应的化学方程式为
(3)整个操作流程都需隔绝空气,原因是
(4)SiHCl3极易发生水解反应,其生成物之一是一种可燃性气体,则SiHCl3水解的化学方程式为
(5)上述操作流程中可以循环利用的物质是
您最近一年使用:0次



