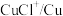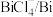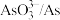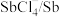真题
解题方法
1 . ⅣA族元素具有丰富的化学性质,其化合物有着广泛的应用。回答下列问题:
(1)该族元素基态原子核外未成对电子数为_____ ,在与其他元素形成化合物时,呈现的最高化合价为_____ 。
(2) 俗称电石,该化合物中不存在的化学键类型为
俗称电石,该化合物中不存在的化学键类型为_____ (填标号)。
a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷 ,其中电负性最大的元素是
,其中电负性最大的元素是_____ ,硅原子的杂化轨道类型为_____ 。
(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:_____ 。
(5)结晶型 可作为放射性探测器元件材料,其立方晶胞如图所示。其中
可作为放射性探测器元件材料,其立方晶胞如图所示。其中 的配位数为
的配位数为_____ 。设 为阿伏加德罗常数的值,则该晶体密度为
为阿伏加德罗常数的值,则该晶体密度为_____  (列出计算式)。
(列出计算式)。
(1)该族元素基态原子核外未成对电子数为
(2)
 俗称电石,该化合物中不存在的化学键类型为
俗称电石,该化合物中不存在的化学键类型为a.离子键 b.极性共价键 c.非极性共价键 d.配位键
(3)一种光刻胶薄膜成分为聚甲基硅烷
 ,其中电负性最大的元素是
,其中电负性最大的元素是(4)早在青铜器时代,人类就认识了锡。锡的卤化物熔点数据如下表,结合变化规律说明原因:
| 物质 | 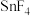 |  |  | 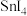 |
熔点/ | 442 | 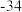 | 29 | 143 |
(5)结晶型
 可作为放射性探测器元件材料,其立方晶胞如图所示。其中
可作为放射性探测器元件材料,其立方晶胞如图所示。其中 的配位数为
的配位数为 为阿伏加德罗常数的值,则该晶体密度为
为阿伏加德罗常数的值,则该晶体密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次
真题
解题方法
2 . 科学家使用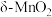 研制了一种
研制了一种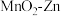 可充电电池(如图所示)。电池工作一段时间后,
可充电电池(如图所示)。电池工作一段时间后, 电极上检测到
电极上检测到 和少量
和少量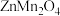 。下列叙述正确的是
。下列叙述正确的是
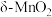 研制了一种
研制了一种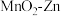 可充电电池(如图所示)。电池工作一段时间后,
可充电电池(如图所示)。电池工作一段时间后, 电极上检测到
电极上检测到 和少量
和少量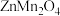 。下列叙述正确的是
。下列叙述正确的是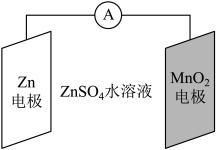
A.充电时, 向阳极方向迁移 向阳极方向迁移 |
B.充电时,会发生反应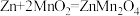 |
C.放电时,正极反应有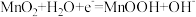 |
D.放电时, 电极质量减少 电极质量减少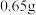 , , 电极生成了 电极生成了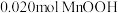 |
您最近一年使用:0次
真题
3 . 我国探月工程取得重大进展。月壤中含有Ca、Fe等元素的磷酸盐,下列元素位于元素周期表第二周期的是
| A.O | B.P | C.Ca | D.Fe |
您最近一年使用:0次
4 . 回答下列问题:
1.AlBr3水解可得Al(OH)3胶体,请解释用Al(OH)3可净水的原因_______ 。
2.用上述制得的胶体做电泳实验时,有某种胶体粒子向阴极移动,该粒子可能是_______。
1.AlBr3水解可得Al(OH)3胶体,请解释用Al(OH)3可净水的原因
2.用上述制得的胶体做电泳实验时,有某种胶体粒子向阴极移动,该粒子可能是_______。
| A.[mAl(OH)3·nAl3+·(3n-x)Br-]x+ |
| B.[mAl(OH)3·nBr-·xAl3+]3x+ |
| C.[mAl(OH)3·nOH-·(n-x)H+]x- |
| D.[mAl(OH)3·nAl3+·(n-x)Br-]x+ |
您最近一年使用:0次
5 . 已知Al2Br6的晶胞如图所示(已知结构为平行六面体,各棱长不相等,Al2Br6在棱心)
2.已知NA= 6.02×1023mol-1,一个晶胞的体积C=5.47×10-22 cm3,求Al2Br6的晶胞密度。_______ 。

| A.4 | B.5 | C.8 | D.12 |
您最近一年使用:0次
2024高三·上海·专题练习
6 . 已知反应Al2Br6(l) 2Al(g) +6Br(g) ΔH
2Al(g) +6Br(g) ΔH
①Al2Br6(s) Al2Br6(l) ΔH1
Al2Br6(l) ΔH1
②Al(s) Al(g) ΔH2
Al(g) ΔH2
③Br2(l) Br2(g) ΔH3
Br2(g) ΔH3
④Br2(g) 2Br(g) ΔH4
2Br(g) ΔH4
⑤2Al(s) + 3Br2(l) Al2Br6(s) ΔH5
Al2Br6(s) ΔH5
则ΔH=_______ 。
由图可知,若该反应自发,则该反应的_______ 。
 2Al(g) +6Br(g) ΔH
2Al(g) +6Br(g) ΔH①Al2Br6(s)
 Al2Br6(l) ΔH1
Al2Br6(l) ΔH1②Al(s)
 Al(g) ΔH2
Al(g) ΔH2③Br2(l)
 Br2(g) ΔH3
Br2(g) ΔH3④Br2(g)
 2Br(g) ΔH4
2Br(g) ΔH4⑤2Al(s) + 3Br2(l)
 Al2Br6(s) ΔH5
Al2Br6(s) ΔH5则ΔH=
由图可知,若该反应自发,则该反应的

您最近一年使用:0次
2024高三·上海·专题练习
7 . 氟单质常温下能腐蚀Fe、Ag等金属,但工业上却可用Cu制容器储存,其原因是_______ 。
您最近一年使用:0次
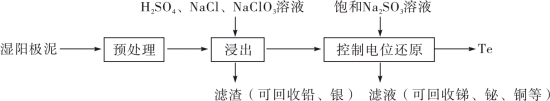
8 . 碲(Te)是一种重要的稀有分散元素,广泛应用于冶金、石油、化工、航空、电子等领域。以某冶炼厂的湿阳极泥(含水26%,主要含锑、砷、铅、铋、银和少量铜、碲等)为原料回收碲的流程如下:
请回答下列问题:
(1)52Te的基态原子的电子排布式为___________ 。
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是_______________ ;氧化后的原料还需粉碎、过筛,目的是_________________ 。
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为___________ 、___________ ;添加 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式________________ 。
(4)电解时为防止除Te以外的单质生成,需控制电位的范围为___________ ;加入饱和Na2SO3溶液还原 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成_____________ (填化学式)。
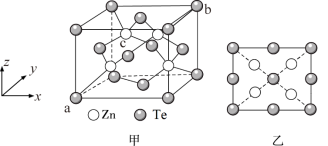
(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为_______________ ,设ZnTe的摩尔质量为M,阿伏加德罗常数的值为NA,密度为dg/cm3,则Zn与Te最近距离为___________ nm(列出计算式即可)。
物质 |
|
|
|
|
|
氧化还原电位(E)/V | 0.342 | 0.568 | 0.16 | 小于0.16 | 小于0.16 |
(1)52Te的基态原子的电子排布式为
(2)原料预处理可采用干燥箱中加热氧化或自然堆放氧化(四天以上)两种方式,两相比较,后者的主要优点是
(3)浸出时,所得滤渣主要含铅、银的化合物,其化学式分别为
 可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出
可显著提高碲和铜的浸出率,说明预处理后的原料中仍存在低价态的碲和铜,写出 转化为
转化为 、
、 而被浸出的离子方程式
而被浸出的离子方程式(4)电解时为防止除Te以外的单质生成,需控制电位的范围为
 可减少电能消耗并防止阳极生成
可减少电能消耗并防止阳极生成(5)将碲与锌一起加热,然后升华可制得碲化锌。碲化锌是一种重要的半导体材料,图甲为它的一种立方晶胞结构,图乙为该晶胞沿z轴投影图。已知a点的坐标为(0,0,0),b点的坐标为(1,1,1),则c点的坐标为
您最近一年使用:0次
7日内更新
|
53次组卷
|
2卷引用:福建省永春一中2023-2024学年高三化学最后一卷试卷
真题
解题方法
9 . 我国学者研发出一种新型水系锌电池,其示意图如下。该电池分别以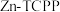 (局部结构如标注框内所示)形成的稳定超分子材料和
(局部结构如标注框内所示)形成的稳定超分子材料和 为电极,以
为电极,以 和
和 混合液为电解质溶液。下列说法错误的是
混合液为电解质溶液。下列说法错误的是
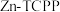 (局部结构如标注框内所示)形成的稳定超分子材料和
(局部结构如标注框内所示)形成的稳定超分子材料和 为电极,以
为电极,以 和
和 混合液为电解质溶液。下列说法错误的是
混合液为电解质溶液。下列说法错误的是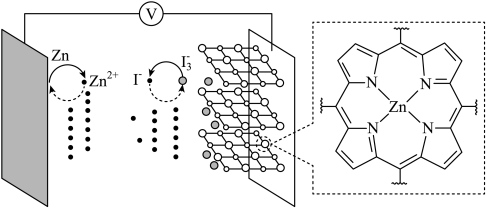
| A.标注框内所示结构中存在共价键和配位键 |
B.电池总反应为: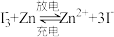 |
C.充电时,阴极被还原的 主要来自 主要来自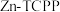 |
D.放电时,消耗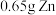 ,理论上转移 ,理论上转移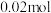 电子 电子 |
您最近一年使用:0次
真题
10 . 下列选项中的物质能按图示路径在自然界中转化,且甲和水可以直接生成乙的是

| 选项 | 甲 | 乙 | 丙 |
| A |  |  |  |
| B |  |  |  |
| C |  |  |  |
| D |  |  |  |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次