10-11高三·安徽合肥·阶段练习
1 . (1)化学反应的焓变与反应物和生成物的键能有关。所谓键能就是:在101.3 kPa、298 K时,断开1 mol气态AB为气态A、气态B时过程的焓变,用ΔH298(AB)表示;断开化学键时ΔH>0[如H2(g)=2H(g) ΔH=" 436" kJ·mol-1],形成化学键时ΔH<0[如2H(g)=H2(g) ΔH =" -" 436 kJ·mol-1]。
已知:H2(g)+Cl2(g)=2HCl(g) ΔH =" -185" kJ·mol-1
ΔH298(H2)=" 436" kJ·mol-1 ,ΔH298(Cl2)=" 247" kJ·mol-1
则ΔH298(HCl)="________________________ " 。
(2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH =" -25" kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH =" -" 47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH =" 19" kJ·mol-1
请写出CO还原FeO的热化学方程式:________________________________________
已知:H2(g)+Cl2(g)=2HCl(g) ΔH =" -185" kJ·mol-1
ΔH298(H2)=" 436" kJ·mol-1 ,ΔH298(Cl2)=" 247" kJ·mol-1
则ΔH298(HCl)="
(2)已知:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH =" -25" kJ·mol-1
3 Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH =" -" 47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH =" 19" kJ·mol-1
请写出CO还原FeO的热化学方程式:
您最近一年使用:0次
11-12高三上·安徽蚌埠·期中
2 . 钾是活泼的碱金属,钾和氧有氧化钾(K2O)、过氧化钾(K2O2)和超氧化钾(KO2)等多种化合物。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3 = 6K2O+N2↑),39.0g钾与10.1g硝酸钾充分反应生成K2O的物质的量为__________ mol。
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为_____________ 。
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO2+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L(标准状况),列式计算反应消耗的KO2的物质的量__________ mol。
(1)钾和硝酸钾反应可制得K2O(10K+2KNO3 = 6K2O+N2↑),39.0g钾与10.1g硝酸钾充分反应生成K2O的物质的量为
(2)某过氧化钾样品中氧的质量分数(杂质不含氧)为0.28,则样品中K2O2的质量分数为
(3)超氧化钾和二氧化碳反应生成氧气(4KO2+2CO2→2K2CO2+3O2),在医院、矿井、潜水、高空飞行中用作供氧剂。13.2L(标准状况)CO2和KO2反应后,气体体积变为18.8L(标准状况),列式计算反应消耗的KO2的物质的量
您最近一年使用:0次
11-12高三上·安徽合肥·阶段练习
3 . 在200 mL含Mg2+、Al3+、NH、H+、Cl-等离子的溶液中,逐滴加入5 mol·L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示。
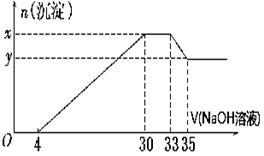
通过计算填写下列空白:
(1). x与y的差为__________________
(2). 原溶液中c(Cl-)=__________________
(3). 原溶液的pH=_____________________
(4). 原溶液中n(Mg2+)∶n(Al3+)=______________________
(5). 所加氢氧化钠溶液体积大于33ml时,反应的离子方程式为____________________________ .

通过计算填写下列空白:
(1). x与y的差为
(2). 原溶液中c(Cl-)=
(3). 原溶液的pH=
(4). 原溶液中n(Mg2+)∶n(Al3+)=
(5). 所加氢氧化钠溶液体积大于33ml时,反应的离子方程式为
您最近一年使用:0次
10-11高一下·安徽合肥·期中
4 . 将等物质的量的A、B混合于2 L的密闭容器中,发生如下反应:3A(g)+B(g)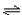 xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min)。试求:
(1)此时A的浓度c(A)=________ mol/L,x的值为________ ;
(2)反应开始前容器中的A、B的物质的量:n(A)=n(B)=________ mol;
(3)平衡时n(A): n(B): n (C): n(D) =_________________________ 。
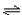 xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min)。试求:
xC(g)+2D(g),经5 min后达平衡状态,此时测得D的浓度为0.5 mol/L,混合气体的总体积为134.4 L(标准状况),C的平均反应速率为0.1 mol/(L·min)。试求:(1)此时A的浓度c(A)=
(2)反应开始前容器中的A、B的物质的量:n(A)=n(B)=
(3)平衡时n(A): n(B): n (C): n(D) =
您最近一年使用:0次
10-11高二下·安徽马鞍山·期中
5 . 氨气是氮循环中的重要物质,在人类的生产和生活中有着广泛的应用。
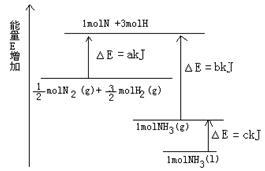
(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是______________________ 。
(2).若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436. 0kJ/mol,则N-H键的键能是________ kJ/mol。

(1)如图是N2与H2反应过程中能量变化的示意图,则该反应生成液态氨的热化学方程式是
(2).若由N2和H2合成1molNH3时可放出46.2kJ/mol的热量。从手册上查出N≡N键的键能是948.9kJ/mol,H-H键的键能是436. 0kJ/mol,则N-H键的键能是
您最近一年使用:0次
10-11高一下·安徽宿州·期中
6 . 一定温度下在10L容器中加入5molSO2和3molO2,当反应达到平衡时,有3molSO2发生了反应,则:
(1)生成了______________ molSO3,SO2的转化率为_________________ (用百分数表示)。
(2)平衡时容器内气体的总物质的量为_________ 。
(3)平衡时SO2的浓度是________ O2的浓度是_________ SO3的浓度是______ 。
(1)生成了
(2)平衡时容器内气体的总物质的量为
(3)平衡时SO2的浓度是
您最近一年使用:0次
10-11高一下·四川雅安·期中
7 . 在一定温度下的5L的密闭固定容积容器中,通入10molNH3,发生了如下反应:N2+3H2 2NH3,反应进行到2min时,测得容器内有2molN2,求:
2NH3,反应进行到2min时,测得容器内有2molN2,求:
(1)2min时的N2的浓度______ ?
(2)2min内的平均速率υ(NH3)=______ ?
(3)反应前后容器中气体压强之比______ ?
(4)NH3的分解率______ ?
 2NH3,反应进行到2min时,测得容器内有2molN2,求:
2NH3,反应进行到2min时,测得容器内有2molN2,求:(1)2min时的N2的浓度
(2)2min内的平均速率υ(NH3)=
(3)反应前后容器中气体压强之比
(4)NH3的分解率
您最近一年使用:0次
10-11高一下·安徽蚌埠·期中
8 . 在一定温度下将3 mol A和1 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+ B(g) C(g)+ 2D(g),2分钟末反应达到平衡状态,D的浓度为0.4 mol·L-1,求
C(g)+ 2D(g),2分钟末反应达到平衡状态,D的浓度为0.4 mol·L-1,求
(1)B的平衡浓度、A的转化率(写出计算过程)______________________ 。
(2)达平衡时,容器内混合气体的平均相对分子质量比起始投料时____________ (填“增大”、“减小”或“相等”)。
(3)达平衡后,若其他条件不变,再向容器中分别加入①3 mol A和1mol B或②1 mol C和2 mol D,重新达到平衡后,与第一次平衡时相比,A的体积分数______________ 。
A.①②都增大B.①②都减小C.①增大,②减小D.②增大,①减小
 C(g)+ 2D(g),2分钟末反应达到平衡状态,D的浓度为0.4 mol·L-1,求
C(g)+ 2D(g),2分钟末反应达到平衡状态,D的浓度为0.4 mol·L-1,求(1)B的平衡浓度、A的转化率(写出计算过程)
(2)达平衡时,容器内混合气体的平均相对分子质量比起始投料时
(3)达平衡后,若其他条件不变,再向容器中分别加入①3 mol A和1mol B或②1 mol C和2 mol D,重新达到平衡后,与第一次平衡时相比,A的体积分数
A.①②都增大B.①②都减小C.①增大,②减小D.②增大,①减小
您最近一年使用:0次
11-12高一上·安徽·期末
9 .  铜片与某浓度的硝酸反应,生成气体的体积在标准状况下为
铜片与某浓度的硝酸反应,生成气体的体积在标准状况下为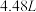 . 铜和硝酸反应的化学方程式为:
. 铜和硝酸反应的化学方程式为:
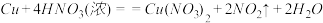
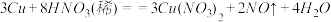
试计算:
(1)被还原的硝酸的物质的量
(2)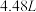 气体中各成分的物质的量
气体中各成分的物质的量
 铜片与某浓度的硝酸反应,生成气体的体积在标准状况下为
铜片与某浓度的硝酸反应,生成气体的体积在标准状况下为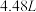 . 铜和硝酸反应的化学方程式为:
. 铜和硝酸反应的化学方程式为: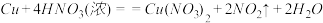
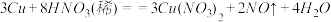
试计算:
(1)被还原的硝酸的物质的量
(2)
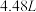 气体中各成分的物质的量
气体中各成分的物质的量
您最近一年使用:0次
10-11高一上·安徽蚌埠·期中
10 . (1)6.20g 白磷(P4)在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为________________ L.上述燃烧生成氧化物溶有于水配成50.0mLH3PO4溶液,该溶液的物质的量浓度为____________ mol ·L-1
(2)含0.300molH3PO4溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2 g水,该难溶盐的化学式可表示为____________ 。
(2)含0.300molH3PO4溶液滴加到含0.500mol Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2 g水,该难溶盐的化学式可表示为
您最近一年使用:0次



