1 . 从物质类别和元素化合价两个维度研究物质的性质及转化是重要的化学学习方法。氯及其化合物有重要用途,右图为氯元素的“价类二维图”的部分信息。请回答下列问题:
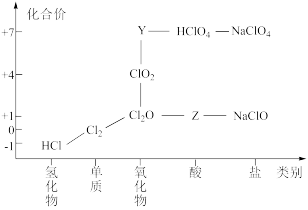
(1)根据图中信息写出Y、Z的化学式___________ 、___________ 。
(2)漂白液的有效成分是___________ ,其使用说明中特别提醒不可与洁厕灵(主要成分盐酸)混合使用,否则会产生Cl2,请用离子方程式表示其原因___________ 。
(3)现以氢氧化钠为原料制备漂白液,需配制100mL 8mol/L NaOH溶液。
①配制NaOH溶液时,需要称取NaOH固体的质量为___________ g;
②下面操作造成所配NaOH溶液浓度偏高的是___________ 。
A.暴露在空气中称量NaOH的时间太长
B.溶解后未冷却至室温就转移至容量瓶
C.若移液前容量瓶内有少量水
D.定容时俯视刻度线
(4)二氧化氯是一种高效消毒剂。工业制备ClO2的反应为:
___NaClO3+___HCl—___ClO2↑+___Cl2↑+___H2O+___NaCl
①配平上述化学方程式并用单线桥 表示反应过程中的电子转移情况。___________
②该反应的氧化剂与还原剂的物质的量之比为___________ ;若反应过程中消耗0.1molNaClO3,转移电子的数目为___________ 。
③ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO ),需将其转化为Cl-除去,下列试剂中可将ClO
),需将其转化为Cl-除去,下列试剂中可将ClO 转化为Cl-的是
转化为Cl-的是___________ (填字母)。
A.O3 B.FeSO4 C.KI D.KMnO4

(1)根据图中信息写出Y、Z的化学式
(2)漂白液的有效成分是
(3)现以氢氧化钠为原料制备漂白液,需配制100mL 8mol/L NaOH溶液。
①配制NaOH溶液时,需要称取NaOH固体的质量为
②下面操作造成所配NaOH溶液浓度偏高的是
A.暴露在空气中称量NaOH的时间太长
B.溶解后未冷却至室温就转移至容量瓶
C.若移液前容量瓶内有少量水
D.定容时俯视刻度线
(4)二氧化氯是一种高效消毒剂。工业制备ClO2的反应为:
___NaClO3+___HCl—___ClO2↑+___Cl2↑+___H2O+___NaCl
①配平上述化学方程式并用
②该反应的氧化剂与还原剂的物质的量之比为
③ClO2在杀菌消毒过程中会产生副产物亚氯酸盐(ClO
 ),需将其转化为Cl-除去,下列试剂中可将ClO
),需将其转化为Cl-除去,下列试剂中可将ClO 转化为Cl-的是
转化为Cl-的是A.O3 B.FeSO4 C.KI D.KMnO4
您最近一年使用:0次
2021-12-08更新
|
305次组卷
|
2卷引用:吉林省吉化第一高级中学校2021-2022学年高二下学期复课检测化学试题
名校
解题方法
2 . 工业废水中过量的氨氮( 和
和 )会导致水体富营养化,其氨氮总量的检测和去除备受关注。
)会导致水体富营养化,其氨氮总量的检测和去除备受关注。
(1)氨氮总量检测
利用氨气传感器检测水体中氨氮含量的示意图:
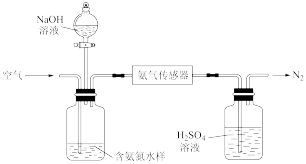
若利用氨气传感器将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为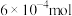 ,则水样中氨氮(以氨气计)含量为
,则水样中氨氮(以氨气计)含量为___________ mg/L。
(2) 氧化法处理氨氮废水
氧化法处理氨氮废水
①写出酸性条件下 氧化
氧化 为氮气的离子反应方程式
为氮气的离子反应方程式___________ 。
②为研究空气对 氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是
氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是___________ (填字母)。
a. 的氧化性比
的氧化性比 弱 b.
弱 b. 氧化氨氮速率比
氧化氨氮速率比 慢 c.空气中的
慢 c.空气中的 进入溶液中
进入溶液中
(3)传统的生物脱氮机理认为:脱氮过程一般包括氨化[将含氮有机物转化为氨氮( 、
、 )、硝化和反硝化三个过程。
)、硝化和反硝化三个过程。
①硝化过程:废水中的氨氮( 、
、 )在硝化菌(好氧自养型微生物)的作用下被转化为
)在硝化菌(好氧自养型微生物)的作用下被转化为 和
和 的过程。其中硝化过程的主要反应原理有:
的过程。其中硝化过程的主要反应原理有:
反应1
反应2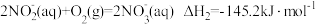
反应3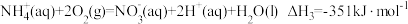
则x=___________ 。
②反硝化过程:若在缺氧环境和反硝化菌的作用下,向某含 的酸性废水中加入适量的甲醇,能实现“反硝化”过程,并产生两种对环境无污染的气体;写出该过程的离子反应方程式:
的酸性废水中加入适量的甲醇,能实现“反硝化”过程,并产生两种对环境无污染的气体;写出该过程的离子反应方程式:___________ 。
(4)新型生物脱氮工艺可将硝化过程中的产物控制在 阶段,防止生成
阶段,防止生成 ,该工艺的优点
,该工艺的优点___________ 。
 和
和 )会导致水体富营养化,其氨氮总量的检测和去除备受关注。
)会导致水体富营养化,其氨氮总量的检测和去除备受关注。(1)氨氮总量检测
利用氨气传感器检测水体中氨氮含量的示意图:

若利用氨气传感器将1L水样中的氨氮完全转化为N2时,转移电子的物质的量为
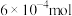 ,则水样中氨氮(以氨气计)含量为
,则水样中氨氮(以氨气计)含量为(2)
 氧化法处理氨氮废水
氧化法处理氨氮废水①写出酸性条件下
 氧化
氧化 为氮气的离子反应方程式
为氮气的离子反应方程式②为研究空气对
 氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是
氧化氨氮的影响,其他条件不变,仅增加单位时间内通入空气的量,发现氨氮去除率几乎不变。其原因可能是a.
 的氧化性比
的氧化性比 弱 b.
弱 b. 氧化氨氮速率比
氧化氨氮速率比 慢 c.空气中的
慢 c.空气中的 进入溶液中
进入溶液中(3)传统的生物脱氮机理认为:脱氮过程一般包括氨化[将含氮有机物转化为氨氮(
 、
、 )、硝化和反硝化三个过程。
)、硝化和反硝化三个过程。①硝化过程:废水中的氨氮(
 、
、 )在硝化菌(好氧自养型微生物)的作用下被转化为
)在硝化菌(好氧自养型微生物)的作用下被转化为 和
和 的过程。其中硝化过程的主要反应原理有:
的过程。其中硝化过程的主要反应原理有:反应1

反应2
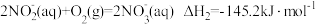
反应3
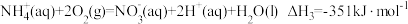
则x=
②反硝化过程:若在缺氧环境和反硝化菌的作用下,向某含
 的酸性废水中加入适量的甲醇,能实现“反硝化”过程,并产生两种对环境无污染的气体;写出该过程的离子反应方程式:
的酸性废水中加入适量的甲醇,能实现“反硝化”过程,并产生两种对环境无污染的气体;写出该过程的离子反应方程式:(4)新型生物脱氮工艺可将硝化过程中的产物控制在
 阶段,防止生成
阶段,防止生成 ,该工艺的优点
,该工艺的优点
您最近一年使用:0次
名校
3 . 利用 和浓盐酸进行实验的流程如下图所示,下列说法错误的是
和浓盐酸进行实验的流程如下图所示,下列说法错误的是
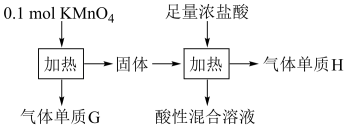
 和浓盐酸进行实验的流程如下图所示,下列说法错误的是
和浓盐酸进行实验的流程如下图所示,下列说法错误的是
A.氧化产物只有 和 和 | B.参与反应的浓盐酸全部作还原剂 |
C. 既是氧化剂又是还原剂 既是氧化剂又是还原剂 | D. 的物质的量可能为 的物质的量可能为 |
您最近一年使用:0次
4 . 2020年11月7日是“中国稀土之父”徐光宪先生诞辰100周年纪念日。金属铈( )是地壳中含量最高的稀土元素。关于铈的有关化合物及H2O2的转化关系如图所示,下列说法错误的是
)是地壳中含量最高的稀土元素。关于铈的有关化合物及H2O2的转化关系如图所示,下列说法错误的是
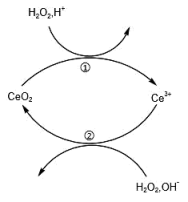
 )是地壳中含量最高的稀土元素。关于铈的有关化合物及H2O2的转化关系如图所示,下列说法错误的是
)是地壳中含量最高的稀土元素。关于铈的有关化合物及H2O2的转化关系如图所示,下列说法错误的是
| A.CeO2是整个转化过程中的催化剂 |
B.过程①的离子方程式: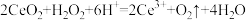 |
| C.该反应历程的总反应为:2H2O2=2H2O+O2↑ |
| D.氧化性:CeO2>H2O2 |
您最近一年使用:0次
2021-11-08更新
|
309次组卷
|
5卷引用:吉林省长春市博硕学校(原北师大长春附属学校)2021-2022学年高二下学期期末考试化学试题
名校
解题方法
5 . 化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质。例如:
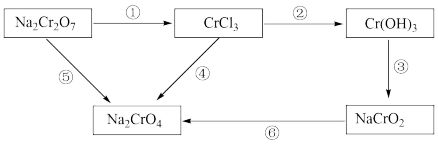
(1)配平反应①Na2Cr2O7+HCl=NaCl+CrCl3+Cl2↑+______,___________ 。Na2Cr2O7中的Cr元素为___________ 价;氧化剂是___________ ;氧化产物是___________ 。
(2)在上述有编号的步骤中,需外加氧化剂的步骤是___________ (填序号)。
(3)加入NaClO或ClO2,均可实现⑥的转化,反应后氯元素的化合价均为-1价,则还原性:
___________ Cl-(填“>”“<”或“=”)。氧化剂的氧化效率可用单位质量氧化剂被还原时得电子数表示,即得电子数越多,氧化效率越高。则ClO2的氧化效率是NaClO的___________ 倍。(结果精确到小数点后第2位)

(1)配平反应①Na2Cr2O7+HCl=NaCl+CrCl3+Cl2↑+______,
(2)在上述有编号的步骤中,需外加氧化剂的步骤是
(3)加入NaClO或ClO2,均可实现⑥的转化,反应后氯元素的化合价均为-1价,则还原性:

您最近一年使用:0次
2021-10-22更新
|
138次组卷
|
2卷引用:吉林省长春市十一高中2021-2022学年高一上学期第一学程考试化学试题
6 . 新型洗涤剂过氧碳酸钠(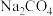 )固体,能瞬间清除衣服上的汗渍、果汁等顽固污渍。它与水反应生成碳酸钠和其他化合物,关于过氧碳酸钠(
)固体,能瞬间清除衣服上的汗渍、果汁等顽固污渍。它与水反应生成碳酸钠和其他化合物,关于过氧碳酸钠(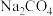 )的性质,下列推测
)的性质,下列推测不合理 的是
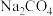 )固体,能瞬间清除衣服上的汗渍、果汁等顽固污渍。它与水反应生成碳酸钠和其他化合物,关于过氧碳酸钠(
)固体,能瞬间清除衣服上的汗渍、果汁等顽固污渍。它与水反应生成碳酸钠和其他化合物,关于过氧碳酸钠(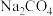 )的性质,下列推测
)的性质,下列推测| A.过氧碳酸钠也可作为水体供氧剂 |
| B.过碳酸钠中的氧元素有-1、-2两种价态 |
| C.过氧碳酸钠能使酸性高锰酸钾溶液褪色,体现了过氧碳酸钠的强氧化性 |
| D.过碳酸钠的水溶液既有碱性也有强氧化性 |
您最近一年使用:0次
2021-10-20更新
|
371次组卷
|
3卷引用:吉林省通化市辉南县第六中学2022-2023学年高一上学期期中考试化学试题
名校
7 . 铜、铬、锰均为过渡元素,其单质及化合物在工业、科技和生产中有着广泛的应用。
(1)Cu2S可用作制防污涂料、污水处理剂、催化剂等。
①灼烧Cu2S时,铜的焰色为___________ (填序号)。
A.黄色 B.洋红色 C.紫色 D.绿色
②用CuS、Cu2S处理酸性废水中的 时发生的反应如下:
时发生的反应如下:
I.CuS+ +H+→Cu2++
+H+→Cu2++ +Cr3++H2O
+Cr3++H2O
II.Cu2S+ +H+→Cu2++
+H+→Cu2++ +Cr3++H2O
+Cr3++H2O
当消耗的CuS、Cu2S的物质的量相同时,两者去除 的物质的量比为
的物质的量比为___________ 。
(2)Cr2O3可用于冶金,也可用作陶瓷、耐火材料、颜料业原料及有机合成催化剂等。
①Cr2O3与Al2O3性质类似,具有两性,写出Cr2O3与NaOH溶液反应的离子方程式:___________ 。
②用碳还原重铬酸钾可制备Cr2O3,同时生成一种可燃性有毒气体,当该反应中碳与重铬酸钾的化学计量数比为2:1时,氧化产物的化学式为___________ 。
(3)锰酸钾可用作皮革、纤维漂白剂以及杀菌剂、羊毛的媒染剂等。
①金属锰与熔融碱在氧化剂作用下生成锰酸钾,反应为2Mn+4KOH(熔融)+3O2=2K2MnO4+2H2O,若生成98.5 g K2MnO4,则消耗标准状况下O2的体积为___________ 。
②在KOH溶液的环境中高锰酸钾溶液与亚硫酸钠反应可以制得锰酸钾,写出该反应的离子方程式___________ 。
(1)Cu2S可用作制防污涂料、污水处理剂、催化剂等。
①灼烧Cu2S时,铜的焰色为
A.黄色 B.洋红色 C.紫色 D.绿色
②用CuS、Cu2S处理酸性废水中的
 时发生的反应如下:
时发生的反应如下:I.CuS+
 +H+→Cu2++
+H+→Cu2++ +Cr3++H2O
+Cr3++H2OII.Cu2S+
 +H+→Cu2++
+H+→Cu2++ +Cr3++H2O
+Cr3++H2O当消耗的CuS、Cu2S的物质的量相同时,两者去除
 的物质的量比为
的物质的量比为(2)Cr2O3可用于冶金,也可用作陶瓷、耐火材料、颜料业原料及有机合成催化剂等。
①Cr2O3与Al2O3性质类似,具有两性,写出Cr2O3与NaOH溶液反应的离子方程式:
②用碳还原重铬酸钾可制备Cr2O3,同时生成一种可燃性有毒气体,当该反应中碳与重铬酸钾的化学计量数比为2:1时,氧化产物的化学式为
(3)锰酸钾可用作皮革、纤维漂白剂以及杀菌剂、羊毛的媒染剂等。
①金属锰与熔融碱在氧化剂作用下生成锰酸钾,反应为2Mn+4KOH(熔融)+3O2=2K2MnO4+2H2O,若生成98.5 g K2MnO4,则消耗标准状况下O2的体积为
②在KOH溶液的环境中高锰酸钾溶液与亚硫酸钠反应可以制得锰酸钾,写出该反应的离子方程式
您最近一年使用:0次
2021-10-13更新
|
267次组卷
|
3卷引用:吉林省长春市第六中学2022-2023学年高一上学期期末考试化学试题
吉林省长春市第六中学2022-2023学年高一上学期期末考试化学试题河南省的商丘市、周口市,安徽省...“皖豫名校联盟体” 2021-2022学年高三上学期第一次考试化学试题(已下线)第10练 金属材料-2022年【寒假分层作业】高一化学(人教版2019)
解题方法
8 . 利用元素的化合价与物质类别关系研究物质性质是学习元素化合物知识的重要方法。如图是氮元素的常见化合价与常见物质类别的二维关系图。
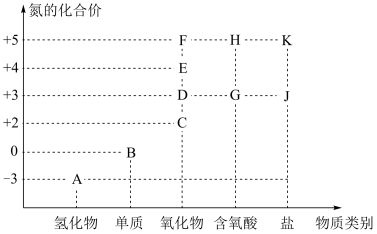
(1)实验室常用熟石灰与I共热来制取A,请写出反应方程式_______ 。
(2)图中氮的氧化物中,属于酸性氧化物的有_______ 。(用物质化学式作答)
(3)J主要用于染料、医药、印染、漂白等方面,J的焰色反应呈黄色。J能使酸性 溶液褪色(生成了
溶液褪色(生成了 ),该反应的离子方程式为
),该反应的离子方程式为_______ 。
(4)治理汽车尾气中氮的氧化物的污染的一种方法是在汽车排气管中装一个含有A的催化转化装置,尾气中的C与A在催化剂作用下转化为无毒无污染的排放物。该反应的化学方程式为_______ 。
(5)工业上以A为原料生产H,反应路线为 ,假设整个过程中氮的转化率达
,假设整个过程中氮的转化率达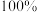 ,则每天生产质量分数为
,则每天生产质量分数为 的浓硝酸25千克,共消耗标准状况下
的浓硝酸25千克,共消耗标准状况下 的体积为
的体积为_______  。
。

(1)实验室常用熟石灰与I共热来制取A,请写出反应方程式
(2)图中氮的氧化物中,属于酸性氧化物的有
(3)J主要用于染料、医药、印染、漂白等方面,J的焰色反应呈黄色。J能使酸性
 溶液褪色(生成了
溶液褪色(生成了 ),该反应的离子方程式为
),该反应的离子方程式为(4)治理汽车尾气中氮的氧化物的污染的一种方法是在汽车排气管中装一个含有A的催化转化装置,尾气中的C与A在催化剂作用下转化为无毒无污染的排放物。该反应的化学方程式为
(5)工业上以A为原料生产H,反应路线为
 ,假设整个过程中氮的转化率达
,假设整个过程中氮的转化率达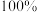 ,则每天生产质量分数为
,则每天生产质量分数为 的浓硝酸25千克,共消耗标准状况下
的浓硝酸25千克,共消耗标准状况下 的体积为
的体积为 。
。
您最近一年使用:0次
2021-09-30更新
|
369次组卷
|
2卷引用:吉林省敦化市实验中学2020-2021学年高一下学期期末考试化学试题
名校
9 . 某化学工程师以电子产品废料(含 、
、 、
、 、
、 )为原料,设计回收
)为原料,设计回收 的工艺流程如下:
的工艺流程如下:
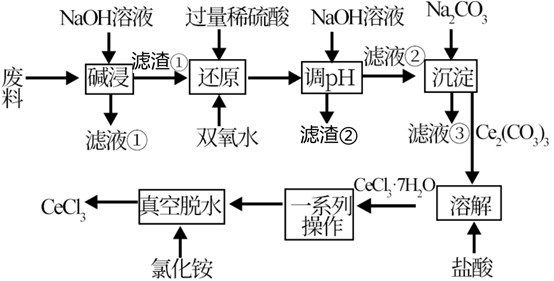
已知:溶液中只有 、
、 能稳定存在。
能稳定存在。
(1)“碱浸”前,将“废料”磨成粉末的目的是_______ 。
(2)“滤液①”中的溶质除过量的 外主要成分为
外主要成分为_______ (填化学式下同),“滤渣②”的主要成分为_______ 。
(3)“还原”工艺中发生氧化还原反应的离子方程式为_______ 。
(4)室温下,已知: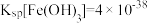 ,
,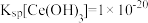 。“还原”后加入稀硫酸调节溶液的
。“还原”后加入稀硫酸调节溶液的 ,当溶液的
,当溶液的 时,
时,
_______ (填“已”或“没有”)除干净(当溶液中某离子浓度小于 时,认为已除干净),若“滤液②”的体积为1L,“废料”中含
时,认为已除干净),若“滤液②”的体积为1L,“废料”中含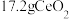 ,不考虑损耗,则“滤液②”中
,不考虑损耗,则“滤液②”中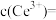
_______ 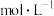 。
。
(5)“一系列操作”包括_______ 、洗涤。
(6)将 、
、 按比例配制成二元电解质体系,用惰性电极电解可得到金属铈,该电解池阴极的主要电极反应式为
按比例配制成二元电解质体系,用惰性电极电解可得到金属铈,该电解池阴极的主要电极反应式为_______ ;该方法的缺点是_______ 。
 、
、 、
、 、
、 )为原料,设计回收
)为原料,设计回收 的工艺流程如下:
的工艺流程如下:
已知:溶液中只有
 、
、 能稳定存在。
能稳定存在。(1)“碱浸”前,将“废料”磨成粉末的目的是
(2)“滤液①”中的溶质除过量的
 外主要成分为
外主要成分为(3)“还原”工艺中发生氧化还原反应的离子方程式为
(4)室温下,已知:
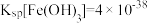 ,
,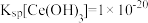 。“还原”后加入稀硫酸调节溶液的
。“还原”后加入稀硫酸调节溶液的 ,当溶液的
,当溶液的 时,
时,
 时,认为已除干净),若“滤液②”的体积为1L,“废料”中含
时,认为已除干净),若“滤液②”的体积为1L,“废料”中含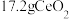 ,不考虑损耗,则“滤液②”中
,不考虑损耗,则“滤液②”中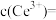
 。
。(5)“一系列操作”包括
(6)将
 、
、 按比例配制成二元电解质体系,用惰性电极电解可得到金属铈,该电解池阴极的主要电极反应式为
按比例配制成二元电解质体系,用惰性电极电解可得到金属铈,该电解池阴极的主要电极反应式为
您最近一年使用:0次
2021-09-06更新
|
326次组卷
|
2卷引用:吉林省东北师范大学附属中学2021-2022学年高三上学期第二次摸底考试化学试题
名校
解题方法
10 . 回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为___________ mol。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。___________
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。
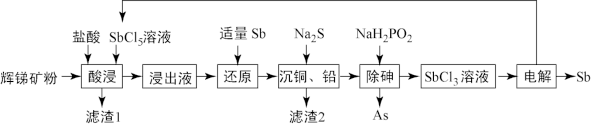
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是___________ (填化学式)。
(5)写出“还原”反应的化学方程式___________ 。
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 序号 | 实验 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是
(5)写出“还原”反应的化学方程式
您最近一年使用:0次
2021-07-28更新
|
1111次组卷
|
3卷引用:吉林省长春希望高中2020-2021学年高二下学期期末考试化学试题



