名校
解题方法
1 . 向含废水中加入 ,铁元素会形成如图所示的
,铁元素会形成如图所示的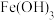 胶团,在静电吸附作用下,胶团可以除去废水中的
胶团,在静电吸附作用下,胶团可以除去废水中的 价砷元素,下列说法正确的是
价砷元素,下列说法正确的是

 ,铁元素会形成如图所示的
,铁元素会形成如图所示的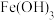 胶团,在静电吸附作用下,胶团可以除去废水中的
胶团,在静电吸附作用下,胶团可以除去废水中的 价砷元素,下列说法正确的是
价砷元素,下列说法正确的是
| A.废水中的含砷微粒是带正电荷的离子 |
B.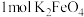 可以形成的胶团数目小于 可以形成的胶团数目小于 |
C.增大废水的 , ,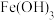 胶粒的吸附絮凝效能提升 胶粒的吸附絮凝效能提升 |
D. 可以还原废水中的含砷微粒到 可以还原废水中的含砷微粒到 价 价 |
您最近一年使用:0次
2022-12-09更新
|
1234次组卷
|
5卷引用:吉林省延边第一中学2023届高三下学期第七次模拟考试理科综合化学试题
解题方法
2 . 钛是一种性能非常优越的金属,有着广泛的应用,有人说“21世纪将是钛的世纪”。以金红石矿(主要成分为TiO2,含有少量Al2O3、SiO2、FeO、Fe2O3等杂质)为主要原料,首先反应生成TiCl4,然后再用镁还原得到金属钛,其工艺流程如下:

已知:常温下Fe(OH)3和Fe(OH)2溶度积(Ksp)分别为4.0×10-38和8.0×10-16
请回答下列问题:
(1)加入浓NaOH溶液的目的是_________ 。
(2)镁和氯气主要来源于流程中的某种物质通过电解方法获得,该物质是_________ 。工业生产中需要适当补充该物质,该物质可来源于海水,制备过程如下:向海水中加入石灰乳后,向分离得到的固体中加入过量的盐酸,目的是_________ ,将得到的溶液通过_________ 、冷却结晶操作后得到晶体,在HCl气流中加热晶体即可得到该物质。
(3)高温下,滤渣Y、焦炭和氯气发生反应生成可燃性气体的化学方程式为:_________ 。
(4)工艺流程中稀有气体Ar的作用是_________ 。
(5)为提高原料的利用率,常温下某研究小组向⑤过滤后的滤液中,先加适量的H2O2,再加适量的碱调节溶液的pH至4,过滤后将滤渣加热灼烧,得到了常用的涂料。调节溶液的pH至4时,溶液中金属离子的浓度为_________ mol/L。
(6)TiN具有重要的用途,可在高温下由TiO2与NH3反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体。该反应的化学方程式为_________ 。

已知:常温下Fe(OH)3和Fe(OH)2溶度积(Ksp)分别为4.0×10-38和8.0×10-16
请回答下列问题:
(1)加入浓NaOH溶液的目的是
(2)镁和氯气主要来源于流程中的某种物质通过电解方法获得,该物质是
(3)高温下,滤渣Y、焦炭和氯气发生反应生成可燃性气体的化学方程式为:
(4)工艺流程中稀有气体Ar的作用是
(5)为提高原料的利用率,常温下某研究小组向⑤过滤后的滤液中,先加适量的H2O2,再加适量的碱调节溶液的pH至4,过滤后将滤渣加热灼烧,得到了常用的涂料。调节溶液的pH至4时,溶液中金属离子的浓度为
(6)TiN具有重要的用途,可在高温下由TiO2与NH3反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体。该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
3 . 碱性条件下30mL1mol/L 溶液恰好将某溶液中0.02mol
溶液恰好将某溶液中0.02mol 完全氧化为
完全氧化为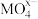 ,
, 被还原为
被还原为 ,则x为
,则x为
 溶液恰好将某溶液中0.02mol
溶液恰好将某溶液中0.02mol 完全氧化为
完全氧化为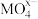 ,
, 被还原为
被还原为 ,则x为
,则x为| A.4 | B.3 | C.2 | D.1 |
您最近一年使用:0次
2022-11-23更新
|
296次组卷
|
2卷引用:吉林省长春市第六中学2022-2023学年高一上学期期末考试化学试题
名校
4 . 电石渣[主要成分为Ca(OH)2]是氯碱工业中的废料,某同学在实验室以电石渣为原料制取KClO3的工艺流程如图所示:
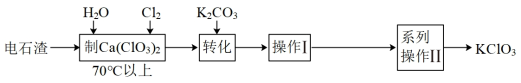
已知:Ca(ClO3)2易溶于水。
下叙述述中正确的是

已知:Ca(ClO3)2易溶于水。
下叙述述中正确的是
| A.上述流程中所用Cl2是用MnO2与浓盐酸反应制得,体现了盐酸的酸性和氧化性 |
B.工业生产电石(CaC2)的反应为CaO+3C CaC2+CO↑,该反应中氧化剂与还原剂的物质的量之比为1∶2 CaC2+CO↑,该反应中氧化剂与还原剂的物质的量之比为1∶2 |
C.“转化”发生反应的离子方程式为Ca2++ClO +K++CO +K++CO =CaCO3↓+KClO3 =CaCO3↓+KClO3 |
| D.操作I为过滤 |
您最近一年使用:0次
2022-11-11更新
|
439次组卷
|
4卷引用:吉林省长春外国语学校2022-2023学年高二下学期7月期末考试化学试题
吉林省长春外国语学校2022-2023学年高二下学期7月期末考试化学试题浙江省七彩阳光联盟2022-2023学年高一上学期期中联考化学试题(已下线)专题14 工艺流程选择题-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)(已下线)【2022】【高一上】【期中考】【七彩阳光】【高中化学】【宋永洁收集】
5 .  .某化工厂从含
.某化工厂从含 的废料
的废料 杂质为
杂质为 、
、 、
、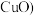 中回收、制备具有良好的电化学活性和高堆积密度的羟基氧化镍
中回收、制备具有良好的电化学活性和高堆积密度的羟基氧化镍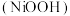 的工艺流程如下图:
的工艺流程如下图:
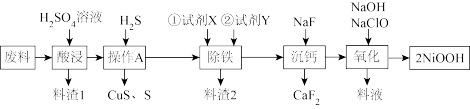
(1)酸浸中不断用搅拌机进行搅拌的目的是_______ ,下图是酸浸时镍的浸出率与温度的关系,则酸浸时合适的浸出温度是_______ ℃,若酸浸时将温度控制在80℃左右,则料渣 中会含有一定量的
中会含有一定量的 ,其可能的原因是
,其可能的原因是_______ 。
(2)生成 的化学方程式为
的化学方程式为_______ ,试剂 是一种绿色氧化剂,
是一种绿色氧化剂, 反应时氧化剂与还原剂物质的量之比为
反应时氧化剂与还原剂物质的量之比为_______ ,试剂 是用于调节溶液的
是用于调节溶液的 的,则
的,则 的调控范围是
的调控范围是_______  与沉淀相关的数据如表所示
与沉淀相关的数据如表所示 。
。
(3)写出氧化过程中反应的离子方程式:_______ ,沉钙中当溶液中c(F-)=3×10-3mol·L-1,通过计算确定溶液中 是否沉淀完全。答:
是否沉淀完全。答:_______  常温时,Ksp(CaF2)=2.7×10-11]。
常温时,Ksp(CaF2)=2.7×10-11]。
Ⅱ、T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的 溶液,所得溶液中三种微粒
溶液,所得溶液中三种微粒 、
、 、
、 的物质的量分数(δ)与
的物质的量分数(δ)与 的关系如下图所示:
的关系如下图所示:
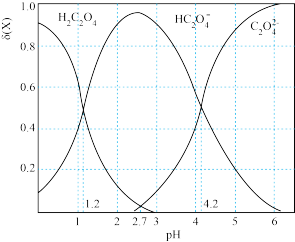
(4)草酸的电离常数分别为 与
与 ,则
,则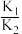 =
=_______ 。
(5)按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,下列有关该溶液的叙述正确的是_______ 填序号
填序号 。
。
 .某化工厂从含
.某化工厂从含 的废料
的废料 杂质为
杂质为 、
、 、
、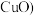 中回收、制备具有良好的电化学活性和高堆积密度的羟基氧化镍
中回收、制备具有良好的电化学活性和高堆积密度的羟基氧化镍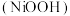 的工艺流程如下图:
的工艺流程如下图:
(1)酸浸中不断用搅拌机进行搅拌的目的是
 中会含有一定量的
中会含有一定量的 ,其可能的原因是
,其可能的原因是
(2)生成
 的化学方程式为
的化学方程式为 是一种绿色氧化剂,
是一种绿色氧化剂, 反应时氧化剂与还原剂物质的量之比为
反应时氧化剂与还原剂物质的量之比为 是用于调节溶液的
是用于调节溶液的 的,则
的,则 的调控范围是
的调控范围是 与沉淀相关的数据如表所示
与沉淀相关的数据如表所示 。
。| 离子 |  |  |  |
开始沉淀的 |  | 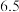 |  |
沉淀完全的 |  | 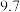 | 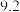 |
(3)写出氧化过程中反应的离子方程式:
 是否沉淀完全。答:
是否沉淀完全。答: 常温时,Ksp(CaF2)=2.7×10-11]。
常温时,Ksp(CaF2)=2.7×10-11]。Ⅱ、T℃时,向某浓度的草酸溶液中逐滴加入一定浓度的
 溶液,所得溶液中三种微粒
溶液,所得溶液中三种微粒 、
、 、
、 的物质的量分数(δ)与
的物质的量分数(δ)与 的关系如下图所示:
的关系如下图所示:
(4)草酸的电离常数分别为
 与
与 ,则
,则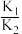 =
=(5)按投料比n(Na2C2O4):n(NaHC2O4)=2:1配成溶液,下列有关该溶液的叙述正确的是_______
 填序号
填序号 。
。A.该溶液的 为 为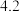 |
B. 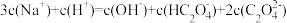 |
C.3c(Na+)=5[c( )+c( )+c( )+c(H2C2O4)] )+c(H2C2O4)] |
D.3c(OH-)+c( )=3c(H+)+2c( )=3c(H+)+2c( )+5c(H2C2O4) )+5c(H2C2O4) |
您最近一年使用:0次
名校
6 . 次磷酸(H3PO2)是一元中强酸,次磷酸钠(NaH2PO2)广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如图所示。下列有关说法正确的是


A.Ni2+价电子的轨道表示式为 |
| B.“碱溶”时氧化剂与还原剂的物质的量之比为3:1 |
C.PH3、PO 中P的杂化方式相同,键角PO 中P的杂化方式相同,键角PO >PH3 >PH3 |
D.次磷酸铵与足量氢氧化钠共热,发生反应NH +H2PO +H2PO +3OH- +3OH- NH3↑+3H2O+PO NH3↑+3H2O+PO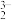 |
您最近一年使用:0次
2022-10-08更新
|
1443次组卷
|
8卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期9月月考化学试题
名校
7 . 零价纳米铁在有机氯化物降解等方面有重要作用,采用强还原剂硼氢化钾液相还原法制备纳米零价铁的化学反应如下: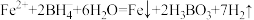 ,其中B元素化合价不变。下列说法正确的是
,其中B元素化合价不变。下列说法正确的是
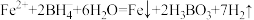 ,其中B元素化合价不变。下列说法正确的是
,其中B元素化合价不变。下列说法正确的是A. 是氧化产物 是氧化产物 |
| B.已知纳米Fe颗粒直径为60nm,则纳米Fe颗粒为胶体 |
C.若有 参加反应,则反应中转移电子的物质的量为4mol 参加反应,则反应中转移电子的物质的量为4mol |
D.该反应的氧化剂只有 ,还原剂只有 ,还原剂只有 |
您最近一年使用:0次
2022-10-08更新
|
189次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期9月月考化学试题
名校
解题方法
8 . 按要求填空
(1)现有下列物质,请用序号填空:
①硫酸钡②胆矾晶体③熔融氯化钠④稀盐酸⑤氨水⑥蔗糖⑦二氧化碳
上述状态下可导电的是_____ 。属于强电解质的是____ 。属于非电解质的是_____ 。
(2)向50mL沸水中加入5~6滴饱和 溶液,加热至产生红褐色液体,停止加热,利用
溶液,加热至产生红褐色液体,停止加热,利用_______ 来证明得到的分散系是氢氧化铁胶体。
(3) 固体溶于水的电离方程式为
固体溶于水的电离方程式为_______ 。
(4)写出少量硫酸铁和氢氧化钡溶液反应的离子方程为_______ 。
(5) 能与硫酸酸化的
能与硫酸酸化的 溶液反应,生成
溶液反应,生成 和
和 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(6)已知: ,
,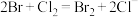 ,
, 。向
。向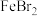 的溶液通入
的溶液通入 ,
,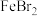 与
与 的化学计量数之比为
的化学计量数之比为 时,发生反应的离子方程式为:
时,发生反应的离子方程式为:_______ 。
(1)现有下列物质,请用序号填空:
①硫酸钡②胆矾晶体③熔融氯化钠④稀盐酸⑤氨水⑥蔗糖⑦二氧化碳
上述状态下可导电的是
(2)向50mL沸水中加入5~6滴饱和
 溶液,加热至产生红褐色液体,停止加热,利用
溶液,加热至产生红褐色液体,停止加热,利用(3)
 固体溶于水的电离方程式为
固体溶于水的电离方程式为(4)写出少量硫酸铁和氢氧化钡溶液反应的离子方程为
(5)
 能与硫酸酸化的
能与硫酸酸化的 溶液反应,生成
溶液反应,生成 和
和 ,该反应的离子方程式为
,该反应的离子方程式为(6)已知:
 ,
,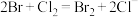 ,
, 。向
。向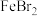 的溶液通入
的溶液通入 ,
,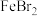 与
与 的化学计量数之比为
的化学计量数之比为 时,发生反应的离子方程式为:
时,发生反应的离子方程式为:
您最近一年使用:0次
9 . 高级氧化技术(AOPs)广泛应用于水处理行业,其中芬顿法(Fenton)最为著名,一种芬顿法处理废水的反应为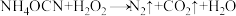 (未配平),下列有关该反应的说法正确的是
(未配平),下列有关该反应的说法正确的是
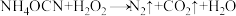 (未配平),下列有关该反应的说法正确的是
(未配平),下列有关该反应的说法正确的是A.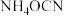 既是氧化剂又是还原剂 既是氧化剂又是还原剂 |
B. 是氧化产物, 是氧化产物, 是还原产物 是还原产物 |
C.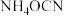 存在离子键和非极性键 存在离子键和非极性键 |
D.生成1mol 时,反应转移3mol电子 时,反应转移3mol电子 |
您最近一年使用:0次
2022-09-06更新
|
138次组卷
|
3卷引用:吉林省部分名校2022-2023学年高三上学期9月大联考化学试题
解题方法
10 . 某化学兴趣小组用硫铜矿煅烧后的废渣(主要含 、CuO、FeO)为原料制取
、CuO、FeO)为原料制取 ,流程如下:
,流程如下:
 、CuO、FeO)为原料制取
、CuO、FeO)为原料制取 ,流程如下:
,流程如下:
A.“氧化”的目的是将 氧化成 氧化成 |
B.“滤渣”是 |
C.“还原”过程中每消耗 ,理论上可得到 ,理论上可得到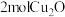 |
D.KOH、 中均含有极性键和非极性键 中均含有极性键和非极性键 |
您最近一年使用:0次
2022-08-08更新
|
483次组卷
|
3卷引用:2024届吉林省长春市高三下学期质量监测(四)化学试题



