1 . 铁和钛是重要的金属材料。 合金是优良的储氢合金。一种利用钛铁矿(主要成分为
合金是优良的储氢合金。一种利用钛铁矿(主要成分为 ,另含
,另含 和
和 等杂质)制备钛和绿矾的工艺流程如下。下列说法错误的是
等杂质)制备钛和绿矾的工艺流程如下。下列说法错误的是

 合金是优良的储氢合金。一种利用钛铁矿(主要成分为
合金是优良的储氢合金。一种利用钛铁矿(主要成分为 ,另含
,另含 和
和 等杂质)制备钛和绿矾的工艺流程如下。下列说法错误的是
等杂质)制备钛和绿矾的工艺流程如下。下列说法错误的是
| A.“浸出”过程中Ti元素的化合价没有发生改变 |
B.氧化性: |
C.若制得 金属钛,则步骤Ⅲ中转移电子的物质的量至少为 金属钛,则步骤Ⅲ中转移电子的物质的量至少为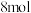 |
D. 被还原为Ti的过程也可以用Na代替Mg 被还原为Ti的过程也可以用Na代替Mg |
您最近一年使用:0次
2023-10-28更新
|
190次组卷
|
3卷引用:选择题11-15
解题方法
2 . 已知: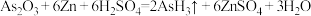 ,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是
,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是
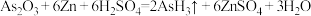 ,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是
,阿伏伽德罗常数的值为NA。若反应物中H2SO4消耗了3mol,则下列说法错误的是| A.转移电子的数目为6NA | B.标准状况下,生成H2O27g |
| C.生成还原产物的分子数为1NA | D.产物AsH3为平面三角形 |
您最近一年使用:0次
名校
解题方法
3 . 含氮物质的过量排放会污染大气,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)O3氧化性强于 O2,工业烟气中的 NO 经 O3处理后再用碱液吸收而实现脱除。
① 已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284.2 kJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=___________ kJ·mol-1。
② 保持烟气气流速率一定、其他条件相同,NO 脱除率随反应温度变化如图所示。温度超过 150 ℃时,温度升高,NO 脱除率下降,可能的原因是___________ 。

(2)铁元素与EDTA的配合物中,只有亚铁配合物[Fe(Ⅱ)EDTA]能吸附氮氧化物, Fe(Ⅱ)EDTA吸附NO生成Fe(Ⅱ)EDTA•NO,连二亚硫酸钠(Na2S2O4)与吸附后的溶液反应可以实现吸附剂再生,同时生成(NH4)2SO3。
① EDTA的化学名为乙二胺四乙酸,结构简式如下图所示。在Fe(Ⅱ)EDTA中,乙二胺四乙酸根和 Fe2+形成六配位离子。其中配位键的形成方式是___________ 。

② 写出吸附剂再生反应的离子方程式:___________ 。
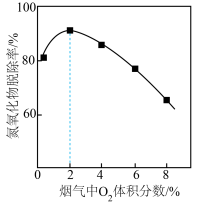
③ Fe(Ⅱ)EDTA吸收烟气中氮氧化物,其他条件相同时,烟气中O2含量对氮氧化物去除率的影响如图所示。在O2含量2 %前后,氮氧化物脱除率先升高后降低的原因是___________ 。
(1)O3氧化性强于 O2,工业烟气中的 NO 经 O3处理后再用碱液吸收而实现脱除。
① 已知:2NO(g)+O2(g)=2NO2(g) ΔH1=-114 kJ·mol-1
2O3(g)=3O2(g) ΔH2=-284.2 kJ·mol-1
NO(g)+O3(g)=NO2(g)+O2(g) ΔH3=
② 保持烟气气流速率一定、其他条件相同,NO 脱除率随反应温度变化如图所示。温度超过 150 ℃时,温度升高,NO 脱除率下降,可能的原因是

(2)铁元素与EDTA的配合物中,只有亚铁配合物[Fe(Ⅱ)EDTA]能吸附氮氧化物, Fe(Ⅱ)EDTA吸附NO生成Fe(Ⅱ)EDTA•NO,连二亚硫酸钠(Na2S2O4)与吸附后的溶液反应可以实现吸附剂再生,同时生成(NH4)2SO3。
① EDTA的化学名为乙二胺四乙酸,结构简式如下图所示。在Fe(Ⅱ)EDTA中,乙二胺四乙酸根和 Fe2+形成六配位离子。其中配位键的形成方式是

② 写出吸附剂再生反应的离子方程式:
③ Fe(Ⅱ)EDTA吸收烟气中氮氧化物,其他条件相同时,烟气中O2含量对氮氧化物去除率的影响如图所示。在O2含量2 %前后,氮氧化物脱除率先升高后降低的原因是

您最近一年使用:0次
2023-10-05更新
|
78次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三上学期11月期中化学试题
解题方法
4 . 中华文明博大精深,源远流长。下列说法错误的是
| A.宣纸是我国传统的书画用纸,用青檀和稻草生产宣纸涉及化学变化 |
| B.《神农本草经》中记载“石硫磺能化金银铜铁”,该过程发生化合反应 |
| C.“千淘万漉虽辛苦,吹尽黄沙始到金”中的淘金原理与化学上的萃取一致 |
| D.“百炼成钢”,反复烧红的生铁在空气中不断锤打可以制得钢,该过程中发生氧化还原反应 |
您最近一年使用:0次
名校
5 . 草酸又称乙二酸,是一种重要的化工原料,一般含有结晶水。现某化学兴趣小组欲测定某草酸样品【主要成分是水合草酸 (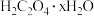 ),还含有少量的草酸钠(
),还含有少量的草酸钠( )】中结晶水的含量,采用如下测定步骤:
)】中结晶水的含量,采用如下测定步骤:
①准确称量质量为 的固体样品于锥形瓶中,加
的固体样品于锥形瓶中,加 蒸馏水,使样品完全溶解,加入2滴指示剂
蒸馏水,使样品完全溶解,加入2滴指示剂 。
。
②用物质的量浓度为 的标准
的标准 溶液滴定至
溶液滴定至 全部转化为
全部转化为 ,到达终点时消耗体积为
,到达终点时消耗体积为 。
。
③向步骤②反应后的溶液中加入一定量的 酸化,用物质的量浓度为
酸化,用物质的量浓度为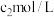 的标准
的标准 溶液滴定,到达终点时,消耗体积为
溶液滴定,到达终点时,消耗体积为 。
。
回答下列问题:
(1)草酸是一种二元弱酸则该酸二级电离平衡常数 的表达式为
的表达式为___________ 。
(2)步骤①中使用的指示剂 是
是___________ (填“甲基橙溶液”或“酚酞溶液”),不选择另一种指示剂的原因是___________ 。
(3)进行步骤③时,盛放 溶液应使用
溶液应使用___________ 滴定管(填“A”或“B”),原因是___________ ,写出步骤③滴定过程中发生反应的离子方程式___________ 。
(4)如何判断步骤③达到滴定终点___________ 。
(5)通过计算得到,样品中杂质草酸钠的质量分数为___________ (用含有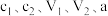 的代数式表示,不用化简)
的代数式表示,不用化简)

(6)下列操作会引起x的测定值偏小的是___________
A.在步骤①中称量药品时,药品和砝码放反,且使用了游码
B.在计算过程中,误认为草酸钠的分子式为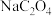
C.在步骤③达到终点且正确读数后,发现在滴定管管口悬有半滴标准 溶液尚未滴下
溶液尚未滴下
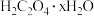 ),还含有少量的草酸钠(
),还含有少量的草酸钠( )】中结晶水的含量,采用如下测定步骤:
)】中结晶水的含量,采用如下测定步骤:①准确称量质量为
 的固体样品于锥形瓶中,加
的固体样品于锥形瓶中,加 蒸馏水,使样品完全溶解,加入2滴指示剂
蒸馏水,使样品完全溶解,加入2滴指示剂 。
。②用物质的量浓度为
 的标准
的标准 溶液滴定至
溶液滴定至 全部转化为
全部转化为 ,到达终点时消耗体积为
,到达终点时消耗体积为 。
。③向步骤②反应后的溶液中加入一定量的
 酸化,用物质的量浓度为
酸化,用物质的量浓度为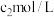 的标准
的标准 溶液滴定,到达终点时,消耗体积为
溶液滴定,到达终点时,消耗体积为 。
。回答下列问题:
(1)草酸是一种二元弱酸则该酸二级电离平衡常数
 的表达式为
的表达式为(2)步骤①中使用的指示剂
 是
是(3)进行步骤③时,盛放
 溶液应使用
溶液应使用(4)如何判断步骤③达到滴定终点
(5)通过计算得到,样品中杂质草酸钠的质量分数为
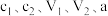 的代数式表示,不用化简)
的代数式表示,不用化简)
(6)下列操作会引起x的测定值偏小的是
A.在步骤①中称量药品时,药品和砝码放反,且使用了游码
B.在计算过程中,误认为草酸钠的分子式为
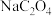
C.在步骤③达到终点且正确读数后,发现在滴定管管口悬有半滴标准
 溶液尚未滴下
溶液尚未滴下
您最近一年使用:0次
名校
解题方法
6 . 元素的价类二维图是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图。下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,回答下列问题:
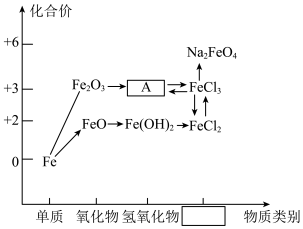
(1)上图横坐标方框中对应的物质类别是___________ ,物质A的颜色是___________ 。
(2)类比推理是学习和研究化学物质及其变化的一种常用的思维方法。下列推理正确的是___________。
(3)向沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸,可制得A的胶体,写出该反应的化学方程式___________ 。向FeCl3溶液中加入NaClO和NaOH溶液,可制得新型绿色消毒剂高铁酸钠(Na2FeO4),相应的反应方程式如下:
 ,请用单线桥法标示出该反应中电子转移的方向和数目。
,请用单线桥法标示出该反应中电子转移的方向和数目。_________

(1)上图横坐标方框中对应的物质类别是
(2)类比推理是学习和研究化学物质及其变化的一种常用的思维方法。下列推理正确的是___________。
A.由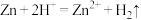 ,可推知 ,可推知 |
B.由 ,可推知 ,可推知 |
C.由 ,可推知 ,可推知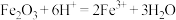 |
D.由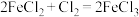 ,可推知 ,可推知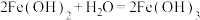 |
(3)向沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸,可制得A的胶体,写出该反应的化学方程式
 ,请用单线桥法标示出该反应中电子转移的方向和数目。
,请用单线桥法标示出该反应中电子转移的方向和数目。
您最近一年使用:0次
名校
解题方法
7 . 移取20.00 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。
已知:
① 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;
② 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化
(1)加入 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为_______ 。
(2)酸化后 歧化发生离子反应方程式为
歧化发生离子反应方程式为_______ 。
(3)加入 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为_______ 。
(4)则溶液中的 的浓度为
的浓度为_______ ; 的浓度为
的浓度为_______ 。
(5)若溶液酸化后将 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将_______ (填“偏大”、“偏小”或“不变”)。
 两种一元弱酸
两种一元弱酸 和
和 的混合溶液,滴加0.1
的混合溶液,滴加0.1 的
的 至反应终点,消耗25
至反应终点,消耗25 。再取相同的上述溶液,加入50
。再取相同的上述溶液,加入50 ,0.02
,0.02
 的强碱性溶液,待其反应完成后,将溶液酸化,加入30
的强碱性溶液,待其反应完成后,将溶液酸化,加入30 0.2
0.2
 溶液,将剩余的
溶液,将剩余的 和
和 歧化生成的
歧化生成的 和
和 全部还原至
全部还原至 ,剩余的
,剩余的 溶液用上述
溶液用上述 溶液在酸性条件下反应至终点消耗18.5
溶液在酸性条件下反应至终点消耗18.5 。
。已知:
①
 在强碱性条件下还原产物为
在强碱性条件下还原产物为 ;
; 在酸性条件发生歧化反应;
在酸性条件发生歧化反应;②
 具有还原性,酸性条件下被氧化为
具有还原性,酸性条件下被氧化为 ,
, 不能被酸性高锰酸钾氧化
不能被酸性高锰酸钾氧化(1)加入
 的强碱性溶液发生的有电子转移的离子反应方程式为
的强碱性溶液发生的有电子转移的离子反应方程式为(2)酸化后
 歧化发生离子反应方程式为
歧化发生离子反应方程式为(3)加入
 溶液后发生反应的离子方程式为
溶液后发生反应的离子方程式为(4)则溶液中的
 的浓度为
的浓度为 的浓度为
的浓度为(5)若溶液酸化后将
 过滤除掉,其它操作不变,则测得的
过滤除掉,其它操作不变,则测得的 浓度将
浓度将
您最近一年使用:0次
名校
8 . 氮氧化物(NO和NO2)是汽车尾气和化工生产中的常见大气污染物,有多种治理方法。
(1)用NaClO溶液将NOx转化为 :向NaClO溶液中加入硫酸,研究初始pH对NOx脱除率的影响,结果如下。
:向NaClO溶液中加入硫酸,研究初始pH对NOx脱除率的影响,结果如下。

①不用盐酸调节NaClO溶液初始pH的原因是_______ ;
②Ph=3.5时NaClO溶液脱除NOx的反应为可逆反应,以NO为例,写出该反应的离子方程式:_______ 。
(2)用尿素[(NH2)2CO]水溶液吸收氮氧化物是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。

①用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式_______ ;
②随着NO和NO2配比的提高,总氮还原率降低的主要原因是_______ 。
(3)NO、NO2用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体NaOH浴液完全吸收。已知反应后溶液含有0.35molNaNO2。若将尾气NO和NO2的平均组成用NOx表示,则
_______ 。
(4)NSR(NOx储存还原)的工作原理如下图所示,柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。

①BaO吸收NO2的反应中氧化剂与还原剂的物质的量之比是_______ ;
②富燃条件下Pt表面反应的化学方程式是_______ 。
(1)用NaClO溶液将NOx转化为
 :向NaClO溶液中加入硫酸,研究初始pH对NOx脱除率的影响,结果如下。
:向NaClO溶液中加入硫酸,研究初始pH对NOx脱除率的影响,结果如下。
①不用盐酸调节NaClO溶液初始pH的原因是
②Ph=3.5时NaClO溶液脱除NOx的反应为可逆反应,以NO为例,写出该反应的离子方程式:
(2)用尿素[(NH2)2CO]水溶液吸收氮氧化物是一种可行的方法。NO和NO2不同配比混合气通入尿素溶液中,总氮还原率与配比关系如下图。

①用尿素[(NH2)2CO]水溶液吸收体积比为1∶1的NO和NO2混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式
②随着NO和NO2配比的提高,总氮还原率降低的主要原因是
(3)NO、NO2用烧碱进行吸收,产物为NaNO2、NaNO3和H2O。现有含0.5mol氮氧化物的尾气,恰好被一定体NaOH浴液完全吸收。已知反应后溶液含有0.35molNaNO2。若将尾气NO和NO2的平均组成用NOx表示,则

(4)NSR(NOx储存还原)的工作原理如下图所示,柴油发动机工作时在稀燃(O2充足、柴油较少)和富燃(O2不足、柴油较多)条件下交替进行,通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原。

①BaO吸收NO2的反应中氧化剂与还原剂的物质的量之比是
②富燃条件下Pt表面反应的化学方程式是
您最近一年使用:0次
名校
解题方法
9 . 氧化镍( 和
和 )是制备二次电池的重要材料,实验室以粗镍板(单质
)是制备二次电池的重要材料,实验室以粗镍板(单质 ,含少量
,含少量 ,
, 杂质)为原料模拟工业制备氧化镍的流程如图所示:
杂质)为原料模拟工业制备氧化镍的流程如图所示:

相关数据如下:
回答下列问题:
(1)粗镍粉碎的作用是_______ 。
(2)溶浸时有 生成,单质镍生成
生成,单质镍生成 发生的离子反应方程式为
发生的离子反应方程式为_______ 。
(3)用氨水调节 约为5除去
约为5除去_______ ,充分反应后需加热煮沸后过滤,加热的目的是_______ 。
(4)加入饱和 溶液前需先调节
溶液前需先调节 至4.0左右,原因是
至4.0左右,原因是_______ ;滤渣2主要成分为_______ 。
(5)滤液2可以返回_______ 工序继续使用, 热分解为
热分解为 的方程式为
的方程式为_______ ;
 和
和 )是制备二次电池的重要材料,实验室以粗镍板(单质
)是制备二次电池的重要材料,实验室以粗镍板(单质 ,含少量
,含少量 ,
, 杂质)为原料模拟工业制备氧化镍的流程如图所示:
杂质)为原料模拟工业制备氧化镍的流程如图所示:
相关数据如下:
| 难溶电解质或离子 |  |  |  |  |  |
 或沉淀完全的 或沉淀完全的 | 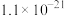 | 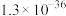 |  |  |  |
(1)粗镍粉碎的作用是
(2)溶浸时有
 生成,单质镍生成
生成,单质镍生成 发生的离子反应方程式为
发生的离子反应方程式为(3)用氨水调节
 约为5除去
约为5除去(4)加入饱和
 溶液前需先调节
溶液前需先调节 至4.0左右,原因是
至4.0左右,原因是(5)滤液2可以返回
 热分解为
热分解为 的方程式为
的方程式为
您最近一年使用:0次
名校
10 . 化学创造美好生活。下列说法错误的是
A. 可用作葡萄酒的抗氧化剂 可用作葡萄酒的抗氧化剂 |
| B.泡沫灭火器的瓶身内装有硫酸铝溶液和碳酸钠溶液 |
| C.过氧化钠可用作呼吸面罩或潜水艇的供氧剂 |
| D.维生素C与补铁口服液一起服用可促进人体对铁元素的吸收 |
您最近一年使用:0次
2023-08-27更新
|
106次组卷
|
2卷引用:吉林省四平市第一高级中学2023-2024学年高三上学期10月月考化学试题



