名校
1 . 日常消毒应做到安全消毒、有效消毒、绿色消毒。下列是我们常见的几种消毒剂:
①“84”消毒液、②高铁酸钠 、③漂白粉、④
、③漂白粉、④ 、⑤
、⑤ 、⑥碘酒、⑦75%的酒精、⑧过氧乙酸(
、⑥碘酒、⑦75%的酒精、⑧过氧乙酸( ,是一种弱酸)。回答下列问题:
,是一种弱酸)。回答下列问题:
(1)上述物质中属于电解质的是______ (填标号);“84”消毒液的有效成分NaClO在水中的电离方程式为______ 。
(2)已知反应 ,则在该反应的条件下,氧化性:
,则在该反应的条件下,氧化性:
______ (填“>”或“<”) ,当反应中转移电子的数目为
,当反应中转移电子的数目为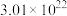 时,生成的氧气在标准状况下的体积为
时,生成的氧气在标准状况下的体积为______ L。
(3)高铁酸钠是一种新型净水剂,在水中发生反应: (胶体)
(胶体)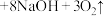 。
。
①该反应中,高铁酸钠中铁元素被______ (填“还原”或“氧化”)。
②某课外活动小组进行 胶体的制备及相关性质实验。
胶体的制备及相关性质实验。
制备:若将饱和 溶液分别滴入下列物质中,能形成胶体的是
溶液分别滴入下列物质中,能形成胶体的是______ (填标号)。
A.冷水 B.沸水 C. 浓溶液 D.
浓溶液 D. 浓溶液
浓溶液
鉴别: 胶体与
胶体与 溶液的鉴别方法是
溶液的鉴别方法是______ 。
 胶体区别于
胶体区别于 溶液最本质的特征是
溶液最本质的特征是______ 。
①“84”消毒液、②高铁酸钠
 、③漂白粉、④
、③漂白粉、④ 、⑤
、⑤ 、⑥碘酒、⑦75%的酒精、⑧过氧乙酸(
、⑥碘酒、⑦75%的酒精、⑧过氧乙酸( ,是一种弱酸)。回答下列问题:
,是一种弱酸)。回答下列问题:(1)上述物质中属于电解质的是
(2)已知反应
 ,则在该反应的条件下,氧化性:
,则在该反应的条件下,氧化性:
 ,当反应中转移电子的数目为
,当反应中转移电子的数目为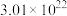 时,生成的氧气在标准状况下的体积为
时,生成的氧气在标准状况下的体积为(3)高铁酸钠是一种新型净水剂,在水中发生反应:
 (胶体)
(胶体)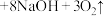 。
。①该反应中,高铁酸钠中铁元素被
②某课外活动小组进行
 胶体的制备及相关性质实验。
胶体的制备及相关性质实验。制备:若将饱和
 溶液分别滴入下列物质中,能形成胶体的是
溶液分别滴入下列物质中,能形成胶体的是A.冷水 B.沸水 C.
 浓溶液 D.
浓溶液 D. 浓溶液
浓溶液鉴别:
 胶体与
胶体与 溶液的鉴别方法是
溶液的鉴别方法是 胶体区别于
胶体区别于 溶液最本质的特征是
溶液最本质的特征是
您最近一年使用:0次
解题方法
2 . CrCl3是重要的化工试剂,用高铝铬铁矿(主要含Cr2O3和Al2O3,还含Fe2O3、FeO、MgO、SiO2)制取CrCl3的流程如下:
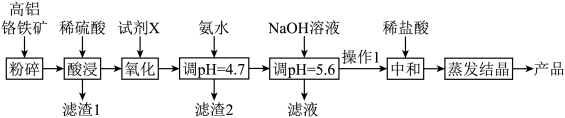
已知:①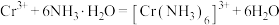
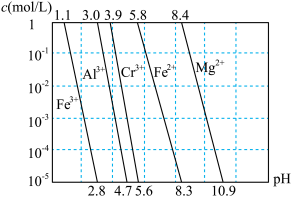
②相关金属离子在不同浓度下生成氢氧化物沉淀的 如图:
如图:
回答下列问题
(1)滤渣1主要成分是___________ ,滤渣2主要成分是___________ 。
(2)试剂X可选用___________ ,简述该流程设计添加X的好处与不好之处,好处是___________ ,不好之处是___________ 。
(3)“操作I”为过滤、洗涤,则证明沉淀洗涤干净的操作方法是___________ 。
(4)蒸发结晶操作应在___________ 条件下进行
(5)硼化铬(CrB)可用作耐磨、抗高温氧化涂层和核反应堆中的中子吸收涂层,硼化铬是在650℃时由金属镁与硼、氯化铬的混合物制得的,写出该反应的化学方程式:___________ 。

已知:①
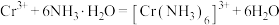
②相关金属离子在不同浓度下生成氢氧化物沉淀的
 如图:
如图:
回答下列问题
(1)滤渣1主要成分是
(2)试剂X可选用
(3)“操作I”为过滤、洗涤,则证明沉淀洗涤干净的操作方法是
(4)蒸发结晶操作应在
(5)硼化铬(CrB)可用作耐磨、抗高温氧化涂层和核反应堆中的中子吸收涂层,硼化铬是在650℃时由金属镁与硼、氯化铬的混合物制得的,写出该反应的化学方程式:
您最近一年使用:0次
解题方法
3 . 元素的单质及其化合物在生产、生活中均有重要用途。请结合相关知识回答下列问题:
(1)氯化钠是常见的调味品,也是重要的化工原料。向饱和氯化钠溶液中先后通入两种常见气体可以制备小苏打,写出后通入的气体的结构式___________ 。
(2)“84”消毒液是一种常见的消毒剂,其有效成分为 。
。
①“84”消毒液不可与洁厕灵(主要成分浓盐酸)混合使用会产生一种有毒的气体,请用离子方程式表示该反应___________ 。
②实验室要配制 的
的 溶液。所需的玻璃仪器有量筒,烧杯、玻璃棒、
溶液。所需的玻璃仪器有量筒,烧杯、玻璃棒、___________ 、___________ 。
③配制过程中,下列操作会导致溶液浓度偏低的是___________ 。(填字母序号)
A.称量 固体
固体
B.容量瓶使用时未干燥
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④将 通入冷的烧碱中可以得到
通入冷的烧碱中可以得到 和
和 ,温度较高时,还会有
,温度较高时,还会有 生成,若反应生成的
生成,若反应生成的 与
与 的物质的量之比为
的物质的量之比为 ,试从电子守恒角度分析氧化剂与还原剂的物质的量之比为
,试从电子守恒角度分析氧化剂与还原剂的物质的量之比为___________ 。
(3) 是公认的高效安全灭菌消毒剂之一
是公认的高效安全灭菌消毒剂之一
①工业上可采用 与氯酸钠在硫酸存在条件下反应制取
与氯酸钠在硫酸存在条件下反应制取 ,并生成一种酸式盐,写出工业上制取
,并生成一种酸式盐,写出工业上制取 反应的化学方程式
反应的化学方程式___________ 。
② 和
和 都是利用强氧化性来杀菌消毒,
都是利用强氧化性来杀菌消毒, 的消毒能力是
的消毒能力是 的2.5倍(以
的2.5倍(以 氧化剂生成稳定产物时得到的电子数来计算),则
氧化剂生成稳定产物时得到的电子数来计算),则 对应的稳定产物是
对应的稳定产物是___________ 。
(1)氯化钠是常见的调味品,也是重要的化工原料。向饱和氯化钠溶液中先后通入两种常见气体可以制备小苏打,写出后通入的气体的结构式
(2)“84”消毒液是一种常见的消毒剂,其有效成分为
 。
。①“84”消毒液不可与洁厕灵(主要成分浓盐酸)混合使用会产生一种有毒的气体,请用离子方程式表示该反应
②实验室要配制
 的
的 溶液。所需的玻璃仪器有量筒,烧杯、玻璃棒、
溶液。所需的玻璃仪器有量筒,烧杯、玻璃棒、③配制过程中,下列操作会导致溶液浓度偏低的是
A.称量
 固体
固体B.容量瓶使用时未干燥
C.定容时俯视刻度线
D.定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
④将
 通入冷的烧碱中可以得到
通入冷的烧碱中可以得到 和
和 ,温度较高时,还会有
,温度较高时,还会有 生成,若反应生成的
生成,若反应生成的 与
与 的物质的量之比为
的物质的量之比为 ,试从电子守恒角度分析氧化剂与还原剂的物质的量之比为
,试从电子守恒角度分析氧化剂与还原剂的物质的量之比为(3)
 是公认的高效安全灭菌消毒剂之一
是公认的高效安全灭菌消毒剂之一①工业上可采用
 与氯酸钠在硫酸存在条件下反应制取
与氯酸钠在硫酸存在条件下反应制取 ,并生成一种酸式盐,写出工业上制取
,并生成一种酸式盐,写出工业上制取 反应的化学方程式
反应的化学方程式②
 和
和 都是利用强氧化性来杀菌消毒,
都是利用强氧化性来杀菌消毒, 的消毒能力是
的消毒能力是 的2.5倍(以
的2.5倍(以 氧化剂生成稳定产物时得到的电子数来计算),则
氧化剂生成稳定产物时得到的电子数来计算),则 对应的稳定产物是
对应的稳定产物是
您最近一年使用:0次
名校
解题方法
4 . 碱式氧化镍( )可作镍电池的正极材料,现用某含镍废料(含
)可作镍电池的正极材料,现用某含镍废料(含 及少量的
及少量的 )来制备碱式氧化镍,其工艺流程如图:
)来制备碱式氧化镍,其工艺流程如图:
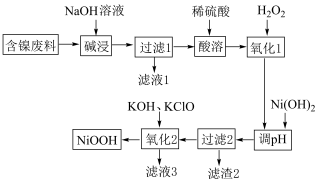
回答下列问题:
(1) 属于
属于___________ 晶体,“碱浸”前将含镍废料粉碎的目的是___________ 。
(2)“碱浸”过程中发生反应的化学方程式是___________ 、___________ 。
(3)用文字说明加入 的目的:
的目的:___________ ;查阅资料得知实际生产中 的用量比理论用量多,试分析其可能的原因:
的用量比理论用量多,试分析其可能的原因:___________ (填一条即可)。
(4)“氧化2”中发生反应的离子方程式为___________ 。
(5)丁二酮肟检验 时生成物质
时生成物质 (结构如图),
(结构如图), 的结构中存在的作用力为
的结构中存在的作用力为___________ (填标号)。
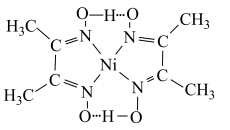
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
 )可作镍电池的正极材料,现用某含镍废料(含
)可作镍电池的正极材料,现用某含镍废料(含 及少量的
及少量的 )来制备碱式氧化镍,其工艺流程如图:
)来制备碱式氧化镍,其工艺流程如图:
回答下列问题:
(1)
 属于
属于(2)“碱浸”过程中发生反应的化学方程式是
(3)用文字说明加入
 的目的:
的目的: 的用量比理论用量多,试分析其可能的原因:
的用量比理论用量多,试分析其可能的原因:(4)“氧化2”中发生反应的离子方程式为
(5)丁二酮肟检验
 时生成物质
时生成物质 (结构如图),
(结构如图), 的结构中存在的作用力为
的结构中存在的作用力为
A.共价键 B.离子键 C.配位键 D.金属键 E.氢键
您最近一年使用:0次
名校
解题方法
5 . 工业上以黄铜矿(主要成分为 )为原料生产铜,同时获取副产物硫单质,原料的综合利用率较高。氯化铁溶液与黄铜矿的反应为
)为原料生产铜,同时获取副产物硫单质,原料的综合利用率较高。氯化铁溶液与黄铜矿的反应为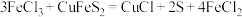 。下列说法错误的是
。下列说法错误的是
 )为原料生产铜,同时获取副产物硫单质,原料的综合利用率较高。氯化铁溶液与黄铜矿的反应为
)为原料生产铜,同时获取副产物硫单质,原料的综合利用率较高。氯化铁溶液与黄铜矿的反应为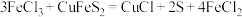 。下列说法错误的是
。下列说法错误的是A. 中 中 的化合价为 的化合价为 价 价 |
B.上述反应中, 只作氧化剂 只作氧化剂 |
C.上述反应中,每生成 硫单质,转移 硫单质,转移 电子 电子 |
D.上述反应中,被 氧化的硫元素约占变价硫元素总量的 氧化的硫元素约占变价硫元素总量的 |
您最近一年使用:0次
名校
解题方法
6 . 回收废旧电池,既可以减轻重金属对环境的污染,又可以变废为宝。对废弃的锂电池正极材料LiCoO2进行氯化处理以回收Li、Co等金属的工艺路线如图: 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 、
、 、
、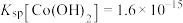 、
、 。
。
回答下列问题:
(1)写出一条提高焙烧效率的措施:_______ 。
(2)若烧渣是LiCl、 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:_______ 。
(3)简述洗涤滤饼3的操作:_______ 。
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①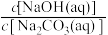
_______ (填“>”、“<”或“=”)1。
②三种溶液中由水电离出的 的浓度的关系是
的浓度的关系是_______ (用a、b、c表示)。
(5)Co2+完全沉淀时(溶液中离子浓度小于 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为_______ 。
(6)煅烧滤饼2时发生反应的化学方程式为_______ ,得到的 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为_______ 。

 的电离常数
的电离常数 ,
, 的电离常数
的电离常数 、
、 、
、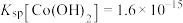 、
、 。
。回答下列问题:
(1)写出一条提高焙烧效率的措施:
(2)若烧渣是LiCl、
 和
和 的混合物,写出焙烧时发生反应的化学方程式:
的混合物,写出焙烧时发生反应的化学方程式:(3)简述洗涤滤饼3的操作:
(4)现有pH相同的以下三种溶液。
a.NaOH溶液 b.Na2CO3溶液 c.氨水
①
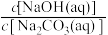
②三种溶液中由水电离出的
 的浓度的关系是
的浓度的关系是(5)Co2+完全沉淀时(溶液中离子浓度小于
 时可认为沉淀完全),溶液的pH最小值约为
时可认为沉淀完全),溶液的pH最小值约为(6)煅烧滤饼2时发生反应的化学方程式为
 的组成类似于
的组成类似于 ,则
,则 中
中 与
与 的个数比为
的个数比为
您最近一年使用:0次
2023-12-12更新
|
137次组卷
|
3卷引用:吉林省白山市抚松县第一中学2023-2024学年高二上学期12月月考化学试题
名校
7 . 维生素C是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】 ,
,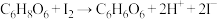 。
。
【实验用品】 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。
【实验步骤】
(1)配制待测溶液:称取新鲜水果样品 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用___________ (填“酸式”或“碱式”)滴定管盛装。
(2)氧化还原滴定法:取(1)中配制好的待测溶液 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。
①上述氧化还原滴定法应用___________ 作指示剂,滴定终点的现象为___________ 。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有___________ 。
(3)库仑滴定法:取(1)中配制好的待测溶液 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中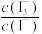 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到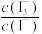 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。

①库仑仪工作时电解池的阳极反应式为___________ 。
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为___________ 。(用含 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为___________ 。这部分非电解生成的 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量___________ 。(填“偏大”或“偏小”)。
 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】
 ,
,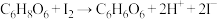 。
。【实验用品】
 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。【实验步骤】
(1)配制待测溶液:称取新鲜水果样品
 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用(2)氧化还原滴定法:取(1)中配制好的待测溶液
 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。①上述氧化还原滴定法应用
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有
(3)库仑滴定法:取(1)中配制好的待测溶液
 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中
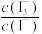 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到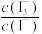 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
①库仑仪工作时电解池的阳极反应式为
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为
 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。③测定过程中,需控制电解质溶液
 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量
您最近一年使用:0次
2023-12-11更新
|
106次组卷
|
3卷引用:吉林省梅河口市第五中学2023-2024学年高二下学期开学化学试题
8 . 化工生产排放的烟气含有 和
和 ,是空气污染的重要元凶。
,是空气污染的重要元凶。
(1) 引发的环境污染有酸雨和
引发的环境污染有酸雨和_______ 。
I.硫酸盐气溶胶作为PM2.5的主要构成成分,科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制。如图所示:

(2)通过“水分子桥”,处于纳米液滴中的 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水桥”主要靠
分子。观察图示可知“水桥”主要靠_______ 形成。其中由 形成中间体
形成中间体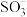 的离子方程式为
的离子方程式为_______
(3)写出 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:_______ 。
Ⅱ.工业可使用酸化的溶液处理含NO和 的烟气。
的烟气。
(4)为测定 溶液在不同温度下对烟气中的硫、硝脱除率,实验得到如下图所示结果。
溶液在不同温度下对烟气中的硫、硝脱除率,实验得到如下图所示结果。
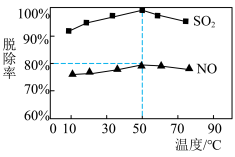
若烟气中 和NO体积比为1:1,烟气于50℃时的吸收液转化生成的
和NO体积比为1:1,烟气于50℃时的吸收液转化生成的
_______
(5)二氧化铈( )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
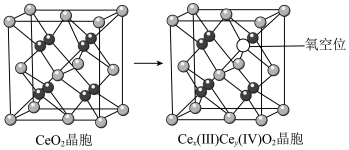
,并引起氧空位的形成,得到新的铈氧化物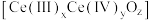 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为_______ ,当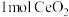 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为_______ 。
 和
和 ,是空气污染的重要元凶。
,是空气污染的重要元凶。(1)
 引发的环境污染有酸雨和
引发的环境污染有酸雨和I.硫酸盐气溶胶作为PM2.5的主要构成成分,科学家最近发现了一种利用水催化促进硫酸盐形成的化学新机制。如图所示:

(2)通过“水分子桥”,处于纳米液滴中的
 或
或 可以将电子快速转移到周围的气相
可以将电子快速转移到周围的气相 分子。观察图示可知“水桥”主要靠
分子。观察图示可知“水桥”主要靠 形成中间体
形成中间体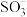 的离子方程式为
的离子方程式为(3)写出
 与
与 间发生的总反应的离子方程式:
间发生的总反应的离子方程式:Ⅱ.工业可使用酸化的溶液处理含NO和
 的烟气。
的烟气。(4)为测定
 溶液在不同温度下对烟气中的硫、硝脱除率,实验得到如下图所示结果。
溶液在不同温度下对烟气中的硫、硝脱除率,实验得到如下图所示结果。
若烟气中
 和NO体积比为1:1,烟气于50℃时的吸收液转化生成的
和NO体积比为1:1,烟气于50℃时的吸收液转化生成的
(5)二氧化铈(
 )作为一种脱硝催化剂,能在
)作为一种脱硝催化剂,能在 和
和 之间改变氧化状态,将NO氧化为
之间改变氧化状态,将NO氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物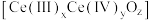 。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为
。铈氧化物晶胞发生的变化如下图所示,生成新的铈氧化物中x、y、z的最简整数比为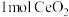 发生如图所示变化时,可吸收标况下NO的体积为
发生如图所示变化时,可吸收标况下NO的体积为
您最近一年使用:0次
9 . 根据所学知识回答下列问题:
(1)关于物质的分类,下列组合中正确的是___________(填标号)。
(2)火法炼锌反应的化学方程式为 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。
(3)铜器在空气中久置会和空气中的水蒸气、CO2、O2作用产生绿锈,该绿锈俗称铜绿,又称孔雀石[主要成分为Cu2(OH)2CO3],铜绿能与酸反应生成铜盐、CO2和H2O。
①上述描述中生成铜绿反应的化学方程式为___________ ,该反应的反应类型为___________ 。
②将少量的铜绿粉末加入足量的稀盐酸中,可观察到的现象为___________ 。
(4)现有KOH、NaHCO3和BaCl2三种无色溶液,仅选用一种试剂把它们鉴别出来,该试剂可能为___________ (填化学式)。
(5)已知:硝酸具有强氧化性,其溶液的质量分数越大,氧化性越强,质量分数越小,氧化性越弱。现将少量铁粉加入质量分数很小的硝酸中,发生的反应为Fe+HNO3→Fe(NO3)3+NH4NO3+H2O,则该反应配平后的化学方程式为___________ 。
(1)关于物质的分类,下列组合中正确的是___________(填标号)。
| 选项 | 酸 | 盐 | 氧化物 | 纯净物 |
| A | HCl | CaSO4 | SO2 | O3 |
| B | HNO3 | FeCl2 | KMnO4 | He |
| C | H3PO4 | CuSO4 | Al2O3 | 纯净的空气 |
| D | H2S | KAl(SO4)2∙12H2O | Fe2O3 | 氢氧化钠溶液 |
| A.A | B.B | C.C | D.D |
 ,下列说法正确的是___________(填标号)。
,下列说法正确的是___________(填标号)。| A.常温下,碳的化学性质很活泼 | B.CO用作还原剂时,失去电子 |
| C.ZnCO3中氧元素的质量分数为38.4% | D.该反应中,还原性:C<Zn |
①上述描述中生成铜绿反应的化学方程式为
②将少量的铜绿粉末加入足量的稀盐酸中,可观察到的现象为
(4)现有KOH、NaHCO3和BaCl2三种无色溶液,仅选用一种试剂把它们鉴别出来,该试剂可能为
(5)已知:硝酸具有强氧化性,其溶液的质量分数越大,氧化性越强,质量分数越小,氧化性越弱。现将少量铁粉加入质量分数很小的硝酸中,发生的反应为Fe+HNO3→Fe(NO3)3+NH4NO3+H2O,则该反应配平后的化学方程式为
您最近一年使用:0次
解题方法
10 . 氧化亚铜(Cu2O)可用于生产船底防污漆,以防止海洋生物对船舶设备的污染。现将Cu2O和Cu的固体混合物放入烧杯中,加入一定质量分数的稀硫酸,发生的反应为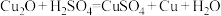 ,充分反应后,过滤,洗涤、干燥,得到4.8g固体(不考虑操作过程中的质量损失)。
,充分反应后,过滤,洗涤、干燥,得到4.8g固体(不考虑操作过程中的质量损失)。
回答下列问题:
(1)下列有关稀硫酸的说法正确的是___________(填标号)。
(2)反应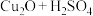
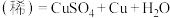 的离子方程式为
的离子方程式为___________ 。
(3)查阅资料可知, 。
。
①下列稀释浓硫酸的操作方法正确的是___________ (填标号)。
A. B.
B. C.
C.  D.
D. 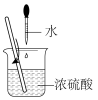
②该反应中,还原剂为___________ (填化学式)。
③用双线桥法表示该反应中电子转移的方向和数目___________ 。
(4)反应结束后,得到4.8g固体,该固体可能___________(填标号)。
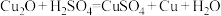 ,充分反应后,过滤,洗涤、干燥,得到4.8g固体(不考虑操作过程中的质量损失)。
,充分反应后,过滤,洗涤、干燥,得到4.8g固体(不考虑操作过程中的质量损失)。回答下列问题:
(1)下列有关稀硫酸的说法正确的是___________(填标号)。
| A.稀硫酸具有酸性和氧化性 |
| B.稀硫酸具有导电性,但稀硫酸不是电解质 |
| C.盛有稀硫酸的烧杯露置在潮湿的空气中一段时间,该稀硫酸的质量分数将变小 |
D.实验室可采用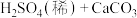 (块状) (块状)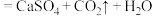 的方法来制备CO2 的方法来制备CO2 |
(2)反应
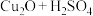
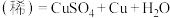 的离子方程式为
的离子方程式为(3)查阅资料可知,
 。
。①下列稀释浓硫酸的操作方法正确的是
A.
 B.
B. C.
C.  D.
D. 
②该反应中,还原剂为
③用双线桥法表示该反应中电子转移的方向和数目
(4)反应结束后,得到4.8g固体,该固体可能___________(填标号)。
| A.仅为Cu | B.仅为Cu2O和Cu |
| C.仅为Cu和CuSO4 | D.仅为Cu、CuSO4和Cu2O |
您最近一年使用:0次



