名校
1 .  作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
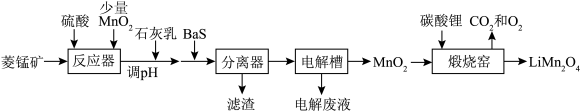
已知常温下部分物质的 如表。
如表。
回答下列问题:
(1)基态Mn原子的价电子轨道表示式为______ 。
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是______ ;若测得溶液中 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于______ 。(已知:离子浓度小于等于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)
(3)加入少量BaS溶液除去 ,生成的沉淀有
,生成的沉淀有______ (填化学式)。
(4)具有强氧化性的过一硫酸( )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ (已知: 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。
(5)煅烧窑中,生成 反应的化学方程式是
反应的化学方程式是______ 。
(6) 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。
由此可以确定,在上述温度范围内,锰元素的平均价态的变化情况是______ 。
 作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
已知常温下部分物质的
 如表。
如表。物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)基态Mn原子的价电子轨道表示式为
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是
 浓度为0.1
浓度为0.1 ,
, 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)(3)加入少量BaS溶液除去
 ,生成的沉淀有
,生成的沉淀有(4)具有强氧化性的过一硫酸(
 )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。(5)煅烧窑中,生成
 反应的化学方程式是
反应的化学方程式是(6)
 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。T/℃ |
|
|
|
700 | 5.56 | 44.58 | 49.86 |
750 | 2.56 | 44.87 | 52.57 |
800 | 5.50 | 44.17 | 50.33 |
850 | 6.22 | 44.40 | 49.38 |
您最近一年使用:0次
2024-02-25更新
|
844次组卷
|
3卷引用:2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
名校
解题方法
2 . 化学与生产生活密切相关。下列说法错误的是
A.饱和 溶液处理锅炉水垢中的 溶液处理锅炉水垢中的 ,发生了沉淀的转化 ,发生了沉淀的转化 |
B.夏天雷雨过后空气清新,是因为放电时 和 和 合成了 合成了 |
C.神舟系列飞船返回舱使用氮化硅耐高温结构材料, 属于共价晶体 属于共价晶体 |
D. 可用于污水脱氯 可用于污水脱氯 ,是由于其具有还原性 ,是由于其具有还原性 |
您最近一年使用:0次
2024-02-24更新
|
146次组卷
|
2卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三下学期开学化学试题
名校
3 . 如图是氯的价类二维图:
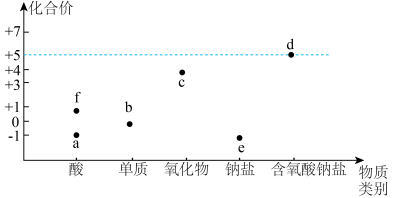
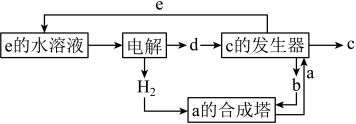
其中c是一种新型净水剂,其合成路线如图:
(1)c为___________ (填化学式)。
(2)“a时合成塔”中发生反应的化学方程式为___________ 。
(3)“c的发生器”中发生反应的离子方程式为___________ (写出正确的离子方程式并用单线桥 法分析电子转移的情况)。
(4)实验测得等物质的量的f、 、
、 具有相同的漂白能力,原因是
具有相同的漂白能力,原因是___________ 。
(5)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如: 的氧化半反应可以表示为:
的氧化半反应可以表示为: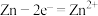 ,电解时生成d的氧化半反应式为
,电解时生成d的氧化半反应式为___________ 。
(6)为测定新型净水剂溶液中c的浓度(加入某种物质使c在溶液中稳定存在),量取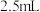 该溶液于锥形瓶中,加蒸馏水稀释到
该溶液于锥形瓶中,加蒸馏水稀释到 ,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应:
,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应: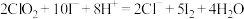 )。然后用
)。然后用 硫代硫酸钠溶液还原产生的
硫代硫酸钠溶液还原产生的 (发生反应:
(发生反应: ),完全反应时消耗的硫代硫酸钠的体积
),完全反应时消耗的硫代硫酸钠的体积 ,计算此新型净水剂中c的物质的量浓度为
,计算此新型净水剂中c的物质的量浓度为___________ 。

其中c是一种新型净水剂,其合成路线如图:

(1)c为
(2)“a时合成塔”中发生反应的化学方程式为
(3)“c的发生器”中发生反应的离子方程式为
(4)实验测得等物质的量的f、
 、
、 具有相同的漂白能力,原因是
具有相同的漂白能力,原因是(5)在氧化还原反应中,可将其拆成氧化半反应和还原半反应,比如:
 的氧化半反应可以表示为:
的氧化半反应可以表示为: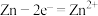 ,电解时生成d的氧化半反应式为
,电解时生成d的氧化半反应式为(6)为测定新型净水剂溶液中c的浓度(加入某种物质使c在溶液中稳定存在),量取
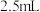 该溶液于锥形瓶中,加蒸馏水稀释到
该溶液于锥形瓶中,加蒸馏水稀释到 ,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应:
,再加入适量的稀硫酸和碘化钾溶液,此时溶液出现棕色(发生反应: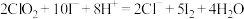 )。然后用
)。然后用 硫代硫酸钠溶液还原产生的
硫代硫酸钠溶液还原产生的 (发生反应:
(发生反应: ),完全反应时消耗的硫代硫酸钠的体积
),完全反应时消耗的硫代硫酸钠的体积 ,计算此新型净水剂中c的物质的量浓度为
,计算此新型净水剂中c的物质的量浓度为
您最近一年使用:0次
2024-02-20更新
|
111次组卷
|
2卷引用:吉林省长春市东北师大附中2023-2024学年高一上学期期末考试化学试题
名校
解题方法
4 . 某粗铜精炼得到的阳极泥主要成分为 、
、 、
、 ,从中提取
,从中提取 的工艺流程如图:
的工艺流程如图: ;
; 为弱酸。
为弱酸。
下列说法正确的是
 、
、 、
、 ,从中提取
,从中提取 的工艺流程如图:
的工艺流程如图:
 ;
; 为弱酸。
为弱酸。下列说法正确的是
A. 、 、 、 、 氧化性由强到弱的顺序为 氧化性由强到弱的顺序为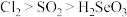 |
B.“氯化”过程中 转化为 转化为 ,反应的离子方程式为 ,反应的离子方程式为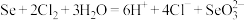 |
C. 转化为 转化为 的原因是 的原因是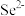 被 被 氧化为 氧化为 ,导致 ,导致 增大 增大 |
D.粗铜精炼时,若以恒定电流强度I安培持续电解t秒,电解效率为 ,当阴极增重m克时,则 ,当阴极增重m克时,则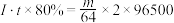 |
您最近一年使用:0次
2024-02-04更新
|
183次组卷
|
3卷引用:吉林省通化市梅河口市第五中学2023-2024学年高三下学期开学化学试题
名校
解题方法
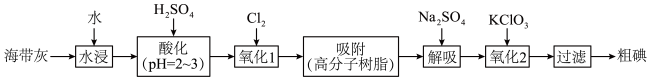
5 . 以海带为原料提取碘单质的流程如下:
(1)为提高“水浸”速率,宜采取的措施有:_____________ (任写两种);“氧化1”中 ,不宜过量的原因是
,不宜过量的原因是_____ 。
(2)“过滤”操作需要的玻璃仪器有______ (填仪器名称)。
(3)“吸附”的目的是______ 。
(4)“解吸”中氧化剂、还原剂的物质的量之比为______ 。
(5)“氧化2”中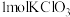 完全反应转移
完全反应转移 电子。与出该反应的离子方程式:
电子。与出该反应的离子方程式:______ 。
(6)利用如图装置提纯碘。
提纯 的原理是
的原理是______ ,棉花防止碘扩散到空气中造成污染。
(1)为提高“水浸”速率,宜采取的措施有:
 ,不宜过量的原因是
,不宜过量的原因是(2)“过滤”操作需要的玻璃仪器有
(3)“吸附”的目的是
(4)“解吸”中氧化剂、还原剂的物质的量之比为
(5)“氧化2”中
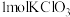 完全反应转移
完全反应转移 电子。与出该反应的离子方程式:
电子。与出该反应的离子方程式:(6)利用如图装置提纯碘。
提纯
 的原理是
的原理是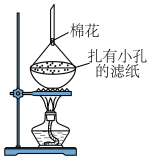
您最近一年使用:0次
2024-01-24更新
|
87次组卷
|
3卷引用:吉林省白城市通榆县第一中学校2023-2024学年高三上学期第四次质量检测 化学试题
名校
6 . 实验室合成高铁酸钾( )的过程如下图所示。下列说法错误的是
)的过程如下图所示。下列说法错误的是
 )的过程如下图所示。下列说法错误的是
)的过程如下图所示。下列说法错误的是
A.气体a的主要成分为 |
B.沉淀b的主要成分为 |
C. 中 中 的化合价为 的化合价为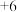 |
D.反应2为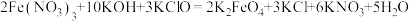 |
您最近一年使用:0次
2024-01-22更新
|
972次组卷
|
6卷引用:2024年1月吉林、黑龙江普通高等学校招生考试适应性测试化学试题
2024年1月吉林、黑龙江普通高等学校招生考试适应性测试化学试题(已下线)选择题11-15(已下线)2024年1月“九省联考”黑龙江、吉林卷真题完全解读与考后提升河南省信阳高级中学2023-2024学年高一下学期开学化学试题河南省郑州市宇华实验学校2023-2024学年高二下学期开学考试化学试题湖南省长沙市雅礼中学2023-2024学年高三下学期月考(八)化学试题
7 . 已知:锂钴电池总反应: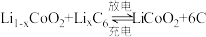 ,过程如图:
,过程如图:
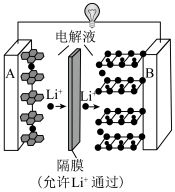
(1) 中,Co元素的化合价为
中,Co元素的化合价为___________ ;锂电池发生火灾时,和氧气发生反应的主要物质是___________ (填“正”或“负”)极材料;充电时阳极的反应方程式是___________ 。
(2)锂电池成本高昂,废弃后需回收其中的锂和钴元素,先将上述锂电池进行放电处理,拆卸后,再将正极材料 涂覆在铝箔上,进行电解,浸出
涂覆在铝箔上,进行电解,浸出 和
和 ,装置如图所示,该条件下副反应忽略不计。
,装置如图所示,该条件下副反应忽略不计。
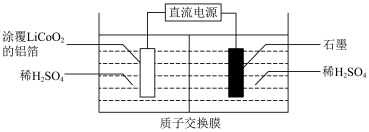
①拆卸前,将锂电池放电处理有利于锂在正极的回收,其原因是___________ 。
②石墨电极连接电源的___________ 极(填“正”或“负”)。
③结合电极反应,指出阴极室的pH变化并解释原因:___________ 。
(3)当前,三元正极材料——镍钴锰酸锂应用广泛,其化学式可写作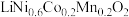 。可用
。可用 、
、 、
、 、
、 与空气混合加热烧结制得,写出制备的化学方程式:
与空气混合加热烧结制得,写出制备的化学方程式:___________ (设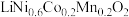 的计量系数为1)。
的计量系数为1)。
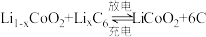 ,过程如图:
,过程如图:
(1)
 中,Co元素的化合价为
中,Co元素的化合价为(2)锂电池成本高昂,废弃后需回收其中的锂和钴元素,先将上述锂电池进行放电处理,拆卸后,再将正极材料
 涂覆在铝箔上,进行电解,浸出
涂覆在铝箔上,进行电解,浸出 和
和 ,装置如图所示,该条件下副反应忽略不计。
,装置如图所示,该条件下副反应忽略不计。
①拆卸前,将锂电池放电处理有利于锂在正极的回收,其原因是
②石墨电极连接电源的
③结合电极反应,指出阴极室的pH变化并解释原因:
(3)当前,三元正极材料——镍钴锰酸锂应用广泛,其化学式可写作
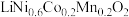 。可用
。可用 、
、 、
、 、
、 与空气混合加热烧结制得,写出制备的化学方程式:
与空气混合加热烧结制得,写出制备的化学方程式: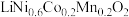 的计量系数为1)。
的计量系数为1)。
您最近一年使用:0次
名校
解题方法
8 . 下列有关物质用途的叙述中,错误的是
| A.醋酸既能除去水垢,也能除去铁锈 |
| B.热的碳酸钠溶液可以洗去物品表面的柴油 |
| C.穿久变黄的白衬衫用高锰酸钾溶液浸泡后,加入维生素C洗涤,可恢复白色 |
| D.葡萄酒中添加少量二氧化硫可以起到杀菌的作用 |
您最近一年使用:0次
名校
解题方法
9 . 1808年,英国化学家戴维用钾还原氧化镁,最早制得少量的镁。镁是航空工业的重要材料,镁合金用于制造飞机机身、发动机零件等,一架超音速飞机约有5%的镁合金构件,一枚导弹一般消耗100~200公斤镁合金;镁作为一种强还原剂,还用于钛、锆、铍和铀等的生产中;镁是燃烧弹和照明弹不能缺少的组成物;镁粉是节日烟花必需的原料。镁及其合金是一种用途很广泛的金属材料,目前世界上60%的镁是从海水中提取的。从海水(主要含NaCl和 )中提取金属镁的主要步骤如下:
)中提取金属镁的主要步骤如下:
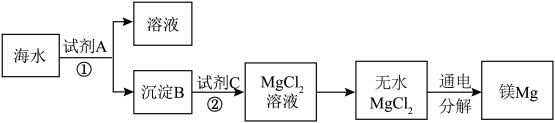
回答下列问题:
(1)Mg在周期表中的位置________ ,试剂A可以选用_______ ,试剂C可选用________ 。
(2)步骤①的离子方程式________ 。
(3)用电子式表示氯化镁的形成过程___________ 。
(4)无水 在熔融状态下,通电后会产生Mg和
在熔融状态下,通电后会产生Mg和 ,该反应的化学方程式为:
,该反应的化学方程式为:_________ 。
(5)戴维制镁的化学方程式为_________ 。
(6)配平下列反应的方程式。
①_____ 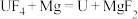
②_____ 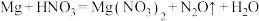
 )中提取金属镁的主要步骤如下:
)中提取金属镁的主要步骤如下:
回答下列问题:
(1)Mg在周期表中的位置
(2)步骤①的离子方程式
(3)用电子式表示氯化镁的形成过程
(4)无水
 在熔融状态下,通电后会产生Mg和
在熔融状态下,通电后会产生Mg和 ,该反应的化学方程式为:
,该反应的化学方程式为:(5)戴维制镁的化学方程式为
(6)配平下列反应的方程式。
①
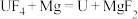
②
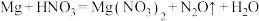
您最近一年使用:0次
名校
10 . 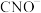 在酸性条件下与NaClO反应生成
在酸性条件下与NaClO反应生成 、
、 、
、 等。写出
等。写出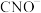 在酸性条件下被NaClO氧化的离子方程式:
在酸性条件下被NaClO氧化的离子方程式:___________ 。
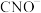 在酸性条件下与NaClO反应生成
在酸性条件下与NaClO反应生成 、
、 、
、 等。写出
等。写出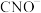 在酸性条件下被NaClO氧化的离子方程式:
在酸性条件下被NaClO氧化的离子方程式:
您最近一年使用:0次







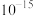

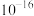
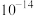
 /%
/% /%
/% /%
/%

