解题方法
1 . 高铁酸钾 是一种新型高效消毒剂,主要用于饮用水处理等。由于
是一种新型高效消毒剂,主要用于饮用水处理等。由于 对水体净化的优越性能,可将其应用到游泳池水的循环再生,
对水体净化的优越性能,可将其应用到游泳池水的循环再生, 不仅能消毒杀菌,去除人体带入的污物和悬浮固体,而且对人体无任何伤害与刺激,安全无异味,投加方便。它的一种制备原理如下:①
不仅能消毒杀菌,去除人体带入的污物和悬浮固体,而且对人体无任何伤害与刺激,安全无异味,投加方便。它的一种制备原理如下:①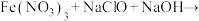
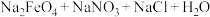 (末配平) ②
(末配平) ②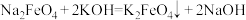 ,下列有关说法错误的是
,下列有关说法错误的是
 是一种新型高效消毒剂,主要用于饮用水处理等。由于
是一种新型高效消毒剂,主要用于饮用水处理等。由于 对水体净化的优越性能,可将其应用到游泳池水的循环再生,
对水体净化的优越性能,可将其应用到游泳池水的循环再生, 不仅能消毒杀菌,去除人体带入的污物和悬浮固体,而且对人体无任何伤害与刺激,安全无异味,投加方便。它的一种制备原理如下:①
不仅能消毒杀菌,去除人体带入的污物和悬浮固体,而且对人体无任何伤害与刺激,安全无异味,投加方便。它的一种制备原理如下:①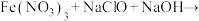
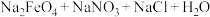 (末配平) ②
(末配平) ②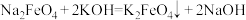 ,下列有关说法错误的是
,下列有关说法错误的是| A.去除悬浮固体利用了胶体的吸附性 |
B.由反应②可知 的溶解度大于 的溶解度大于 |
C.反应①中氧化剂与还原剂的物质的量之比为 |
D.每转移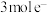 ,可制得 ,可制得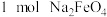 |
您最近一年使用:0次
2023-06-27更新
|
137次组卷
|
4卷引用:山西省忻州市2022-2023学年高二下学期期末联合考试化学试题
2 . 关于方程式□C2H6O+□KMnO4+□H2SO4=□K2SO4+□X+□CO2↑+□H2O(未配平)下列说法正确的是
| A.X的化学式为K2MnO4 | B.氧化产物是CO2 |
| C.每消耗1molC2H6O需要转移的电子数为6NA | D.H2SO4的化学计量数为20 |
您最近一年使用:0次
2023-06-25更新
|
156次组卷
|
2卷引用:山西省大同市阳高县第四中学校2022-2023学年高二下学期7月期末考试化学试题
名校
3 . 工业上常用 处理含
处理含 的废液,反应的离子方程式为:
的废液,反应的离子方程式为:
 。下列判断正确的是
。下列判断正确的是
 处理含
处理含 的废液,反应的离子方程式为:
的废液,反应的离子方程式为:
 。下列判断正确的是
。下列判断正确的是A.氧化产物是 | B.氧化剂与还原剂的物质的量之比是 |
C. 表现了氧化性 表现了氧化性 | D.1mol  参与反应,电子转移3mol 参与反应,电子转移3mol |
您最近一年使用:0次
2023-06-25更新
|
274次组卷
|
3卷引用:山西省大同市第三中学校2023-2024学年高一上学期期中考试化学试卷
山西省大同市第三中学校2023-2024学年高一上学期期中考试化学试卷上海市进才中学2022-2023学年高一下学期期末考试化学试题(已下线)专题05 氧化还原反应和离子反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(上海专用)
名校
解题方法
4 . 已知 为正盐,能将溶液中的
为正盐,能将溶液中的 还原为Ag,可用于化学镀银。反应的离子方程式
还原为Ag,可用于化学镀银。反应的离子方程式 (未配平)。下列说法正确的是
(未配平)。下列说法正确的是
 为正盐,能将溶液中的
为正盐,能将溶液中的 还原为Ag,可用于化学镀银。反应的离子方程式
还原为Ag,可用于化学镀银。反应的离子方程式 (未配平)。下列说法正确的是
(未配平)。下列说法正确的是| A.上述反应中,氧化产物是Ag |
B. 中P元素的化合价为+1价 中P元素的化合价为+1价 |
| C.该反应氧化剂与还原剂的物质的量之比为1:4 |
D. 是三元酸,与NaOH反应可生成三种盐 是三元酸,与NaOH反应可生成三种盐 |
您最近一年使用:0次
2023-06-21更新
|
85次组卷
|
2卷引用:山西省大同市2022-2023学年高二下学期6月学情调研测试化学试题
解题方法
5 . 海水是一个巨大的化学资源宝库。回答下列问题:
(1)海水提溴工艺中,发生反应: ,该反应中氧化剂是
,该反应中氧化剂是__________ ,它在反应中__________ (填“得到”或“失去”)电子;现有 标准状况下的
标准状况下的 参加该反应,则理论上可转化
参加该反应,则理论上可转化 的物质的量是
的物质的量是_________  。
。
(2)利用化学沉淀法可以去除粗盐中的杂质离子( 等)。向某粗盐水滴加过量
等)。向某粗盐水滴加过量 溶液,有关反应的离子方程式为
溶液,有关反应的离子方程式为__________ ,滴加 溶液略微过量的目的是
溶液略微过量的目的是__________ 。
(3)在常温下,将氯气通入 溶液中,可以得到一种漂白液,上述反应的化学方程式为
溶液中,可以得到一种漂白液,上述反应的化学方程式为__________ ,该漂白液的有效成分是__________ (填名称)。
(1)海水提溴工艺中,发生反应:
 ,该反应中氧化剂是
,该反应中氧化剂是 标准状况下的
标准状况下的 参加该反应,则理论上可转化
参加该反应,则理论上可转化 的物质的量是
的物质的量是 。
。(2)利用化学沉淀法可以去除粗盐中的杂质离子(
 等)。向某粗盐水滴加过量
等)。向某粗盐水滴加过量 溶液,有关反应的离子方程式为
溶液,有关反应的离子方程式为 溶液略微过量的目的是
溶液略微过量的目的是(3)在常温下,将氯气通入
 溶液中,可以得到一种漂白液,上述反应的化学方程式为
溶液中,可以得到一种漂白液,上述反应的化学方程式为
您最近一年使用:0次
6 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为_______ (答出一条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸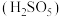 ,
, 中过氧键的数目为
中过氧键的数目为_______ 。
(3)“氧化”中,用石灰乳调节 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ ( 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、_______ (填化学式)。
(4)“氧化”中保持空气通入速率不变, (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为_______ 时, (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是_______ 。
 (Ⅱ)在空气中可被氧化成
(Ⅱ)在空气中可被氧化成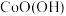 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
(6)“沉镁”中为使 沉淀完全
沉淀完全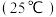 ,需控制
,需控制 不低于
不低于_______ (精确至0.1)。
 和
和 )。实现镍、钴、镁元素的回收。
)。实现镍、钴、镁元素的回收。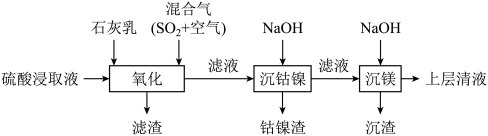
| 物质 |  |  |  |  |
 |  |  |  | 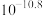 |
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸
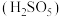 ,
, 中过氧键的数目为
中过氧键的数目为(3)“氧化”中,用石灰乳调节
 ,
, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、(4)“氧化”中保持空气通入速率不变,
 (Ⅱ)氧化率与时间的关系如下。
(Ⅱ)氧化率与时间的关系如下。 体积分数为
体积分数为 (Ⅱ)氧化速率最大;继续增大
(Ⅱ)氧化速率最大;继续增大 体积分数时,
体积分数时, (Ⅱ)氧化速率减小的原因是
(Ⅱ)氧化速率减小的原因是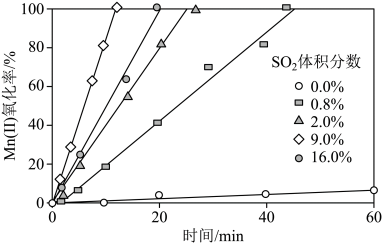
 (Ⅱ)在空气中可被氧化成
(Ⅱ)在空气中可被氧化成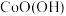 ,该反应的化学方程式为
,该反应的化学方程式为(6)“沉镁”中为使
 沉淀完全
沉淀完全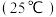 ,需控制
,需控制 不低于
不低于
您最近一年使用:0次
2023-06-13更新
|
12087次组卷
|
20卷引用:山西省三重教育联盟2023-2024学年高三上学期9月联考化学试题
山西省三重教育联盟2023-2024学年高三上学期9月联考化学试题2023年高考辽宁卷化学真题(已下线)T16-工业流程题(已下线)2023年高考化学真题完全解读(辽宁卷)(已下线)专题18 工艺流程题(已下线)2023年高考山东卷化学真题变式题(工业流程题)(已下线)专题18 工艺流程题(已下线)专题18 工艺流程题(已下线)第19练 化学工艺流程题 -2023年【暑假分层作业】高二化学(2024届一轮复习通用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(新高考专用)(已下线)专题13 工艺流程综合题-2023年高考化学真题题源解密(全国通用)江苏省华罗庚中学2023-2024学年高三夏令营学习能力测试化学试题四川省成都市第七中学2023-2024学年高三上学期入学考试理综化学试题(已下线)考点47 无机工艺流程(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)江苏省镇江市丹阳市吕叔湘中学2023-2024学年高三上学期10月月考化学试题吉林省通化市梅河口市第五中学2023-2024学年高二上学期1月期末化学试题辽宁省葫芦岛市第一高级中学2023-2024学年高二上学期化学期末复习提升卷福建泉州科技中学2022-2023学年高二下学期期末考化学试题甘肃省白银市会宁县第四中学2023-2024学年高三上学期第三次月考化学试题(已下线)测试辽宁化学 请勿下载
解题方法
7 . 亚硝酸和硝酸是常见的两种氮的含氧酸,亚硝酸钠(NaNO2)有毒,也有一定氧化性,已知高铁血红蛋白( )无携氧能力。
)无携氧能力。
(1)亚硝酸钠使人体中毒的原因为___________ 。
(2)误食亚硝酸钠可立即服用下列物质中的___________ ,以起到解毒效果。
A.高锰酸钾晶体 B.维生素C C.FeCl3固体
(3)某实验小组模拟用H2O2氧化除去废水中的NO2和NH ,实验数据如下表,消除NH
,实验数据如下表,消除NH 时可能发生的离子反应有
时可能发生的离子反应有___________ 。已知上述反应在该条件下均有较大反应限度,但混合体系中NH 浓度几乎未发生变化的原因是
浓度几乎未发生变化的原因是___________ ,若取1L废水进行实验,则实验2中转移电子的物质的量约为___________ mol。
(4)将6.4g铜片加入100mL9mol/L的硝酸溶液中,铜片完全溶解,并产生标准状况下2.24L气体(气体为NO和NO2的混合气体,不含N2O4),则向反应后的溶液中加入___________ mL浓度为4mol/L的NaOH溶液,可使 恰好完全沉淀。若将产生的气体与足量氧气混合通入水中充分反应,至少需要标准状况下的氧气
恰好完全沉淀。若将产生的气体与足量氧气混合通入水中充分反应,至少需要标准状况下的氧气___________ L。
 )无携氧能力。
)无携氧能力。(1)亚硝酸钠使人体中毒的原因为
(2)误食亚硝酸钠可立即服用下列物质中的
A.高锰酸钾晶体 B.维生素C C.FeCl3固体
(3)某实验小组模拟用H2O2氧化除去废水中的NO2和NH
 ,实验数据如下表,消除NH
,实验数据如下表,消除NH 时可能发生的离子反应有
时可能发生的离子反应有 浓度几乎未发生变化的原因是
浓度几乎未发生变化的原因是| 温度:283K,反应时间:30min | ||||||
| 序号 | 反应前(mg/L) | 反应后(mg/L) | ||||
| [NO2] | [ ] ] | [H2O2] | [NO2] | [ ] ] | 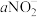 (%) (%) | |
| 1 | 0.000 | 1.00 | 0.66 | 0.000 | 1.00 | 0.0 |
| 2 | 0.100 | 1.00 | 0.66 | 0.048 | 1.00 | 52.0 |
| 3 | 0.100 | 1.00 | 0.00 | 0.100 | 1.00 | 0.0 |
| 4 | 0.500 | 5.00 | 0.00 | 0.498 | 5.00 | 0.4 |
| 5 | 0.500 | 5.00 | 60.0 | 0.200 | 4.98 | 60.0 |
 恰好完全沉淀。若将产生的气体与足量氧气混合通入水中充分反应,至少需要标准状况下的氧气
恰好完全沉淀。若将产生的气体与足量氧气混合通入水中充分反应,至少需要标准状况下的氧气
您最近一年使用:0次
解题方法
8 . 利用NH3吸收液和ClO2可实现煤炭燃烧烟气高效脱硫(SO2)脱硝(NO),吸收处理后得到废液,其成分主要为(NH4)2SO4、NH4NO3、NH4Cl。已知ClO2在碱性条件下会产生 ,下列说法错误的是
,下列说法错误的是
 ,下列说法错误的是
,下列说法错误的是A.脱除NO的总反应为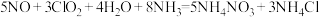 |
| B.标准状况下,脱除含SO2、NO各0.1mol的烟气,至少共需要8.96LNH3 |
| C.每生成1molNH4Cl至少需要1molClO2 |
| D.碱性越强,脱除效率越高 |
您最近一年使用:0次
解题方法
9 . 我国科学家首次实现了CO2直接加氢制取高辛烷值汽油,转化关系如图,下列说法错误的是
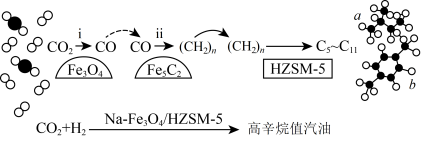

A.反应ⅱ为 |
| B.1molCO2完全转化为 (CH2)n得到4NA个电子 |
| C.a的化学名称为2-甲基丁烷 |
| D.b的一氯取代物有2种结构 |
您最近一年使用:0次
名校
解题方法
10 . 氧钒(Ⅳ)碱式碳酸铵晶体难溶于水,是制备热敏材料VO2的原料,其化学式为(NH4)5[(VO)6(CO3)4(OH)9]·10H2O。实验室以VOCl2和NH4HCO3为原料制备氧钒( Ⅳ )碱式碳酸铵晶体的装置如图所示。
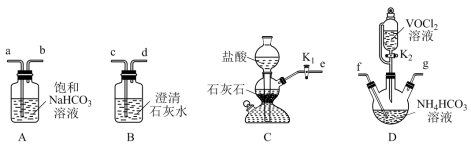
已知:+4价钒的化合物易被氧化。
回答下列问题:
(1)装置D中盛放NH4HCO3溶液的仪器名称是______ ;上述装置依次连接的合理顺序为e→______ (按气流方向,用小写字母表示)。
(2)实验开始时,先关闭K2,打开K1,当______ (填实验现象)时,关闭K1,打开K2,进行实验。
(3)实验完毕后,从装置D中分离产品的操作方法是_____ (填操作名称)。
(4)测定粗产品中钒的含量。实验步骤如下:
称量a g产品于锥形瓶中,用20 mL蒸馏水与30 mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe( SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知: +Fe2++2H+= VO2++Fe3++H2O)
+Fe2++2H+= VO2++Fe3++H2O)
① 中V的化合价
中V的化合价_____________ 。
②过量KMnO4溶液的作用是___________ 。
③粗产品中钒的质量分数表达式为___________ (以VO2计)。
④若(NH4)2Fe( SO4)2标准溶液部分变质,会使测定结果___________ ( 填“偏高”、“偏低”或“无影响”)。

已知:+4价钒的化合物易被氧化。
回答下列问题:
(1)装置D中盛放NH4HCO3溶液的仪器名称是
(2)实验开始时,先关闭K2,打开K1,当
(3)实验完毕后,从装置D中分离产品的操作方法是
(4)测定粗产品中钒的含量。实验步骤如下:
称量a g产品于锥形瓶中,用20 mL蒸馏水与30 mL稀硫酸溶解后,加入0.02mol/LKMnO4溶液至稍过量,充分反应后继续滴加1%的NaNO2溶液至稍过量,再用尿素除去过量NaNO2,最后用c mol/L (NH4)2Fe( SO4)2标准溶液滴定至终点,消耗标准溶液的体积为b mL。(已知:
 +Fe2++2H+= VO2++Fe3++H2O)
+Fe2++2H+= VO2++Fe3++H2O)①
 中V的化合价
中V的化合价②过量KMnO4溶液的作用是
③粗产品中钒的质量分数表达式为
④若(NH4)2Fe( SO4)2标准溶液部分变质,会使测定结果
您最近一年使用:0次



