名校
解题方法
1 . 化学与生产、生活息息相关。回答下列问题:
(1)小苏打在面包行业,不仅可以做膨松剂,还可以调节酸度。写出用小苏打调节酸度时发生反应的离子方程式:
(2)沾有水的铁锅在高温火焰上灼烧会发黑,该反应的化学方程式为
(3)SO2是一种酸性氧化物,有类似CO2的性质,写出过量的SO2与NaOH溶液反应的离子方程式:
(4)有人误把洁厕灵(主要成分为盐酸)和“84”消毒液(主要成分为NaClO)一起倒在马桶里,结果产生大量的黄绿色气体。该反应的离子方程式为
(5)我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为
 。该反应中被还原的元素是
。该反应中被还原的元素是(6)安全气囊弹出时发生反应:10NaN3+2KNO3=K2O+5Na2O+16N2↑,该反应中氧化产物与还原产物的物质的量之比为
 (
( 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2023-12-21更新
|
195次组卷
|
3卷引用:山西省大同市2023-2024学年高一上学期12月月考化学试题
名校
2 . 设 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,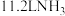 中含有的氢原子数为 中含有的氢原子数为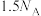 |
B.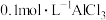 溶液中含有的 溶液中含有的 数目为 数目为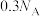 |
C.标准状况下, 完全溶于水形成氯水时,转移电子数小于 完全溶于水形成氯水时,转移电子数小于 |
D.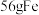 与足量的 与足量的 反应,转移的电子数为 反应,转移的电子数为 |
您最近一年使用:0次
2023-12-21更新
|
481次组卷
|
3卷引用:山西省大同市2023-2024学年高一上学期12月月考化学试题
3 . 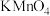 溶液和
溶液和 溶液都是临床上常用的外用消毒剂,酸性条件下两者混合会发生反应:
溶液都是临床上常用的外用消毒剂,酸性条件下两者混合会发生反应: 。下列有关判断正确的是
。下列有关判断正确的是
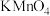 溶液和
溶液和 溶液都是临床上常用的外用消毒剂,酸性条件下两者混合会发生反应:
溶液都是临床上常用的外用消毒剂,酸性条件下两者混合会发生反应: 。下列有关判断正确的是
。下列有关判断正确的是A.该反应中 作氧化剂 作氧化剂 | B.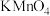 的氧化性强于 的氧化性强于 |
C.反应中 发生了还原反应 发生了还原反应 | D.每生成1个 分子时,反应中转移4个电子 分子时,反应中转移4个电子 |
您最近一年使用:0次
4 . 长途运输鱼苗时,可在水中加入过氧化钙( ),其与水发生反应的方程式为
),其与水发生反应的方程式为 。下列有关说法正确的是
。下列有关说法正确的是
 ),其与水发生反应的方程式为
),其与水发生反应的方程式为 。下列有关说法正确的是
。下列有关说法正确的是A. 是氧化剂, 是氧化剂, 是还原剂 是还原剂 |
B. 是还原产物, 是还原产物, 是氧化产物 是氧化产物 |
C.每转移4mol电子,有1mol 生成 生成 |
D.1mol 参加反应一定生成11.2L 参加反应一定生成11.2L |
您最近一年使用:0次
名校
5 . 维生素C是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】 ,
,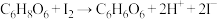 。
。
【实验用品】 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。
【实验步骤】
(1)配制待测溶液:称取新鲜水果样品 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用___________ (填“酸式”或“碱式”)滴定管盛装。
(2)氧化还原滴定法:取(1)中配制好的待测溶液 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。
①上述氧化还原滴定法应用___________ 作指示剂,滴定终点的现象为___________ 。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有___________ 。
(3)库仑滴定法:取(1)中配制好的待测溶液 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中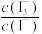 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到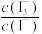 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。

①库仑仪工作时电解池的阳极反应式为___________ 。
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为___________ 。(用含 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为___________ 。这部分非电解生成的 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量___________ 。(填“偏大”或“偏小”)。
 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】
 ,
,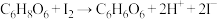 。
。【实验用品】
 标准溶液、指示剂、
标准溶液、指示剂、 溶液、
溶液、 溶液、蒸馏水等。
溶液、蒸馏水等。【实验步骤】
(1)配制待测溶液:称取新鲜水果样品
 ,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
,加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用(2)氧化还原滴定法:取(1)中配制好的待测溶液
 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
的质量分数。①上述氧化还原滴定法应用
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有
(3)库仑滴定法:取(1)中配制好的待测溶液
 ,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
,用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中
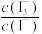 保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将 还原,库仑仪便立即自动进行电解到
还原,库仑仪便立即自动进行电解到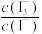 又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。
①库仑仪工作时电解池的阳极反应式为
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为
 ,则新鲜水果中维生素C的质量分数为
,则新鲜水果中维生素C的质量分数为 的代数式表示)已知:电解中转移
的代数式表示)已知:电解中转移 电子所消耗的电量为96500库仑。
电子所消耗的电量为96500库仑。③测定过程中,需控制电解质溶液
 ,当
,当 时,部分
时,部分 易被空气中的
易被空气中的 直接氧化为
直接氧化为 ,该过程的离子方程式为
,该过程的离子方程式为 ;将导致测得的维生素C的含量
;将导致测得的维生素C的含量
您最近一年使用:0次
2023-12-11更新
|
105次组卷
|
3卷引用:山西省朔州市怀仁市2023-2024学年高二上学期1月期末化学试题
名校
6 . 氯化亚铜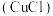 常用作有机合成催化剂、石油工业脱色剂和脱硫剂。其种制备方法如下:
常用作有机合成催化剂、石油工业脱色剂和脱硫剂。其种制备方法如下:
①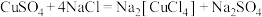 ;
;
② 。
。
下列说法错误的是
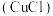 常用作有机合成催化剂、石油工业脱色剂和脱硫剂。其种制备方法如下:
常用作有机合成催化剂、石油工业脱色剂和脱硫剂。其种制备方法如下:①
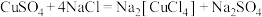 ;
;②
 。
。下列说法错误的是
| A.反应①为非氧化还原反应,反应②为氧化还原反应 |
B. 中铜元素的化合价为 中铜元素的化合价为 价 价 |
| C.反应①②涉及的物质中有一种酸性氧化物 |
D.每转移 电子、生成 电子、生成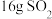 |
您最近一年使用:0次
2023-12-01更新
|
180次组卷
|
6卷引用:山西省2023-2024学年高一上学期12月联合考试化学试题
名校
解题方法
7 . 根据如图所示的转化关系判断,下列说法正确的是(反应条件已略去)


A.生成等质量 时,①和②反应消耗 时,①和②反应消耗 |
B.反应③和④消耗等量的Al时,生成的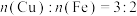 |
| C.反应③中氧化剂与还原剂的物质的量之比为2∶3 |
D.反应⑤的离子方程式为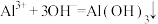 |
您最近一年使用:0次
2023-11-29更新
|
149次组卷
|
8卷引用:山西省太原市第五中学2020-2021学年高一上学期12月阶段性检测化学试题
名校
解题方法
8 . 氮化硅( )陶瓷材料可应用于原子反应堆。氮化硅可由下列反应制得:
)陶瓷材料可应用于原子反应堆。氮化硅可由下列反应制得: 。已知:
。已知: 中
中 元素的化合价为-3。
元素的化合价为-3。
回答下列问题:
(1)上述反应涉及的物质中属于氧化物的是___________ (填化学式)。碳元素存在多种单质,其中金刚石和石墨是应用最广泛的两种,它们互为___________ 。
(2)该反应的氧化剂是___________ (填化学式,下同),被氧化的物质是___________ ,氧化产物与还原产物的质量之比为___________ 。
(3)用双线桥法标出上述反应中电子转移的方向和数目:___________ 。
(4)若生成标准状况下 ,则反应过程中转移
,则反应过程中转移___________ 电子。
 )陶瓷材料可应用于原子反应堆。氮化硅可由下列反应制得:
)陶瓷材料可应用于原子反应堆。氮化硅可由下列反应制得: 。已知:
。已知: 中
中 元素的化合价为-3。
元素的化合价为-3。回答下列问题:
(1)上述反应涉及的物质中属于氧化物的是
(2)该反应的氧化剂是
(3)用双线桥法标出上述反应中电子转移的方向和数目:
(4)若生成标准状况下
 ,则反应过程中转移
,则反应过程中转移
您最近一年使用:0次
2023-11-28更新
|
113次组卷
|
2卷引用:山西省吕梁市2023-2024学年高三上学期11月期中化学试题
名校
9 . 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化情况如图所示。则下列说法中不正确的是(已知:还原性:I->Fe2+>Br-)
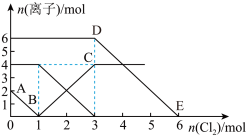

| A.DE线段的反应方程式:2Br-+Cl2=Br2+2Cl- |
| B.原混合溶液中FeBr2的物质的量为3mol |
| C.线段AB表示Fe2+被氯气氧化 |
| D.原溶液中:n(Fe2+):n (I-):n (Br-)=2:1:3 |
您最近一年使用:0次
2023-11-26更新
|
539次组卷
|
3卷引用:山西省实验中学2023-2024学年高一上学期期中考试化学试题
山西省实验中学2023-2024学年高一上学期期中考试化学试题山西省实验中学2023-2024学年高一上学期期中考试化学试题(已下线)寒假作业05 氯及其化合物-【寒假分层作业】2024年高一化学寒假培优练(人教版2019必修第一册)
名校
10 . NA代表阿伏加德罗常数的值。下列说法正确的是
| A.标准状况下,2.24 L N2和O2的混合气体中气体分子总数为0.2NA |
| B.39 g Na2O2中含有的离子总数为1.5NA |
| C.1 mol Cl2与足量的Fe反应,转移电子数为3NA |
| D.1 mol OH-所含电子数为9NA |
您最近一年使用:0次
2023-11-26更新
|
372次组卷
|
3卷引用:山西省实验中学2023-2024学年高一上学期期中考试化学试题



