1 . 无水氯化铝常作为有机合成和石油化工的催化剂。工业上可由金属铝和纯净的氯气作用制备。某课外兴趣小组在实验室里,通过如图所示装置,制取少量纯净的无水氯化铝。据此回答下列问题:

查阅资料:常温下,无水氯化铝为白色晶体,易吸收水分,在178 ℃升华。装有无水氯化铝的试剂瓶久置潮湿空气中,会自动爆炸并产生大量白雾。
(1)写出A装置中,实验室制取Cl2的离子方程式 _______ ;
(2)仪器甲为_______ (写名称);装置B中加入的试剂是_______ ;装置C中加入的试剂是_______ ;
(3)为制得较纯净的氯化铝,实验开始时应先点燃酒精灯_______ (填“A”或“D”), F装置中碱石灰所起的作用是_______ ;
(4)若A装置中导出的气体若不经过B、C装置而直接进入D装置中,产生的后果是_______ 。

查阅资料:常温下,无水氯化铝为白色晶体,易吸收水分,在178 ℃升华。装有无水氯化铝的试剂瓶久置潮湿空气中,会自动爆炸并产生大量白雾。
(1)写出A装置中,实验室制取Cl2的
(2)仪器甲为
(3)为制得较纯净的氯化铝,实验开始时应先点燃酒精灯
(4)若A装置中导出的气体若不经过B、C装置而直接进入D装置中,产生的后果是
您最近一年使用:0次
2 . 高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
)是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 ,
,

(1)除了用二氧化锰和浓盐酸反应外,实验室可以用氯酸钾和浓盐酸反应制取氯气,反应方程式如下: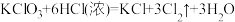 。
。
①浓盐酸在反应中显示出来的性质是___________ 性和___________ 性,用双线桥表示该反应中电子转移的情况___________ 。
②若产生标况下 ,则被氧化的HCl的物质的量为
,则被氧化的HCl的物质的量为___________ mol。
③如果要将装置B补充完整,除需用导管外,试剂瓶中还应装的除杂试剂为___________ 。
(2)C中得到紫色固体和溶液。C中 发生的反应有
发生的反应有 。另外还有
。另外还有___________ 。(用离子方程式表示)
(3)探究 的性质
的性质
取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:
方案一:取少量a,滴加KSCN溶液至过量,溶液呈血红色
方案二:用KOH溶液充分洗涤C中所得固体,除去固体表面附着的 ,防止其氧化
,防止其氧化 ,再用KOH溶液将
,再用KOH溶液将 溶出,得到紫色溶液b.取少量b,滴加盐酸,有
溶出,得到紫色溶液b.取少量b,滴加盐酸,有 产生。
产生。
①由方案一中溶液变红可知a中含有___________ (填离子符号),但该离子的产生不能判断一定是 将
将 氧化所得,还可能由
氧化所得,还可能由___________ 产生(文字描述)。
②根据 的制备实验得出:氧化性
的制备实验得出:氧化性
___________ FeO (填“>”或“<”),而方案二实验中
(填“>”或“<”),而方案二实验中 和FeO
和FeO 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是___________ 。
 )是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知:
)是一种高效多功能的新型非氯绿色消毒剂。实验小组欲制备高铁酸钾并探究其性质。已知: 为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生
为紫色固体,具有强氧化性;在碱性溶液中较稳定,微溶于KOH溶液;在酸性或中性溶液中快速产生 ,
,
(1)除了用二氧化锰和浓盐酸反应外,实验室可以用氯酸钾和浓盐酸反应制取氯气,反应方程式如下:
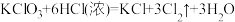 。
。①浓盐酸在反应中显示出来的性质是
②若产生标况下
 ,则被氧化的HCl的物质的量为
,则被氧化的HCl的物质的量为③如果要将装置B补充完整,除需用导管外,试剂瓶中还应装的除杂试剂为
(2)C中得到紫色固体和溶液。C中
 发生的反应有
发生的反应有 。另外还有
。另外还有(3)探究
 的性质
的性质取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有
 。为证明是否
。为证明是否 氧化了
氧化了 而产生
而产生 ,设计如下方案:
,设计如下方案:方案一:取少量a,滴加KSCN溶液至过量,溶液呈血红色
方案二:用KOH溶液充分洗涤C中所得固体,除去固体表面附着的
 ,防止其氧化
,防止其氧化 ,再用KOH溶液将
,再用KOH溶液将 溶出,得到紫色溶液b.取少量b,滴加盐酸,有
溶出,得到紫色溶液b.取少量b,滴加盐酸,有 产生。
产生。①由方案一中溶液变红可知a中含有
 将
将 氧化所得,还可能由
氧化所得,还可能由②根据
 的制备实验得出:氧化性
的制备实验得出:氧化性
 (填“>”或“<”),而方案二实验中
(填“>”或“<”),而方案二实验中 和FeO
和FeO 的氧化性强弱关系与之相反,原因是
的氧化性强弱关系与之相反,原因是
您最近一年使用:0次
2021-11-12更新
|
315次组卷
|
2卷引用:浙江省A9协作体2021-2022学年高一上学期期中考试化学试题
3 . 下列关于物质制备的说法正确的是
| A.可用石墨电解饱和食盐水的方法制取金属钠 |
B.工业上主要用 和 和 反应制取NaOH 反应制取NaOH |
C.实验室可用 和浓盐酸反应制备氯气 和浓盐酸反应制备氯气 |
| D.工业上用氯气与澄清石灰水反应制取漂白粉 |
您最近一年使用:0次
名校
解题方法
4 . 关于反应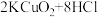 (浓)
(浓)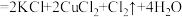 ,下列说法
,下列说法不正确 的是
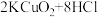 (浓)
(浓)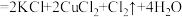 ,下列说法
,下列说法A.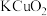 的氧化性强于 的氧化性强于 | B. 是氧化产物 是氧化产物 |
C.若生成 氯气,则转移 氯气,则转移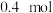 电子 电子 | D.氧化剂与还原剂的物质的量之比为 |
您最近一年使用:0次
2021-11-12更新
|
369次组卷
|
5卷引用:浙江省绍兴市2021-2022学年高三上学期11月选考科目诊断性考试化学试题
浙江省绍兴市2021-2022学年高三上学期11月选考科目诊断性考试化学试题(已下线)解密03 氧化还原反应(分层训练)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)化学-2022年高考押题预测卷02(浙江卷)浙江省精诚联盟2021-2022学年高二下学期5月联考化学试题西藏自治区拉萨中学2022届高三第五次月考理综化学试题
名校
5 . 某化学兴趣小组设计了如图装置,该装置能制取 ,并进行相关性质实验,且可利用装置A储存多余的氯气。
,并进行相关性质实验,且可利用装置A储存多余的氯气。

(1)A中发生反应的化学方程式为___________ 。
(2)储气瓶b可以收集氯气,则B内盛放的试剂是__ ;装置E中球形干燥管的作用是__ 。
(3)在装置D中能看到的实验现象是__ ;此现象可推断氧化性:
___  (填“>”或“<”)
(填“>”或“<”)
(4)装置C中 被
被 氧化为
氧化为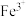 ,反应的离子方程式为
,反应的离子方程式为___________ 。
 ,并进行相关性质实验,且可利用装置A储存多余的氯气。
,并进行相关性质实验,且可利用装置A储存多余的氯气。
(1)A中发生反应的化学方程式为
(2)储气瓶b可以收集氯气,则B内盛放的试剂是
(3)在装置D中能看到的实验现象是

 (填“>”或“<”)
(填“>”或“<”)(4)装置C中
 被
被 氧化为
氧化为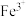 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
2021-11-11更新
|
105次组卷
|
2卷引用:浙江省杭州八校联盟2021-2022学年高一上学期期中联考化学试题
名校
解题方法
6 . 氯元素是生产生活中常见的非金属元素。回答下列问题
(1)二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸分解,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:

①仪器a的名称为___________ ,装置D中反应的化学方程式为___________ 。
②若该反应中加入足量的MnO2,则完全反应后,___________ (填“有”或“无”)HCl剩余。
③装置D中通入干燥空气的作用是___________ 。
④该实验装置的缺陷是___________ 。
(2)某同学查阅资料得知,最初,人们直接用氯气作漂白剂,但使用起来不方便,效果也不理想。经过多年的实验、改进,才有了今天常用的漂白粉。
①你认为“使用起来不方便,效果也不理想”的原因是___________ 。
②科研人员以氯气、石灰石、水为原料制取漂白粉,有关反应的化学方程式是:___________ 。
(1)二氧化氯(ClO2)是一种高效消毒剂,易溶于水,沸点为11.0℃,极易爆炸分解,若用空气、二氧化碳、氮气等惰性气体稀释时,爆炸性则降低。用干燥的氯气与固体亚氯酸钠制备二氧化氯,装置如图:

①仪器a的名称为
②若该反应中加入足量的MnO2,则完全反应后,
③装置D中通入干燥空气的作用是
④该实验装置的缺陷是
(2)某同学查阅资料得知,最初,人们直接用氯气作漂白剂,但使用起来不方便,效果也不理想。经过多年的实验、改进,才有了今天常用的漂白粉。
①你认为“使用起来不方便,效果也不理想”的原因是
②科研人员以氯气、石灰石、水为原料制取漂白粉,有关反应的化学方程式是:
您最近一年使用:0次
2021-11-08更新
|
472次组卷
|
4卷引用:2021年6月浙江高考化学试题变式题26-31
名校
解题方法
7 . 一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成 HClO, 遇有机物易燃烧或爆炸,42℃以上易分解。制备出的Cl2O要冷却成固体才便于操作和保存,制取少量的Cl2O是用干燥的氧化汞和氯气反应:2HgO+2Cl2 = Cl2O+HgCl2·HgO (反应放热)。某化学兴趣小组设计如图装置以制备 Cl2O(支撑、加热及夹持装置已省略)。
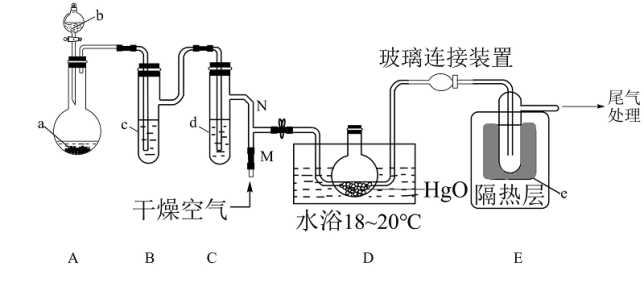
已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
请回答:
(1)仪器b的名称___________
(2)写出装置 A 中制备 Cl2的化学方程式___________ 。
(3)B中盛有的液体c应是___________ ,C中的液体d的作用___________
(4)E中的保温瓶中盛有液态制冷剂e是___________ (在“干冰”“冰水”“液态空气”“液氨”“液氯”中选择一种)
(5)据文献报道,Cl2O 的另一种制备方法是利用 Cl2与足量的 Na2CO3溶液 反应来制得,同时生成NaHCO3和NaCl两种盐,写出该反应的化学方程式___________ 。

已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
| Cl2O | N2 | O2 | CO2 | NH3 | Cl2 | |
| 熔点 | -120.6 ℃ | -209.86℃ | -218.4℃ | -78.5℃(升华) | -77.3℃ | -101℃ |
| 沸点 | 3.8℃ | -195.8℃ | -183℃ | -33.35℃ | -34.6℃ |
(1)仪器b的名称
(2)写出装置 A 中制备 Cl2的化学方程式
(3)B中盛有的液体c应是
(4)E中的保温瓶中盛有液态制冷剂e是
(5)据文献报道,Cl2O 的另一种制备方法是利用 Cl2与足量的 Na2CO3溶液 反应来制得,同时生成NaHCO3和NaCl两种盐,写出该反应的化学方程式
您最近一年使用:0次
2021-11-08更新
|
373次组卷
|
3卷引用:浙江省衢州高级中学2021-2022学年高一上学期期中考试化学试题
8 . 下列选项中除杂试剂(括号内)选用正确的是
| A.除去氢氧化钠溶液中的碳酸钠(氯化钙溶液) |
| B.去二氧化碳中的少量一氧化碳(氧气) |
| C.除去碳酸钠固体中的碳酸氢钠(加热) |
| D.除去氯气中的氯化氢(碱石灰) |
您最近一年使用:0次
解题方法
9 . 用8.70g MnO2与100mL 36.5%密度为1.20g/cm3的浓盐酸共热(假设HCl没有损失且MnO2被完全消耗),请回答(要求写出运算过程)
(1)求出浓盐酸的物质的量浓度_____
(2)反应中生成的Cl2在标准状况下的体积_____ 。
(1)求出浓盐酸的物质的量浓度
(2)反应中生成的Cl2在标准状况下的体积
您最近一年使用:0次
名校
10 . 下图为实验室制取Cl2的装置。
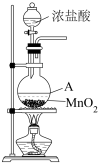
(1)盛放浓盐酸的仪器名称是___________ ,A中反应的离子方程式为___________ ,浓盐酸在反应中显示出___________ 。
a. 氧化性 b. 还原性 c. 酸性
其中,被氧化的HCl与参加反应的HCl两者的物质的量之比为___________ 。
(2)除去Cl2中的HCl,需通过盛有___________ 溶液的洗气瓶。
(3)用NaOH溶液吸收尾气,反应的离子方程式为___________ 。

(1)盛放浓盐酸的仪器名称是
a. 氧化性 b. 还原性 c. 酸性
其中,被氧化的HCl与参加反应的HCl两者的物质的量之比为
(2)除去Cl2中的HCl,需通过盛有
(3)用NaOH溶液吸收尾气,反应的离子方程式为
您最近一年使用:0次
2021-11-05更新
|
245次组卷
|
2卷引用:浙江省金华市曙光学校2021-2022学年高一上学期期中考试化学试题



