名校
解题方法
1 . 已知:CH3OH(g)+ O2(g)=CO2(g)+2H2O(g)△H=akJ·mol﹣1、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=bkJ·mol﹣1,则下列叙述正确的是
O2(g)=CO2(g)+2H2O(g)△H=akJ·mol﹣1、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=bkJ·mol﹣1,则下列叙述正确的是
 O2(g)=CO2(g)+2H2O(g)△H=akJ·mol﹣1、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=bkJ·mol﹣1,则下列叙述正确的是
O2(g)=CO2(g)+2H2O(g)△H=akJ·mol﹣1、CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=bkJ·mol﹣1,则下列叙述正确的是| A.C﹣H键键长小于H﹣H键 |
| B.CH4(g)+2O2=CO2(g)+2H2O(g)△H=bkJ·mol﹣1表示甲烷燃烧热的热化学方程式 |
| C.2CH3OH(g)=2CH4(g)+O2(g)△H=2(a﹣b)kJ·mol﹣1 |
D.当CH3OH(g)和CH4(g)物质的量之比为1:2时,其完全燃烧生成CO2和H2O(g)时,放出的热量为ckJ,则该混合物中CH3OH(g)的物质的量为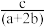 mol mol |
您最近一年使用:0次
2 . 物质的摩尔燃烧焓是指在一定温度和压强条件下,1mol物质完全氧化为同温下的指定产物时的焓变,其中物质中所含的N元素氧化为N2(g)、H元素氧化为H2O(l)、C元素氧化为CO2(g)。
已知:①几种物质的摩尔燃烧焓:
②298k,101kPa时,部分化学键键能:
③H2O(l)=H2O(g) △H=+44.0kJ/mol
回答下列问题:
(1)计算反应2CO(g)+O2(g)=2CO2(g)的焓变△H1=___________ kJ·mol-1,由此可求CO的化学键C O键能a=
O键能a=___________ kJ·mol-1。
(2)已知相同条件下,石墨比金刚石稳定,则1mol金刚石的燃烧放热___________ 393.5kJ(填“>”、“<”、“=”)。
(3)写出常温下氢气燃烧的热化学方程式___________ ,则反应CO(g)+H2O(g)=CO2(g)+H2(g)的焓变△H2=___________ kJ·mol-1。
已知:①几种物质的摩尔燃烧焓:
| 物质 | 石墨(s) | H2(g) | CO(g) |
| △H/(kJ·mol—1) | -393.5 | -285.8 | -283.0 |
②298k,101kPa时,部分化学键键能:
| 化学键 | C O O | O=O | C=O | C-O |
| E/(kJ·mol-1) | a | 498 | 745 | 351 |
③H2O(l)=H2O(g) △H=+44.0kJ/mol
回答下列问题:
(1)计算反应2CO(g)+O2(g)=2CO2(g)的焓变△H1=
 O键能a=
O键能a=(2)已知相同条件下,石墨比金刚石稳定,则1mol金刚石的燃烧放热
(3)写出常温下氢气燃烧的热化学方程式
您最近一年使用:0次
名校
解题方法
3 . 工业合成氨的反应N2+3H2⇌2NH3的能量变化如图所示,请回答有关问题:
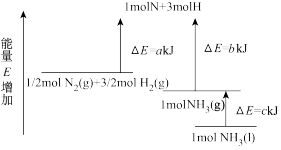
(1)合成1molNH3(l)____ (填“吸收”或“放出”)____ kJ的热量。
(2)推测反应2NH3(l)⇌2N2(g)+3H2(g)比反应2NH3(g)⇌2N2(g)+3H2(g)___ (填“吸收”或“放出”)的热量___ (填“多”或“少”)。
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是__ (填“黑磷”或“红磷”)。
(4)某实验小组同学对电化学原理进行了一系列探究活动。
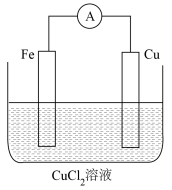
该电池基于总反应____ (用离子方程式表示)来设计的,一段时间后,铜极质量变化32g,则导线中通过____ mol电子。

(1)合成1molNH3(l)
(2)推测反应2NH3(l)⇌2N2(g)+3H2(g)比反应2NH3(g)⇌2N2(g)+3H2(g)
(3)已知:P(s,白磷)=P(s,黑磷),每1molP(s,白磷)发生反应,放出39.3kJ的热量,P(s,白磷)=P(s,红磷),每1molP(s,白磷)发生反应,放出17.6kJ的热量,由此推知,其中最稳定的磷单质是
(4)某实验小组同学对电化学原理进行了一系列探究活动。

该电池基于总反应
您最近一年使用:0次
名校
解题方法
4 .  催化加氢制备
催化加氢制备 是
是 资源化利用的重要途径。已知下图所示的反应的能量变化。
资源化利用的重要途径。已知下图所示的反应的能量变化。

下列说法不正确 的是
 催化加氢制备
催化加氢制备 是
是 资源化利用的重要途径。已知下图所示的反应的能量变化。
资源化利用的重要途径。已知下图所示的反应的能量变化。
下列说法
| A.由图1推知反应物断键吸收的能量小于生成物成键释放的能量 |
B.图2中,若生成的 为液态,则能量变化曲线为① 为液态,则能量变化曲线为① |
C. |
D.制备 的反应使用催化剂时,其 的反应使用催化剂时,其 不变 不变 |
您最近一年使用:0次
2021-05-10更新
|
806次组卷
|
8卷引用:北京一零一中学2020-2021学年高一下学期期末考试化学试题
北京一零一中学2020-2021学年高一下学期期末考试化学试题北京市海淀区2021届高三二模化学试题(已下线)2021年高考化学押题预测卷(北京卷)(02)湖南省五市十校教研教改共同体2021-2022学年高一下学期期末考试化学试题河南省中原名校2022-2023学年高二上学期第一次联考化学试题(已下线)题型14 从吸热与放热角度突破反应热图像北京交通大学附属中学2023-2024学年高三上学期12月月考化学试题 北京市第十二中学2023-2024学年高二上学期期中考试化学试题
5 . 能源是现代文明的原动力,通过化学方法可以使能源按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。回答下列问题:
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,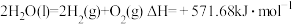 ,
,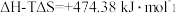 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是_______ 。
(2)已知反应: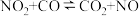
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为_______ (用含K的式子表示)。
②下图是该反应中能量变化示意图。
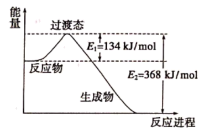
则 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为_______ , 和
和 反应的热化学方程式为
反应的热化学方程式为_______ 。
(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①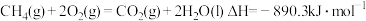
②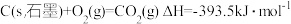
③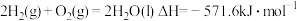
则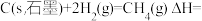
_______ 。
(4)已知一些化学键的键能数据如表所示:
请根据键能数据写出 和
和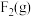 反应生成
反应生成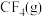 和
和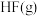 的热化学方程式:
的热化学方程式:_______ 。
(1)氢能作为一种清洁高效的二次能源,在未来能源格局中发挥着重要作用。已知:常温下,
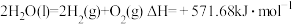 ,
,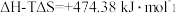 。则常温下水的分解不能自发进行的热力学依据是
。则常温下水的分解不能自发进行的热力学依据是(2)已知反应:
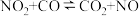
①在某温度下该反应的平衡常数为K,则其逆反应的平衡常数为
②下图是该反应中能量变化示意图。

则
 和
和 反应生成
反应生成 和
和 的活化能为
的活化能为 和
和 反应的热化学方程式为
反应的热化学方程式为(3)燃料燃烧将其所含的化学能转变为我们所需要的热能。已知:
①
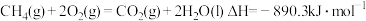
②
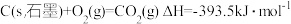
③
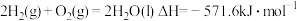
则
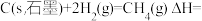
(4)已知一些化学键的键能数据如表所示:
| 化学键 |  |  |  |  |
键能/ | 414 | 489 | 565 | 155 |
请根据键能数据写出
 和
和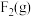 反应生成
反应生成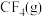 和
和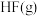 的热化学方程式:
的热化学方程式:
您最近一年使用:0次
名校
解题方法
6 . 工业合成氨的反应N2+3H2=2NH3的能量变化如图所示,请回答有关问题:
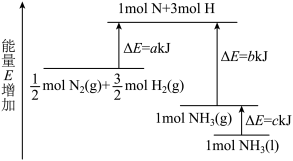
(1)合成1molNH3(l)___________ (填“吸收”或“放出”)___________ kJ的热量。(用字母表示)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为___________ kJ。
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)___________ (填“吸收”或“放出”)的热量___________ (填“多”或“少”)。

(1)合成1molNH3(l)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)
您最近一年使用:0次
2021-05-03更新
|
300次组卷
|
8卷引用:江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题
江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题江西省赣州市南康区第三中学2020-2021学年高一下学期期中考试化学试题黑龙江省齐齐哈尔市第八中学校2020-2021学年高一下学期期中考试化学试题山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题云南省昌宁县第一中学2021-2022学年高一 3月月考化学试题陕西省渭南市华州区咸林中学2022-2023学年高一下学期期中考试化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)
7 . 按要求填空:
(1)相对分子质量为72的烷烃的分子式为___________ ,结构有___________ 种,分别写出它们的结构简式___________ 。
(2)下列物质熔沸点由高到低的顺序是:①CH4;②C3H8;③CH3CH(CH3)2 ;④CH3CH2CH2CH3;___________ (填序号)
(3)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出表示甲烷燃烧热的热化学方程式___________ 。
(4)已知:①Fe(s)+ O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
②2Al(s)+ O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
Al和FeO发生反应的热化学方程式是___________ 。
(1)相对分子质量为72的烷烃的分子式为
(2)下列物质熔沸点由高到低的顺序是:①CH4;②C3H8;③CH3CH(CH3)2 ;④CH3CH2CH2CH3;
(3)4 g甲烷在氧气中燃烧生成CO2和液态水,放出222.5 kJ热量,写出表示甲烷燃烧热的热化学方程式
(4)已知:①Fe(s)+
 O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1
O2(g)=FeO(s) ΔH1=—272.0 kJ·mol-1②2Al(s)+
 O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1
O2(g)=Al2O3(s) ΔH2=—1675.7 kJ·mol-1Al和FeO发生反应的热化学方程式是
您最近一年使用:0次
名校
8 . 证据推理与模型认知是化学学科的核心素养之一。下列事实与相应定律或原理相符的
| A.常温常压下,1体积乙醇完全燃烧消耗3体积O2——阿伏加德罗定律 |
| B.向漂白液中加入少量稀硫酸能增强漂白液的漂白效果——元素周期律 |
| C.通过测量C、CO的燃烧热来间接计算2C(s)+O2(g)=2CO(g)的反应热——盖斯定律 |
| D.体积可变的密闭容器中加入等体积的H2和I2(g)发生反应,加压体系颜色加深——勒夏特列原理 |
您最近一年使用:0次
2021-04-29更新
|
360次组卷
|
3卷引用:衔接点20 物质的量在化学实验中的应用-2021年初升高化学无忧衔接
(已下线)衔接点20 物质的量在化学实验中的应用-2021年初升高化学无忧衔接广东省汕头市第一中学2020-2021学年高二上学期期末考试化学试题广东省信宜市第二中学2022-2023学年高二上学期11月月考化学试题
名校
解题方法
9 . Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) ∆H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) ∆H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) ∆H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) ∆H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是___________ (填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为___________ 。
(3)CO(g)的燃烧热的热化学方程式为___________
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1③
(4)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=___________ 。
(5)已知:①Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g) ΔH1=+19.3kJ·mol-1
②3FeO(s)+H2O(g)⇌Fe3O4(s)+H2(g) ΔH2=-57.2kJ·mol-1
③C(s)+CO2(g)⇌2CO(g) ΔH3=+172.4kJ·mol-1
碳与水制氢气总反应的热化学方程式是___________ 。
(6)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其热化学方程式为___________ 。
(7)SF6是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F—F键能为160kJ·mol-1,S—F键能为330kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式___________ 。
①2H2(g)+O2(g)=2H2O(l) ∆H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) ∆H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) ∆H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) ∆H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是
(2)燃烧10gH2生成液态水,放出的热量为
(3)CO(g)的燃烧热的热化学方程式为
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1③
(4)反应器中的总反应可表示为3CO(g)+3H2(g)⇌CH3OCH3(g)+CO2(g),计算该反应的ΔH=
(5)已知:①Fe3O4(s)+CO(g)⇌3FeO(s)+CO2(g) ΔH1=+19.3kJ·mol-1
②3FeO(s)+H2O(g)⇌Fe3O4(s)+H2(g) ΔH2=-57.2kJ·mol-1
③C(s)+CO2(g)⇌2CO(g) ΔH3=+172.4kJ·mol-1
碳与水制氢气总反应的热化学方程式是
(6)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650kJ的热量。其热化学方程式为
(7)SF6是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1molS(s)转化为气态硫原子吸收能量280kJ,F—F键能为160kJ·mol-1,S—F键能为330kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式
您最近一年使用:0次
10 . 化学反应往往伴随着能量的变化,请完成以下问题
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1 ,N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1;则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=_______ 。
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) =CH3OH(g),反应过程中的能量变化情况如图所示。
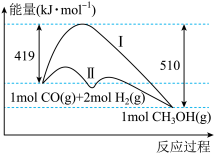
(1)曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是_______ (填“吸热”或“放热”)反应。计算当反应生成1.5molCH3OH(g)时,能量变化值是_______ kJ。
(2)选择适宜的催化剂_______ (填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g) =CO(g)+2H2(g)是_______ (填“吸热”或“放热”)反应。
III.断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需_______ (填“吸收”或“放出”)能量_______ kJ。(小数点后保留两位数字),事实上,反应的热量总小于理论值,理由是_______ 。
Ⅰ.已知:2H2(g)+O2(g)=2H2O(g) ΔΗ=-483.6kJ·mol-1 ,N2(g)+2O2(g)=2NO2(g) ΔΗ=+67.7kJ·mol-1;则反应4H2(g)+2NO2(g)=N2(g)+4H2O(g)的反应热ΔΗ=
II.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) =CH3OH(g),反应过程中的能量变化情况如图所示。

(1)曲线I和曲线II分别表示不使用催化剂和使用催化剂的两种情况。该反应是
(2)选择适宜的催化剂
(3)推测反应CH3OH(g) =CO(g)+2H2(g)是
III.断开1molH—H键、1molN—H键、1molN≡N键分别需要吸收能量为436kJ、391kJ、946kJ,则1molH2与足量N2反应生成NH3需
您最近一年使用:0次



