1 . 雾霾已经成为部分城市发展的障碍。雾霾形成的最主要原因是人为排放,其中汽车尾气污染对雾霾的“贡献”逐年增加。回答下列问题:
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量___________ (填“高”或“低”)。
②N2(g)+O2(g)=2NO(g)的∆H=___________ kJ∙mol-1。
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)⇌2CO2(g)+N2(g)∆H=akJ∙mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值___________ (选填“增大”“减小”或“不变”)。
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:
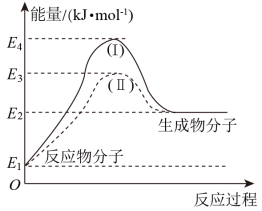
①通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1___________ (选填“>”“=”或“<”)0
②图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能___________ (选填“>”“=”或“<”)途径(Ⅰ)的活化能。
③已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+ O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3
则∆H2=___________ (用∆H1和∆H3的代数式表达)
(1)汽车尾气中含有NO,N2与O2生成NO的过程如下:

①1molO2与1molN2的总能量比2molNO的总能量
②N2(g)+O2(g)=2NO(g)的∆H=
③NO与CO反应的热化学方程式可以表示为2NO(g)+2CO(g)⇌2CO2(g)+N2(g)∆H=akJ∙mol-1,但该反应速率很慢,若使用机动车尾气催化转化器,可以使尾气中的NO与CO转化成无害物质排出。上述反应在使用“催化转化器”后,a值
(2)氢能源是绿色燃料,可以减少汽车尾气的排放,利用甲醇与水蒸气反应可以制备氢气:CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ∆H1,如图是该反应的能量变化图:

①通过图中信息可判断反应CH3OH(g)+H2O(g)=CO2(g)+3H2(g)的∆H1
②图中途径(Ⅱ)使用了催化剂。则途径(Ⅱ)的活化能
③已知下列两个热化学方程式:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g) ∆H2
H2(g)+
 O2(g)=H2O(g) ∆H3
O2(g)=H2O(g) ∆H3则∆H2=
您最近一年使用:0次
2021-04-02更新
|
228次组卷
|
3卷引用:四川省阆中中学校2020-2021学年高一(仁智班)下学期第一次月考化学试题
四川省阆中中学校2020-2021学年高一(仁智班)下学期第一次月考化学试题湖南省娄底市新化县2021-2022学年高二上学期期末考试化学试题(已下线)专题03 化学反应速率及影响因素、活化能【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)
名校
解题方法
2 . 下图为元素周期表的一部分,根据元素①~⑧在表中的位置回答下列问题。
(1)元素⑧的最高价氧化物对应水化物的分子式为___________ ;
(2)元素①与④形成的18电子的化合物的结构式为___________ ;
(3)用电子式表示元素⑤与⑧形成化合物的过程___________ ;
(4)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2.该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是___________ (元素X请用具体元素符号表示)。
(5)元素①与③形成的简单化合物是___________ 分子(填极性或非极性)
(6)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量___________ (填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
族 周期 | Ⅰ | 0 | ||||||
| 1 | ① | Ⅱ | Ⅲ | Ⅳ | Ⅴ | Ⅵ | Ⅶ | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |
(2)元素①与④形成的18电子的化合物的结构式为
(3)用电子式表示元素⑤与⑧形成化合物的过程
(4)假设元素⑧的对应元素符号为X,若在一定条件下,X单质能够与硫反应生成一种用途广泛的硫化剂S2X2.该硫化剂S2X2与足量水反应有淡黄色沉淀生成,同时生成能够使品红溶液褪色的无色气体,则该反应的化学方程式是
(5)元素①与③形成的简单化合物是
(6)丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)ΔH=-akJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g)ΔH=+bkJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l)ΔH=-ckJ/mol
2H2(g)+O2(g)=2H2O(l)ΔH=-dkJ/mol(a、b、c、d均为正值)
判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量
您最近一年使用:0次
名校
解题方法
3 . 已知以下的热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-24.8kJ·mol-1
②Fe2O3(s)+ CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g)ΔH=-15.73kJ·mol-1
CO2(g)ΔH=-15.73kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)ΔH=+640.4kJ·mol-1
则28gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)ΔH=-24.8kJ·mol-1
②Fe2O3(s)+
 CO(g)=
CO(g)= Fe3O4(s)+
Fe3O4(s)+ CO2(g)ΔH=-15.73kJ·mol-1
CO2(g)ΔH=-15.73kJ·mol-1③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g)ΔH=+640.4kJ·mol-1
则28gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为
| A.+218kJ·mol-1 | B.-109kJ·mol-1 | C.-218kJ·mol-1 | D.+109kJ·mol-1 |
您最近一年使用:0次
2021-04-02更新
|
187次组卷
|
2卷引用:四川省阆中中学校2020-2021学年高一(仁智班)下学期第一次月考化学试题
名校
4 . 参照反应Br+H2⇌HBr+H的能量对反应历程的示意图,下列叙述中正确的是


| A.正反应为吸热反应 |
| B.加入催化剂,该化学反应的放热量变多 |
| C.反应物总能量高于生成物总能量 |
| D.升高温度可增大正反应速率,降低逆反应速率 |
您最近一年使用:0次
2021-03-18更新
|
161次组卷
|
2卷引用:辽宁省锦州市义县高级中学2020-2021学年高一下学期3月考试化学试题
名校
解题方法
5 . 已知完全分解1molH2O2放出热量为98kJ,在含有少量I-的溶液中H2O2分解的机理为
反应Ⅰ:H2O2(aq)+I-(aq) IO-(aq)+H2O(l) △H1
IO-(aq)+H2O(l) △H1
反应Ⅱ:H2O2(aq)+IO-(aq) O2(g)+I-(aq)+H2O(l) △H2
O2(g)+I-(aq)+H2O(l) △H2
在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是
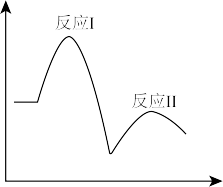
反应Ⅰ:H2O2(aq)+I-(aq)
 IO-(aq)+H2O(l) △H1
IO-(aq)+H2O(l) △H1反应Ⅱ:H2O2(aq)+IO-(aq)
 O2(g)+I-(aq)+H2O(l) △H2
O2(g)+I-(aq)+H2O(l) △H2在一定温度下,其反应过程能量变化如图所示,下列有关该反应的说法不正确的是

| A.反应Ⅱ高温下能自发进行 |
| B.H2O2分解产生氧气的速率是由反应I决定的 |
| C.I-、IO-都是催化剂 |
| D.△H1+△H2=-196kJ•mol-1 |
您最近一年使用:0次
2021-03-16更新
|
940次组卷
|
12卷引用:辽宁省沈阳市郊联体2020-2021学期高一下学期期中考试化学试题
辽宁省沈阳市郊联体2020-2021学期高一下学期期中考试化学试题浙江省2021届高三下学期3月联考化学试题(已下线)浙江省“超级全能生”2021年3月高考选考科目联考化学试题(已下线)押山东卷第14题 化学反应速率和平衡-备战2021年高考化学临考题号押题(山东卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)广东省广州中学2021-2022学年高二上学期期中考试化学试题广东省揭阳市榕城区仙桥中学2021-2022学年高二下学期期中考试化学试题云南省昆明市第一中学2021-2022学年高二下学期期中考试化学试题浙江省温州新力量联盟2022-2023学年高二 上学期期中联考化学试题广东省广州市东涌中学2022-2023学年高二上学期期中考试化学试题广东省深圳市富源学校2023-2024学年高二上学期11月期中化学试题
6 . 反应2H2(g)+O2(g)=2H2O(1) ΔH=-571.6 kJ·mol-1 过程中的能量变化关系如图。下列说法错误的是

| A.ΔH1>△H2 |
| B.ΔH1+ΔH2+ΔH3=ΔH4=-571.6kJ·mol-1 |
C.2mol水蒸气转化为液态水能够释放出的能量为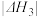 kJ kJ |
| D.若将上述反应设计成原电池,则当氢失4mol电子时能够产生571.6kJ的电能 |
您最近一年使用:0次
2021-03-14更新
|
496次组卷
|
6卷引用:辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题
辽宁省大连市一0三中学2020-2021学年高一4月月考化学试题福建省福州市2021届高考3月毕业班质量检测(一模)化学试题(已下线)押山东卷第07题 化学反应与能量-备战2021年高考化学临考题号押题(山东卷)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)云南省大理州实验中学2021-2022学年高二上学期化学期末考试题
名校
解题方法
7 . 硫酰氯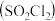 是一种重要的磺化试剂,其可利用
是一种重要的磺化试剂,其可利用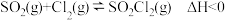 制备。
制备。 时,该反应的压强平衡常数
时,该反应的压强平衡常数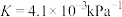 ,在恒温恒容的容器中发生反应,下列说法正确的是
,在恒温恒容的容器中发生反应,下列说法正确的是
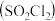 是一种重要的磺化试剂,其可利用
是一种重要的磺化试剂,其可利用 制备。
制备。 时,该反应的压强平衡常数
时,该反应的压强平衡常数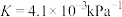 ,在恒温恒容的容器中发生反应,下列说法正确的是
,在恒温恒容的容器中发生反应,下列说法正确的是A.已知硫酰氯结构式为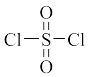 ,硫酰氯每个原子均达到8电子稳定结构 ,硫酰氯每个原子均达到8电子稳定结构 |
| B.容器内气体的平均摩尔质量不变时,反应达到平衡 |
| C.温度升高,平衡逆向移动,反应的压强平衡常数增大 |
| D.上述制备硫酰氯的反应,在高温下自发 |
您最近一年使用:0次
2021-03-10更新
|
531次组卷
|
7卷引用:甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题
甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题河北省“五个一名校联盟”(张家口一中、唐山一中、保定一中、邯郸一中、邢台一中)2021届高三第二次模拟考试化学试题河南省鹤壁市高中2020-2021学年高二下学期第三次段考化学试题(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点18 化学平衡状态 化学平衡移动-备战2022年高考化学一轮复习考点帮(浙江专用)河北省石家庄市第二中学2021-2022学年高三上学期10月第二次考试化学试题(已下线)专题10 化学反应速率与平衡-2023年高考化学一轮复习小题多维练(全国通用)
20-21高一下·全国·课时练习
名校
解题方法
8 . 氢能是最具前景的清洁能源之一,目前水分解制氢技术及贮氢材料的开发应用都取得了很大进展。已知:2H2(g)+ O2(g)=2H2O(1)∆H=-571.6kJ·mol-1。下列说法错误的是
| A.1mol H2O(l)分解制得1molH2需要吸收571.6kJ的能量 |
| B.氢气作为新能源具有热值高、无污染、资源丰富、可再生等优点 |
| C.贮氢材料具有能大量、快速和高效率地吸收和释放氢气的特点 |
| D.利用太阳能光催化分解水制氢是一种理想的制氢手段 |
您最近一年使用:0次
2021-03-09更新
|
273次组卷
|
3卷引用:6.2.2 燃料燃烧释放的能量 氢燃料的应用前景(练习)-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)
(已下线)6.2.2 燃料燃烧释放的能量 氢燃料的应用前景(练习)-2020-2021学年下学期高一化学同步精品课堂(苏教版2019必修第二册)江苏省沭阳县修远中学2020-2021学年高一下学期第一次月考化学试题江苏省淮安市涟水县第一中学2021-2022学年高一下学期第一次阶段检测化学试题
9 . H2与ICl的反应分①、②两步进行,其能量曲线如图所示,下列有关说法错误的是
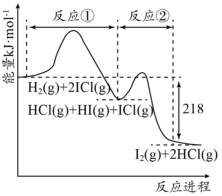

| A.反应①、反应②均为放热反应 |
| B.反应①、反应②均为氧化还原反应 |
| C.H2与ICl的总反应速率快慢取决于反应② |
| D.反应H2(g)+2ICl(g)=I2(g)+2HCl(g)的ΔH=-218kJ·mol-1 |
您最近一年使用:0次
2021-01-29更新
|
787次组卷
|
3卷引用:山东省日照市莒县2020-2021学年高一下学期期中考试化学试题
名校
10 . Na2CO3(aq)与盐酸反应过程中的能量变化示意图如图,下列选项正确的是
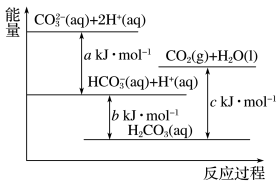

| A.H2CO3(aq)=CO2(g)+H2O(l)为放热反应 |
B.CO (aq)+H+(aq)=HCO (aq)+H+(aq)=HCO (aq)∆H=a kJ·mol-1 (aq)∆H=a kJ·mol-1 |
C.HCO (aq)+H+(aq)=CO2(g)+H2O (l)∆H=(c-b) kJ·mol-1 (aq)+H+(aq)=CO2(g)+H2O (l)∆H=(c-b) kJ·mol-1 |
D.CO (aq)+2H+(aq)=CO2(g)+H2O(l)∆H=(a+b-c) kJ·mol-1 (aq)+2H+(aq)=CO2(g)+H2O(l)∆H=(a+b-c) kJ·mol-1 |
您最近一年使用:0次
2020-12-22更新
|
517次组卷
|
12卷引用:天津市南开中学2020-2021学年高一下学期期中考试化学试题
天津市南开中学2020-2021学年高一下学期期中考试化学试题河北省衡水中学2016-2017学年高一下学期期中考试化学试题河北省深州中学2017-2018高一下学期期中考试化学试题2017届浙江省宁波市高三新高考选考适应性考试化学试卷(已下线)2018年10月15日 《每日一题》人教选修4-热化学方程式的书写与正误判断【全国百强校】陕西省西安市长安区第一中学2018-2019学年高二(实验班)上学期期中考试化学试题安徽省滁州市明光县明光中学2020-2021学年高二上学期第一次月考化学试题河北省实验中学2021届高三上学期期中考试化学试题(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)第一章 本章复习提升2山西大学附属中学校2022-2023学年高二上学期11月期中考试化学试题陕西省武功县普集高级中学2023-2024学年高二上学期10月月考化学试题



