名校
解题方法
1 . 已知:①Zn(s)+ O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+ O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
 O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+
O2(g)=ZnO(s) ΔH=-348.3kJ·mol-1;②2Ag(s)+ O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )
O2(g)=Ag2O(s) ΔH=-31.0kJ·mol-1则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为( )| A.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=+317.3kJ·mol-1 |
| B.Zn+Ag2O=ZnO+2Ag ΔH=+317.3kJ·mol-1 |
| C.Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s) ΔH=-379.3kJ·mol-1 |
| D.2Zn(s)+2Ag2O(s)=2ZnO(s)+4Ag(s) ΔH=-634.6 kJ·mol-1 |
您最近一年使用:0次
2019-12-18更新
|
135次组卷
|
3卷引用:河北省衡水市第十四中学2020-2021学年高一下学期期末考试化学试题
名校
2 . NH3催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如左图;研究发现在以Fe2O3为主的催化剂上可能发生的反应过程如右图 下列说法正确的是
下列说法正确的是
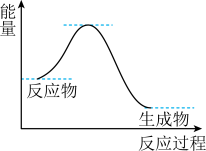
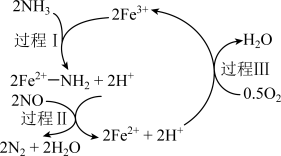
 下列说法正确的是
下列说法正确的是

| A.NH3催化还原NO为吸热反应 |
| B.过程Ⅰ中NH3断裂离子键 |
| C.过程Ⅱ中NO为氧化剂,Fe2+为还原剂 |
D.脱硝的总反应为:4NH3(g)+4NO(g)+O2(g)  4N2(g)+6H2O(g) 4N2(g)+6H2O(g) |
您最近一年使用:0次
2019-11-04更新
|
313次组卷
|
2卷引用:广东省深圳市宝安中学高中部2020-2021学年高一下学期期中考试化学试卷
名校
3 . 在36 g 碳不完全燃烧所得气体中,CO占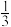 体积,CO2占
体积,CO2占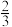 体积,且
体积,且
C(s) + O2(g) = CO(g) △H =-110.5 kJ/mol
O2(g) = CO(g) △H =-110.5 kJ/mol
CO(g) + O2(g) = CO2(g) △H =-283 kJ/mol
O2(g) = CO2(g) △H =-283 kJ/mol
与这些碳完全燃烧相比,损失的热量是( )
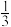 体积,CO2占
体积,CO2占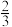 体积,且
体积,且C(s) +
 O2(g) = CO(g) △H =-110.5 kJ/mol
O2(g) = CO(g) △H =-110.5 kJ/molCO(g) +
 O2(g) = CO2(g) △H =-283 kJ/mol
O2(g) = CO2(g) △H =-283 kJ/mol与这些碳完全燃烧相比,损失的热量是( )
| A.172.5 kJ | B.566kJ | C.1149kJ | D.283kJ |
您最近一年使用:0次
2019-10-16更新
|
143次组卷
|
7卷引用:江西省抚州市黎川县第一中学2020-2021学年高一下学期期末质量检测化学试题
江西省抚州市黎川县第一中学2020-2021学年高一下学期期末质量检测化学试题湖南省永州市东安县第一中学2019-2020学年高二上学期第一次月考化学试题甘肃省张掖市临泽县第一中学2019-2020学年高二上学期9月月考化学试题湖南省长沙市第一中学2020-2021学年高二上学期入学考试化学试题云南省玉溪第三中学2021-2022学年高二下学期3月入学考试化学试题(已下线)1.2.1 反应热的测量和热化学方程式-【帮课堂】2022-2023学年高二化学同步精品讲义(沪科版2020选择性必修第一册)云南省玉溪市易门县一中2021-2022学年高二下学期3月月考化学试题
名校
4 . 乙醇的燃烧热为ΔH1,甲醇的燃烧热为ΔH2,且ΔH1<ΔH2,若乙醇和甲醇的混合物1 mol完全燃烧,反应热为ΔH3,则乙醇和甲醇的物质的量之比为
A.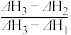 | B.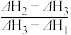 | C.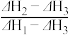 | D. |
您最近一年使用:0次
2019-09-27更新
|
583次组卷
|
8卷引用:陕西省西安市铁一中 学2021-2022学年高一下学期期中考试化学试题
2019高三·全国·专题练习
名校
5 . 环戊二烯(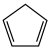 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
(1)已知: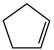 (g) =
(g) =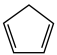 (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应: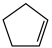 (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ ΔH3=
(g)+2HI(g) ③ ΔH3=___________ kJ·mol −1。
(2)某温度下,等物质的量的碘和环戊烯(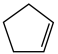 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为_________ ,该反应的平衡常数Kp=_________ Pa。达到平衡后,欲增加环戊烯的平衡转化率,可采取的措施有__________ (填标号)。
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是__________ (填标号)。
A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L−1
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:(1)已知:
 (g) =
(g) = (g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应:
(g)+H2(g) ΔH1=100.3 kJ·mol −1①H2(g)+ I2(g) =2HI(g) ΔH2=−11.0 kJ·mol −1②,对于反应: (g)+ I2(g) =
(g)+ I2(g) = (g)+2HI(g) ③ ΔH3=
(g)+2HI(g) ③ ΔH3=(2)某温度下,等物质的量的碘和环戊烯(
 )在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为
)在刚性容器内发生反应③,起始总压为105Pa,平衡时总压增加了20%,环戊烯的转化率为A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度
(3)环戊二烯容易发生聚合生成二聚体,该反应为可逆反应。不同温度下,溶液中环戊二烯浓度与反应时间的关系如图所示,下列说法正确的是

A.T1>T2
B.a点的反应速率小于c点的反应速率
C.a点的正反应速率大于b点的逆反应速率
D.b点时二聚体的浓度为0.45 mol·L−1
您最近一年使用:0次
2019-06-26更新
|
2675次组卷
|
20卷引用:江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题
江西省崇义中学2020-2021学年高一上学期期中考试(A卷)化学试题四川省遂宁市2020-2021学年高二下学期期末考试化学试题选择性必修1(SJ)专题2专题培优专练(已下线)第19讲 化学平衡(讲) — 2022年高考化学一轮复习讲练测(新教材新高考)山东省临沂市平邑县第一中学实验部2021-2022学年高二上学期第二次月考化学试题(已下线)专题09 反应速率、化学平衡——2019年高考真题和模拟题化学分项汇编(已下线)专题7.2 化学平衡状态 化学平衡移动(练)-《2020年高考一轮复习讲练测》(已下线)专题7.2 化学平衡状态 化学平衡移动(讲)-《2020年高考一轮复习讲练测》江西省高安中学2019-2020学年高二上学期期末考试化学(B卷)试题鲁科版(2019)选择性必修1第2章 化学反应的方向、限度与速率 第2章 综合检测高中必刷题高二选择性必修1第二章 化学反应速率与化学平衡 第二章素养检测(已下线)2.3.3+化学平衡常数-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)人教版(2019)高二化学选择性必修1第二章 化学反应速率与化学平衡 过高考 3年真题强化闯关(已下线)第23讲 化学平衡状态 化学平衡的移动 (精讲)——2021年高考化学一轮复习讲练测鲁科版(2019)高二选择性必修第一册第2章 化学反应的方向、限度与速率 高考挑战区 过高考内蒙古赤峰市2021-2022学年高二下学期期末考试化学试题(已下线)第19讲 化学平衡(讲)-2023年高考化学一轮复习讲练测(新教材新高考)河南省洛阳市第一中学2022-2023学年高二上学期期末检测化学试题福建省泉州市南安市侨光中学2022-2023学年高二上学期10月月考化学试题湖南省邵阳市新邵县2023-2024学年高二上学期期末考试化学试题
名校
6 . 键能的大小可用于计算化学反应的反应热(△H)。
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g) = 2HCl(g)过程中,当生成1molHCl气体时需要___ (填“吸收”或“放出” )____ kJ能量。
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是___ kJ·mol-1。
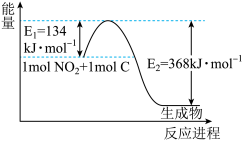
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:____ 。
(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=_______ (用含ΔH1、ΔH2、ΔH3的式子表示)。
| 化学键 | Cl-Cl | H—H | H—Cl | N≡N |
| 键能/kJ·mol-1 | 243 | 436 | 431 | 946 |
(1)利用上表中的数据判断发生反应H2(g) + Cl2(g) = 2HCl(g)过程中,当生成1molHCl气体时需要
(2)已知N2 (g)+3H2(g) = 2NH3(g) ΔH=-92 kJ/mol,则N—H键的键能是
(3)1molNO2气体和1mol CO气体反应生成CO2气体和NO气体过程中能量变化如下图,请写出NO2和CO反应的热化学方程式:

(4)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1
②2CO(g)+O2(g)=2CO2(g) ΔH2
③H2O(g)=H2O(l) ΔH3
则CH3OH(l)+O2(g)= CO(g) + 2H2O(l) ΔH=
您最近一年使用:0次
2019-05-07更新
|
281次组卷
|
2卷引用:内蒙古鄂尔多斯市第一中学2020-2021学年高一下学期第三次月考化学试题
名校
7 . 根据下列热化学方程式
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
C(s) + O2(g) = CO2(g) △H1=–393.5 kJ·mol-1
2H2(g) + O2(g) =2H2O(l) △H2=–571.6 kJ·mol-1
CH3COOH(l) +2O2(g)=2CO2 (g) + 2H2O(l) △H3=–870.3 kJ·mol-1
可以计算出2C(s) + 2H2(g)+ O2(g)=CH3COOH(l)的反应热为:
| A.△H=+244.1 kJ·mol-1 | B.△H=-488.3 kJ·mol-1 |
| C.△H=-996.6 kJ·mol-1 | D.△H=+996.6 kJ·mol-1 |
您最近一年使用:0次
2019-05-06更新
|
276次组卷
|
3卷引用:浙江省宁波市北仑区北仑中学2020-2021学年高一下学期中考试化学(选考)试题
8 . MgCO3和CaCO3的能量关系如图所示(M=Ca、Mg):不正确 的是

| A.ΔH1(MgCO3)>ΔH1(CaCO3)>0 |
| B.ΔH2(MgCO3)=ΔH2(CaCO3)>0 |
| C.ΔH1(CaCO3)-ΔH1(MgCO3)=ΔH3(CaO)-ΔH3(MgO) |
| D.对于MgCO3和CaCO3,ΔH1+ΔH2>ΔH3 |
您最近一年使用:0次
2019-04-12更新
|
7428次组卷
|
49卷引用:辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题
辽宁省沈阳市实验中学2021-2022学年高一上学期10月月考化学试题天津市第一中学2018-2019学年高一下学期期末考试化学试题(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练选择性必修1(SJ)专题1专题培优专练(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)选择性必修1 专题1 素养检测(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)专题10.化学反应中的能量变化-十年(2012-2021)高考化学真题分项汇编(浙江专用)四川省广安友谊中学2021-2022学年上学期高二10月月考化学试题湖北省石首市2021-2022学年高二上学期期中考试化学试题(已下线)专题09 化学反应与能量变化-备战2022年高考化学学霸纠错(全国通用)河南省信阳市2021-2022学年高二上学期期中考试化学试题2019年4月浙江省普通高校招生选考科目考试化学试题黑龙江省鹤岗市第一中学2020届高三11月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2019-2020学年高二10月月考化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高二上学期期中化学试题浙江省宁波市余姚中学2019-2020学年高二上学期期中考试化学试题2019年秋高三化学复习强化练习—— 盖斯定律及其应用河南省洛阳市2019-2020学年高三上学期尖子生第一次考试化学试题山东省滕州市第一中学2020届高三3月线上模拟考试化学试题(已下线)专题九 化学能与热能(真题汇编)-2020年高考二轮模块化复习之《化学基本原理》名师讲案与提分特训人教版(2019)高二选择性必修第一册 第一章 化学反应的热效应 第二节 反应热的计算 高考帮安徽省池州市第一中学2020-2021学年高二上学期9月月考化学试题鲁科版(2019)高二选择性必修第一册第1章 化学反应与能量变化 过高考 3年真题强化闯关人教版(2019)高二化学选择性必修1第一章 化学反应的热效应 过高考 3年真题强化闯关(已下线)【浙江新东方】97(已下线)小题必刷23 焓变与热化学方程式——2021年高考化学一轮复习小题必刷(通用版)(已下线)小题必刷24 盖斯定律及反应热计算——2021年高考化学一轮复习小题必刷(通用版)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(浙江专用)(已下线)解密08 化学反应与能量(讲义)-【高频考点解密】2022年高考化学二轮复习讲义+分层训练(全国通用)(已下线)专题7 盖斯定律专练(已下线)考点17 化学反应的热效应-备战2023年高考化学一轮复习考点帮(全国通用)第一章 综合拔高练(已下线)高中化学-高二上-9(已下线)易错点18 化学反应与能量-备战2023年高考化学考试易错题黑龙江省大庆市肇州县第二中学2022-2023学年高三上学期第二次月考化学试题湖南省长沙市第一中学2022-2023学年高三上学期月考卷(五)化学试题湖南省攸县第二中学2022-2023学年高三第六次月考化学试题(已下线)第六章 化学反应与能量 第34讲 反应热的计算黑龙江省富锦市第一中学2022-2023学年高二下学期第一次考试化学试题天津市区重点中学2023届高三毕业班联考(一)化学试题广东省揭阳市惠来县第一中学2022-2023学年高二下学期第一次月考化学试题山西省孝义市2022-2023学年高二4月月考化学试卷(已下线)专题08 化学反应中的能量变化(已下线)2019年高考浙江卷化学试题变式题(单选题21-25)(已下线)考点17 化学反应的热效应(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)黑龙江省哈尔滨第三中学2023-2024学年高二上学期第二次验收考试化学试题
2019高一下·全国·专题练习
名校
解题方法
9 . 工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。
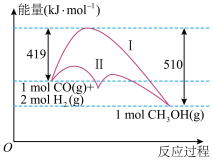
(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是________ (填“吸热”或“放热”)反应。计算当反应生成1.5 mol CH3OH(g)时,能量变化是________ kJ。
(2)选择适宜的催化剂________ (填“能”或“不能”)改变该反应的反应热。
(3)推测反应CH3OH(g)⇌CO(g)+2H2(g)是________ (填“吸热”或“放热”)反应。
 CH3OH(g),反应过程中的能量变化情况如图所示。
CH3OH(g),反应过程中的能量变化情况如图所示。
(1)曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。该反应是
(2)选择适宜的催化剂
(3)推测反应CH3OH(g)⇌CO(g)+2H2(g)是
您最近一年使用:0次
2019-03-18更新
|
621次组卷
|
4卷引用:人教版2019必修第二册 第六章 本章复习提升
人教版2019必修第二册 第六章 本章复习提升(已下线)2019年3月14日 《每日一题》 必修2 化学反应过程的能量变化图分析2020春(新教材)人教化学第二册第6章 化学反应与能量练习湖北省随州市曾都一中2019-2020学年高一下学期3月月考化学试题
10 . 已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l);ΔH1
2 H2(g)+ O2(g)= 2H2O(g);ΔH2
C(s)+ O2(g)=CO2(g);ΔH3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的ΔH为
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l);ΔH1
2 H2(g)+ O2(g)= 2H2O(g);ΔH2
C(s)+ O2(g)=CO2(g);ΔH3
则反应4C3H5(ONO2)3(l)= 12CO2(g)+10H2O(g) + O2(g) +6N2(g)的ΔH为
| A.12ΔH3+5ΔH2-2ΔH1 | B.2ΔH1-5ΔH2-12ΔH3 |
| C.12ΔH3-5ΔH2-2ΔH1 | D.ΔH1-5ΔH2-12ΔH3 |
您最近一年使用:0次
2019-01-30更新
|
4651次组卷
|
64卷引用:内蒙古包头市第六中学2020-2021学年高一下学期期中考试化学试题
内蒙古包头市第六中学2020-2021学年高一下学期期中考试化学试题江西省景德镇一中2020-2021学年高一下学期期末考试化学试题甘肃省礼县第一中学2020-2021学年高一上学期期中测试化学试题(已下线)2013-2014黑龙江省大庆铁人中学高一下学期期末考试化学试卷黑龙江省大庆市铁人中学2018-2019学年高一下学期期末化学试题河北省张家口宣化一中2020-2021学年高二下学期3月月考化学试题浙江省嘉兴市2020-2021学年高二下学期期末检测化学试题浙江省天台中学2021-2022学年高二上学期返校考试化学试题辽宁省营口市第二高级中学2021-2022学年高二上学期第一次月考化学试题安徽省池州市江南中学2021-2022学年高二上学期11月月考化学试题河北省唐山市迁西县职业技术教育中心2021-2022学年高二(普职融通部)上学期9月月考化学试题海南省临高县新盈中学2021-2022学年高二上学期(1-4班)期中考试化学试题安徽省安庆二中2022-2023学年高一下学期5月月考化学试题2013年全国普通高等学校招生统一考试化学(海南卷)(已下线)2013-2014学年黑龙江省哈师大附中高二上学期期中化学试卷(已下线)2014届高考化学二轮复习江苏专用 第5讲化学反应与能量练习卷(已下线)2014高考名师推荐化学盖斯定律及其应用(已下线)2015届山东省枣庄三中高三第一次学情调查化学试卷(已下线)2014-2015学年甘肃省庆阳一中高二第一学期期中考试化学试卷2015-2016学年西藏拉萨中学高二上第一次月考化学试卷2015-2016学年湖南常德石门第一中学高二上期中理化学卷2015-2016学年安徽省六安一中高二上第一阶段测化学试卷2016-2017学年重庆市第一中学高二上10月月考化学试卷2016-2017学年四川省成都外国语学校高二上10月月考化学试卷2016-2017学年河南省漯河中学高二上第一次月考化学卷2017届福建省厦门大学附中高三上学期第二次月考化学试卷湖北省沙市中学2017-2018学年高二上学期第二次双周考化学试题贵州省思南中学2017-2018学年高二上学期第一次月考化学试题安徽省铜陵市第一中学2017-2018学年高二10月月考化学试题浙江省温州中学2017-2018学年高二上学期期中考试化学试题黑龙江省孙吴县第一中学2017-2018学年高二上学期期中考试化学试题河南省三门峡市2018届高三上学期期末考试化学试题河南省鹤壁市淇县第一中学2018-2019学年高二(普通班)上学期第一次月考化学试题湖南省衡阳县第四中学2018-2019学年高二(普通班)第一学期9月月考化学试题黑龙江省绥化市第二中学2019届高三上学期第一次月考化学试题新疆自治区北京大学附属中学新疆分校2018-2019学年高二上学期10月月考化学试题(已下线)2018年10月19日 《每日一题》人教选修4-盖斯定律及其应用【全国百强校】贵州省思南中学2018-2019学年高二上学期期中考试化学试题西藏自治区拉萨中心2018-2019学年高二上学期第二次月考化学试题河南省实验中学2019-2020学年高二10月月考化学试题福建2020届高三化学总复习专题训练——选修四化学反应原理测试2019年秋高三化学复习强化练习—— 盖斯定律及应用黑龙江省宾县一中2020届高三上学期第三次月考化学试题海南省文昌中学2019-2020学年高二上学期第二次月考化学试题【懂做原理题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择提升24题】2020届高三化学选修4二轮专题练——盖斯定律的应用【选择精编25题】2020届高三化学二轮复习—— 化学能与热能【精编选择25题】山东省烟台市栖霞市2019-2020学年高二下学期3月网上统一月考化学试题天津市河北区2020届高三年级“停课不停学”期间线上测试化学试题(已下线)第01章 化学反应的热效应(A卷基础强化篇)-2020-2021学年高二化学选择性必修1同步单元AB卷(新教材人教版)四川省简阳市阳安中学2020-2021学年高二上学期9月月考化学试题黑龙江省哈尔滨师范大学附属中学2021届高三10月月考化学试题山东省惠民县第二中学致远部2020-2021学年高二上学期10月月考化学试题浙江省宁波诺丁汉大学附属中学2020-2021学年高二上学期10月月考化学试题湖南省中方一中2020-2021学年高二上学期期中考试化学试题吉林省汪清县汪清第四中学2020-2021学年高二上学期第二阶段考试化学试题云南省大理州祥云县2019-2020学年高二下学期期末统测化学试题湖北省巴东县第三高级中学2022-2023学年高二上学期第一次月考化学试题四川省广元市八二一中学2021-2022学年高二上学期期中考试化学试题宁夏吴忠市吴忠中学2022-2023学年高二上学期阶段性测试化学试题湖南省怀化市第三中学2022-2023学年高二上学期期中考试化学试题吉林省吉林市普通高中友好学校2022-2023学年高二上学期期末考试化学试题章末检测卷(一)化学反应与能量转化海南省首都师范大学附属昌江矿区中学2023-2024学年高二上学期12月月考化学试题



