解题方法
1 . 断开1molAB(g)分子中的化学键使其分别生成气态A原子和气态B原子所吸收的能量称A-B键的键能E:
请回答下列问题:
(1)如图表示某反应的能量变化关系,则此反应_______ (填“吸热”或“放热”)反应,其中∆H=_______ (用含有a、b的关系式表示)

(2)若图中表示反应2H2(g)+O2(g)=2H2O(g) ∆H=-241.8kJ·mol-1,x=_______ ;若忽略温度和压强对反应热的影响,当反应中有1mol电子转移时,反应的热量变化为_______ 。
(3)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:2CO(g)+O2(g)=2CO2(g) ∆H=-283.0kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-296.0kJ·mol-1
写出CO和SO2转化为单质硫的反应热化学方程式是_______ 。
| 化学键 | H—H | Cl—Cl | O=O | C—Cl | C—H | O—H | H—Cl |
| E/KJ·mol-1 | 436 | 247 | x | 330 | 413 | 463 | 431 |
(1)如图表示某反应的能量变化关系,则此反应

(2)若图中表示反应2H2(g)+O2(g)=2H2O(g) ∆H=-241.8kJ·mol-1,x=
(3)处理含CO、SO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质S。
已知:2CO(g)+O2(g)=2CO2(g) ∆H=-283.0kJ·mol-1
S(s)+O2(g)=SO2(g) ∆H=-296.0kJ·mol-1
写出CO和SO2转化为单质硫的反应热化学方程式是
您最近一年使用:0次
2 . 已知: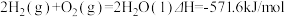 ①
①
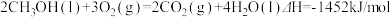 ②
②
下列说法正确的是
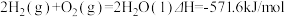 ①
①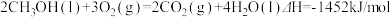 ②
②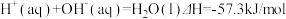
下列说法正确的是
| A.H2(g)的燃烧热为571.6kJ/mol |
| B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多 |
C.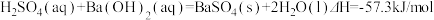 |
D.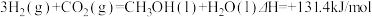 |
您最近一年使用:0次
2021-06-14更新
|
309次组卷
|
3卷引用:四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题
四川省南充西南大学实验学校2020-2021学年高一下学期6月月考化学试题(已下线)第一章 第三节 化学反应热的计算(备作业)-【上好课】2021-2022学年高二化学同步备课系列(人教版选修4)辽宁省大石桥市第三高级中学等三校2022-2023学年高一下学期5月期中联考化学试题
3 . 分别填空(1)已知下列热化学方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式___________
(2)书写下列物质的电子式:NH4Cl___________ HClO___________ Ca(OH)2 ___________ Na2O2 ___________
(3)将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好完全反应,并收集还原产物NO气体(还原产物只有一种)。然后向反应后的溶液中加入一定量NaOH溶液,金属离子恰好沉淀完全,沉淀质量为4.68g,则反应过程中收集到NO气体(标况下)体积为___________
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出 650kJ的热量,反应的热化学方程式为___________
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为___________
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式
(2)书写下列物质的电子式:NH4Cl
(3)将Mg、Cu组成的2.64g混合物投入适量稀硝酸中恰好完全反应,并收集还原产物NO气体(还原产物只有一种)。然后向反应后的溶液中加入一定量NaOH溶液,金属离子恰好沉淀完全,沉淀质量为4.68g,则反应过程中收集到NO气体(标况下)体积为
(4)在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出 650kJ的热量,反应的热化学方程式为
(5)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为
您最近一年使用:0次
解题方法
4 . 根据能量变化示意图,下列说法不正确的是
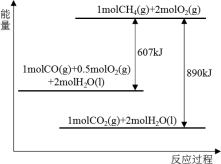

| A.2molCO(g)与1molO2(g)完全反应生成2molCO2(g)时要释放566kJ的能量 |
| B.1molCH4(g)与2molO2(g)具有的总能量高于1molCO2(g)与2molH2O(l) |
| C.1molCH4(g)完全燃烧生成气态水时释放的能量小于890kJ |
| D.16kg液化天然气完全燃烧释放的能量为890000kJ |
您最近一年使用:0次
解题方法
5 . 大气中SO2、H2S的资源化利用具有重要意义。回答下列问题:
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为___ 。
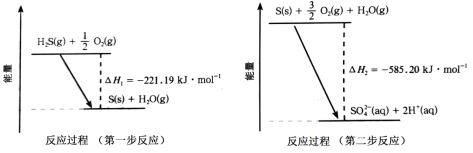
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。
b电极为___ 极(填“正”或“负”),其电极反应式为___ 。
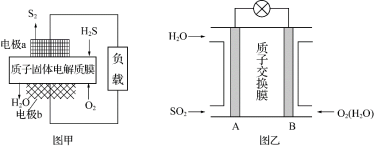
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为___ (填“从A到B”或“从B到A”)。
②负极的电极反应式为___ 。
③用该电池处理32gSO2,理论上需要消耗O2的体积为___ L(标准状况)。
(1)土壤中的微生物可将大气中的H2S经两步反应氧化成SO
 ,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO
,两步反应的能量变化如图所示。则1molH2S(g)全部氧化成SO (aq)的热化学方程式为
(aq)的热化学方程式为
(2)如图甲所示为质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。

b电极为
(3)图乙为SO2—空气质子交换膜燃料电池,可以利用大气所含的SO2快速启动。
①该电池中质子的流动方向为
②负极的电极反应式为
③用该电池处理32gSO2,理论上需要消耗O2的体积为
您最近一年使用:0次
解题方法
6 . 作为一种绿色消毒剂,H2O2在公共卫生事业中发挥了重要的作用。已知反应:H2O2(l)=H2O(1)+ O2(g)ΔH=-98kJ·mol-1K=2.88×1020
O2(g)ΔH=-98kJ·mol-1K=2.88×1020
回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是___ 。
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)=H2O(g)+ O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上____ (填“放出”或“吸收”)热量____ 98kJ(填“大于”、“小于”或“等于”)。
(3)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起____ 作用。某组实验数据如下:
0-30minH2O2反应的平均速率v=____ mol·L-1·min-1
 O2(g)ΔH=-98kJ·mol-1K=2.88×1020
O2(g)ΔH=-98kJ·mol-1K=2.88×1020回答问题:
(1)H2O2的强氧化性使其对大多数致病菌和病毒具有消杀功能。用3%医用H2O2对传染病房喷洒消毒时,地板上有气泡冒出,该气体是
(2)纯H2O2可作为民用驱雹火箭推进剂。在火箭喷口铂网催化下,H2O2剧烈分解:H2O2(l)=H2O(g)+
 O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上
O2(g),放出大量气体,驱动火箭升空。每消耗34gH2O2,理论上(3)向H2O2稀溶液中滴加数滴含Mn2+的溶液,即有气泡快速逸出,反应中Mn2+起
| t/min | 0 | 10 | 20 | 30 | 40 | 50 |
| c(H2O2)/mol·L-1 | 0.70 | 0.49 | 0.35 | 0.25 | 0.17 | 0.12 |
0-30minH2O2反应的平均速率v=
您最近一年使用:0次
解题方法
7 . 计算
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=___________ 。
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
下表列出了几种化学键的键能:【CO的结构 】
】
298 K时,上述反应的ΔH=___________ 。
(1)焦炭与CO、CO2、H2均是重要的化工原料。由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-49.58 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2=+41.19 kJ·mol-1
反应Ⅲ:CO(g)+2H2(g)=CH3OH(g) ΔH3
则反应Ⅲ的ΔH3=
(2)低能耗高效率的合成氨技术开发是实现氨燃料化利用的基础。探索新型合成氨技术是研究热点之一。回答下列问题:
哈伯合成氨在较高温度下以氢气做氢源,氢气可由天然气制备。CH4(g)+H2O(g)
 CO(g)+3H2(g)
CO(g)+3H2(g)下表列出了几种化学键的键能:【CO的结构
 】
】| 化学键 | H-H | C-H | H-O |  |
| 键能kJ/mol | 436 | 413 | 467 | 1072 |
您最近一年使用:0次
8 . 氨气是一种重要的化学物质,可用于制取化肥和硝酸等。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol
表中a为___________ 。
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为___________ 。
②根据反应I、II、III,下列说法正确的是___________ (填选项字母)。
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
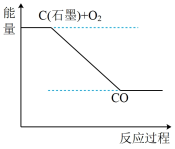 。
。
(1)工业合成氨的热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H=-92 kJ/mol
2NH3(g) △H=-92 kJ/mol| N-H | H-H | N≡N | |
| 断开1 mol化学键需要吸收的能量/kJ | a | 436 | 946 |
(2)合成氨原料中的H2可用CO在高温下与水蒸气反应制得。已知在25℃、101 kPa 下:
I. 2C(石墨,s)+O2(g)=2CO(g) △H1=- 222 kJ/mol
II.2H2(g)+O2(g)=2H2O(g) △H2=- 242 kJ/mol
III. C(石墨,s)+ O2(g)=CO2(g) △H3=- 394kJ/mol
①25℃、101 kPa 下CO与水蒸气反应转化为H2的热化学方程式为
②根据反应I、II、III,下列说法正确的是
a.由反应II可以推知:2H2(g)+O2(g)=2H2O(l) △H4,则△H4小于△H2
b.反应III的反应热等于O2分子中化学键断裂时所吸收的总能量与CO2分子中化学键形成时所释放的总能量的差
c.下图可表示反应I的反应过程和能量的关系
 。
。
您最近一年使用:0次
名校
9 . 单斜硫和正交硫是硫的两种同素异形体,下列说法不正确的是


| A.正交硫比单斜硫稳定 |
| B.S(s,单间) =S(s,正交) △H3=-0.33 kJ/mol |
| C.相同物质的量的正交硫比单斜疏所含的能量高 |
| D.由②可知断裂l molO2和1 mol正交硫中的共价键所吸收的能量比形成1 mol SO2中的共价键所放出的能量多296.83 kJ |
您最近一年使用:0次
10 . 下列与化学反应能量变化相关的叙述正确的是
| A.ΔH﹥0表示放热反应,ΔH﹤0表示吸热反应 |
| B.热化学方程式的化学计量数可以表示分子数或原子数,因此必须是整数 |
| C.根据盖斯定律,可计算某些难以直接测量的反应热 |
| D.同温同压下,H2( g)+Cl2(g)=2HCl (g),在光照和点燃条件的△H不同 |
您最近一年使用:0次



