名校
解题方法
1 . 利用化学反应原理研究氮单质及其化合物有重要意义。
已知:Ⅰ.
Ⅱ.
Ⅲ.
(1)工业合成氨反应在___________ (填“高温”或“低温”)条件下能自发进行。
(2)某温度下,若将 充入恒容密闭容器发生反应Ⅰ,下列说法可作为反应达到平衡判断依据的是___________(填序号)。
充入恒容密闭容器发生反应Ⅰ,下列说法可作为反应达到平衡判断依据的是___________(填序号)。
(3)某科研小组利用反应Ⅱ研究:在其他条件不变的情况下,加入一定量的 ,改变起始时
,改变起始时 对合成
对合成 反应的影响。实验结果如图所示。
反应的影响。实验结果如图所示。

①由图知:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②a、b、c三点中, 转化率最高的是
转化率最高的是___________ (填字母)。
③若容器容积为 点对应的初始时
点对应的初始时 ,测得平衡时
,测得平衡时 的转化率为50%,则平衡时
的转化率为50%,则平衡时 的物质的量浓度为
的物质的量浓度为___________ 。该温度下反应的平衡常数
___________ 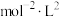 (保留两位有效数字)。
(保留两位有效数字)。
(4)对于反应Ⅲ,向恒容密闭容器中通入 和
和 ,反应一段时间后达到平衡。下列操作能提高
,反应一段时间后达到平衡。下列操作能提高 平衡转化率的是___________(填序号)。
平衡转化率的是___________(填序号)。
(5)将 和
和 置于
置于 的恒容密闭容器中反应。测得不同温度、不同时间段内合成
的恒容密闭容器中反应。测得不同温度、不同时间段内合成 反应中
反应中 的转化率,得到数据如下表:
的转化率,得到数据如下表:
① 温度下反应
温度下反应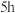 后,向容器内通入
后,向容器内通入 ,则
,则 会
会___________ (填“变大”、“变小”或“不变”)。
②表中a、b、25%三者大小顺序为___________ 。
已知:Ⅰ.

Ⅱ.

Ⅲ.

(1)工业合成氨反应在
(2)某温度下,若将
 充入恒容密闭容器发生反应Ⅰ,下列说法可作为反应达到平衡判断依据的是___________(填序号)。
充入恒容密闭容器发生反应Ⅰ,下列说法可作为反应达到平衡判断依据的是___________(填序号)。| A.混合气体密度不变 | B. |
C. 体积分数不变 体积分数不变 | D.混合气体平均摩尔质量不变 |
 ,改变起始时
,改变起始时 对合成
对合成 反应的影响。实验结果如图所示。
反应的影响。实验结果如图所示。
①由图知:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。②a、b、c三点中,
 转化率最高的是
转化率最高的是③若容器容积为
 点对应的初始时
点对应的初始时 ,测得平衡时
,测得平衡时 的转化率为50%,则平衡时
的转化率为50%,则平衡时 的物质的量浓度为
的物质的量浓度为
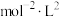 (保留两位有效数字)。
(保留两位有效数字)。(4)对于反应Ⅲ,向恒容密闭容器中通入
 和
和 ,反应一段时间后达到平衡。下列操作能提高
,反应一段时间后达到平衡。下列操作能提高 平衡转化率的是___________(填序号)。
平衡转化率的是___________(填序号)。A.向容器中通入 | B.使用高效催化剂 |
| C.压缩容器体积 | D.通入稀有气体 |
 和
和 置于
置于 的恒容密闭容器中反应。测得不同温度、不同时间段内合成
的恒容密闭容器中反应。测得不同温度、不同时间段内合成 反应中
反应中 的转化率,得到数据如下表:
的转化率,得到数据如下表: |  | 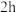 | 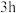 |  |
 | 10% | 16% | 25% | 25% |
 | 15% | 22% | a | b |
 温度下反应
温度下反应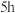 后,向容器内通入
后,向容器内通入 ,则
,则 会
会②表中a、b、25%三者大小顺序为
您最近一年使用:0次
2023-07-16更新
|
137次组卷
|
2卷引用:湖北省恩施州高中教育联盟2022-2023学年高一下学期期末考试化学试题
名校
2 . 反应4A(s)+3B(g)= 2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1对此反应速率的表示正确的是
| A.用A表示的反应速率是0.4 mol·L-1·min-1 |
| B.分别用B、C、D表示的反应速率之比是3∶2∶1 |
| C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1 |
| D.在2 min内的反应速率,用C表示是0.3 mol·L-1·min-1 |
您最近一年使用:0次
2023-07-15更新
|
285次组卷
|
16卷引用:湖北省黄冈麻城市第二中学2020-2021学年高二10月月考化学试题
湖北省黄冈麻城市第二中学2020-2021学年高二10月月考化学试题(已下线)同步君 人教版 选修4 第2章 第1节 化学反应速率高中化学人教版 选修四 第二章 化学反应速率和化学平衡 第一节 化学反应速率 化学反应速率黑龙江省齐齐哈尔市第八中学2018-2019学年高二上学期9月月考化学试题(已下线)2019年9月8日《每日一题》 选修4 每周一测山东省济宁市第二中学2019-2020学年高二上学期第一次月考化学试题辽宁省大连市普兰店区第一中学2019-2020学年高一下学期5月线上教学质量检测化学试题云南省昆明市官渡区第一中学2019-2020学年高二下学期期中考试化学试题湖南省湘西土家族苗族自治州花垣县边城高级中学2020-2021学年高二上学期入学考试化学试题安徽省涡阳县育萃中学2020-2021学年高二上学期第一次月考化学试题大连市普兰店区第一中学2020-2021学年高二上学期第一阶段考试化学试题(已下线)6.1.1 化学反应速率(第1课时 化学反应速率的概念和简单计算)-【帮课堂】2021-2022学年高一化学同步精品讲义(沪科版2020必修第二册)广东省广州市玉岩中学2022-2023学年高一下学期期中考试化学试题2.1.1化学反应速率的表示方法 课前(已下线)专题03 化学反应速率及影响因素、活化能【考点清单】(讲+练)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)云南省开远市第一中学校2023-2024学年高一下学期开学考试化学试题
13-14高二·全国·课时练习
名校
解题方法
3 . 某温度下,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中反应生成气体Z,经过t min后,测得物质的浓度分别为:c(X2)=0.4 mol·L-1,c(X2)=0.8 mol·L-1,c(Z)=0.4 mol·L-1 。则该反应的反应式可表示为:
A.X2+2Y2 2XY2 2XY2 | B.2 X2+Y2 X2Y X2Y |
C.3 X2+Y2 2X3Y 2X3Y | D. X2+3 Y2 2XY3 2XY3 |
您最近一年使用:0次
2023-07-12更新
|
118次组卷
|
19卷引用:2014-2015学年湖北省部分重点中学高二上学期期中考试化学试卷
(已下线)2014-2015学年湖北省部分重点中学高二上学期期中考试化学试卷(已下线)2014年高二化学人教版选修四 5化学反应速率练习卷(已下线)2015届安徽望江中学同步课时练(人教选修4)2.1 化学反应速率试卷2015-2016学年甘肃省嘉峪关一中高一下学期期末化学试卷云南省麒麟高中2018-2019学年高二6月考试化学试题四川省邻水实验学校2020-2021学年高一下学期第二次月考化学试题辽宁省铁岭市六校2020-2021学年高一下学期期末联考化学试题黑龙江省七台河市勃利县高级中学2021-2022学年高一下学期期中考试化学试题辽宁省大连市第一零三中学2021-2022学年高一下学期期中考试化学试题河南省林州市2021-2022学年高一下学期期末考试化学试题宁夏吴忠市吴忠中学2021-2022学年高二上学期月考化学试题新疆乌鲁木齐市林肯外国语培训学校、第十二中学2021-2022学年高一下学期期中考试化学试题安徽省合肥市肥东县综合高中2021-2022学年高一下学期5月月考化学试题黑龙江省伊春市伊美区第二中学2021-2022学年高一下学期期中考试化学试题广东省揭阳普宁市普师高级中学2021-2022学年高二上学期期中考试化学试题江苏省扬州中学2022-2023学年高一下学期开学摸底考试化学试题江苏省涟水县第一中学2022-2023学年高一下学期第一次月考化学试卷黑龙江省哈尔滨市第四中学校2022-2023学年高一下学期期末考试化学试题海南省琼海市嘉积中学2023-2024学年高二上学期末考试化学试题B卷
解题方法
4 . 石油经分馏后可以获得汽油、煤油、柴油等含碳原子少的轻质油,但其产量难以满足社会需求,而含碳原子多的重油却供大于求。因此,需要通过催化裂化过程将重油裂化为汽油等物质,再进一步裂解,可以获得很多重要的化工原料。
以十六烷为例了解这一过程: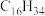 (十六烷)
(十六烷)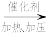 A(辛烷)+B(辛烯);A
A(辛烷)+B(辛烯);A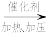 C+D(丁烷)
C+D(丁烷)
D(丁烷)继续分解可制得多种重要的基本化工原料:D(丁烷,g)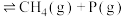 ;D(丁烷,g)
;D(丁烷,g)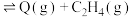
Ⅰ.向一体积为5 L的恒容密闭容器中充入2 mol丁烷,在一定温度和催化剂作用下发生上述2个分解反应,测得丁烷、甲烷的物质的量与时间关系如图所示。
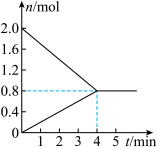
(1)下列数据中___________(填标号)不随时间变化能表明上述反应达到平衡状态。
(2)0~4 min内,乙烷的平均反应速率为___________  ;在该条件下,丁烷的平衡转化率为
;在该条件下,丁烷的平衡转化率为___________ 。
Ⅱ.关于A—D及D分解所得的有机物有如下问题:
(3)B中含有的官能团是:___________ (写结构式)。
(4)A有多种同分异构体,其中一种的分子结构中存在6个甲基,写出它与氯气进行一元取代的反应方程式:___________ 。
(5)Q与氯气在光照条件下反应可能得到的有机物共___________ 种,如果每一种有机产物生成量均相等,则3 mol Q需要与___________ mol氯气反应。
Ⅲ.P可通过加聚反应获得H。(一种常见的合成纤维——丙纶)及其他常见有机物E、F、G,过程如下图:
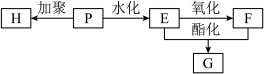
(6)写出H的结构简式___________ 。
(7)M既是G的同分异构体,又是F的同系物,满足此要求的有机物M共有___________ 种。
以十六烷为例了解这一过程:
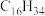 (十六烷)
(十六烷)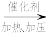 A(辛烷)+B(辛烯);A
A(辛烷)+B(辛烯);A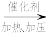 C+D(丁烷)
C+D(丁烷)D(丁烷)继续分解可制得多种重要的基本化工原料:D(丁烷,g)
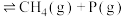 ;D(丁烷,g)
;D(丁烷,g)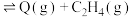
Ⅰ.向一体积为5 L的恒容密闭容器中充入2 mol丁烷,在一定温度和催化剂作用下发生上述2个分解反应,测得丁烷、甲烷的物质的量与时间关系如图所示。

(1)下列数据中___________(填标号)不随时间变化能表明上述反应达到平衡状态。
| A.碳原子总数 | B.总压强 | C.密度 | D.平均摩尔质量 |
 ;在该条件下,丁烷的平衡转化率为
;在该条件下,丁烷的平衡转化率为Ⅱ.关于A—D及D分解所得的有机物有如下问题:
(3)B中含有的官能团是:
(4)A有多种同分异构体,其中一种的分子结构中存在6个甲基,写出它与氯气进行一元取代的反应方程式:
(5)Q与氯气在光照条件下反应可能得到的有机物共
Ⅲ.P可通过加聚反应获得H。(一种常见的合成纤维——丙纶)及其他常见有机物E、F、G,过程如下图:

(6)写出H的结构简式
(7)M既是G的同分异构体,又是F的同系物,满足此要求的有机物M共有
您最近一年使用:0次
5 . 某温度下,在2 L恒容密闭容器中投入一定量的A、B发生反应: ,12s时生成C的物质的量为1.2 mol(过程如图所示)。下列说法中正确的是
,12s时生成C的物质的量为1.2 mol(过程如图所示)。下列说法中正确的是
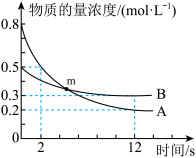
 ,12s时生成C的物质的量为1.2 mol(过程如图所示)。下列说法中正确的是
,12s时生成C的物质的量为1.2 mol(过程如图所示)。下列说法中正确的是
A.2 s内,用B表示反应的平均反应速率为 |
B. |
| C.图中m点达到了反应进行的限度 |
D.12 s时容器内的压强为起始压强的 |
您最近一年使用:0次
解题方法
6 . 合成氨反应 ;是化学工业的重要反应。回答下列问题:
;是化学工业的重要反应。回答下列问题:
(1)已知合成氨反应的能量变化如下图所示,相关物质的化学键键能见下表。则合成氨反应属于___________ (填写“放热”、“吸热”)反应,a+3b_______ 6c(填“>”“<”或“=”)

(2)向起始体积为2L的恒温恒容密闭容器中充入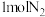 和
和 ,在一定条件下发生反应,反应至
,在一定条件下发生反应,反应至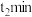 时达到平衡状态,氮气的转化率(a)与时间(t)的关系如图所示。
时达到平衡状态,氮气的转化率(a)与时间(t)的关系如图所示。

①在 ~
~ 内,该反应的平均反应速率v(NH3)=
内,该反应的平均反应速率v(NH3)=___________ 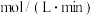 (用含
(用含 ,
, 的式子表示)。
的式子表示)。
②比较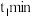 时
时
___________ 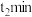 时
时 (填“>”“<”或“=”)
(填“>”“<”或“=”)
③下列各项能作为判断该反应达到化学平衡状态的依据是___________ (填字母)。
a.单位时间内,消耗 的同时生成
的同时生成
b.容器内压强不再改变
c.容器内 、
、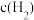 、
、 之比为1:3:2
之比为1:3:2
d.混合气体的密度不再改变
e.
(3)向一恒温恒压密闭容器中通入 和
和 ,此时容器的体积为1L。反应达到平衡后,测得容器的体积为起始时体积的80%。
,此时容器的体积为1L。反应达到平衡后,测得容器的体积为起始时体积的80%。
①平衡时, 和
和 的转化率之比为
的转化率之比为___________ 。
②平衡时, 的物质的量浓度为
的物质的量浓度为___________ 。
(4)如下图所示,起始时甲、乙两个装置的体积与温度均相同,则反应先达到化学平衡状态的是___________ (填写“甲”或“乙”)装置。

 ;是化学工业的重要反应。回答下列问题:
;是化学工业的重要反应。回答下列问题:(1)已知合成氨反应的能量变化如下图所示,相关物质的化学键键能见下表。则合成氨反应属于

 |  |  | |
| 键能(kJ/mol) | a | b | c |
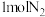 和
和 ,在一定条件下发生反应,反应至
,在一定条件下发生反应,反应至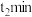 时达到平衡状态,氮气的转化率(a)与时间(t)的关系如图所示。
时达到平衡状态,氮气的转化率(a)与时间(t)的关系如图所示。
①在
 ~
~ 内,该反应的平均反应速率v(NH3)=
内,该反应的平均反应速率v(NH3)=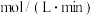 (用含
(用含 ,
, 的式子表示)。
的式子表示)。②比较
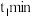 时
时
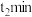 时
时 (填“>”“<”或“=”)
(填“>”“<”或“=”)③下列各项能作为判断该反应达到化学平衡状态的依据是
a.单位时间内,消耗
 的同时生成
的同时生成
b.容器内压强不再改变
c.容器内
 、
、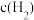 、
、 之比为1:3:2
之比为1:3:2d.混合气体的密度不再改变
e.

(3)向一恒温恒压密闭容器中通入
 和
和 ,此时容器的体积为1L。反应达到平衡后,测得容器的体积为起始时体积的80%。
,此时容器的体积为1L。反应达到平衡后,测得容器的体积为起始时体积的80%。①平衡时,
 和
和 的转化率之比为
的转化率之比为②平衡时,
 的物质的量浓度为
的物质的量浓度为(4)如下图所示,起始时甲、乙两个装置的体积与温度均相同,则反应先达到化学平衡状态的是

您最近一年使用:0次
7 . 化学反应原理与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
求2~4min时间段以盐酸的浓度变化来表示的该反应速率为_____ (设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为可行的是_____(填字母)。
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图1。

①该反应的化学方程式是_____ 。
②该反应达到平衡状态的标志是_____ (填字母)。
A.Y在混合气体中的体积分数保持不变
B.X、Y的反应速率比为3:1
C.容器内气体密度保持不变
D.生成3molY的同时生成2molZ
③4min时,正反应速率_____ 逆反应速率(填“>”“<”或“=”)。
④5min内Y的转化率为_____ 。
(4)可以用图示法分析化学反应中的能量变化。观察题图2,该反应2HI(g) I2(g)+H2(g)能量
I2(g)+H2(g)能量_____ (增加、减小)_____ kJ/mol。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如表(累计值):
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 氢气体积/mL(标准状况) | 200 | 480 | 928 | 1152 | 1240 |
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为可行的是_____(填字母)。
| A.蒸馏水 | B.KNO3溶液 | C.CH3COONa固体 | D.CuSO4溶液 |

①该反应的化学方程式是
②该反应达到平衡状态的标志是
A.Y在混合气体中的体积分数保持不变
B.X、Y的反应速率比为3:1
C.容器内气体密度保持不变
D.生成3molY的同时生成2molZ
③4min时,正反应速率
④5min内Y的转化率为
(4)可以用图示法分析化学反应中的能量变化。观察题图2,该反应2HI(g)
 I2(g)+H2(g)能量
I2(g)+H2(g)能量
您最近一年使用:0次
名校
解题方法
8 . 反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),在5L的密闭容器中进行,反应开始时NH3为1mol,半分钟后,NO的物质的量增加了0.30mol。下列叙述正确的是
4NO(g)+6H2O(g),在5L的密闭容器中进行,反应开始时NH3为1mol,半分钟后,NO的物质的量增加了0.30mol。下列叙述正确的是
 4NO(g)+6H2O(g),在5L的密闭容器中进行,反应开始时NH3为1mol,半分钟后,NO的物质的量增加了0.30mol。下列叙述正确的是
4NO(g)+6H2O(g),在5L的密闭容器中进行,反应开始时NH3为1mol,半分钟后,NO的物质的量增加了0.30mol。下列叙述正确的是| A.容器中H2O的物质的量减少了0.45mol |
| B.NH3的平均反应速率是0.010mol/(L·s) |
| C.当容器中NH3、O2、NO、H2O的物质的量之比是4∶5∶4∶6时,说明该反应达到平衡 |
| D.容器中NH3的转化率为30% |
您最近一年使用:0次
2023-07-07更新
|
173次组卷
|
3卷引用:湖北省荆门市2022-2023学年高一下学期期末学业水平检测化学试题
名校
解题方法
9 . 将等物质的量的A、B混合于2L的恒容密闭容器中,发生反应:3A(g)+B(g)=xC(g)+2D(g),2min后测得c(D)=0.5mol/L,c(A):c(B)=3:5,以C表示的平均速率v(C)=0.25mol/(L·min),下列说法正确的是
| A.2min时,A的物质的量为1.5mol | B.2min时,A的转化率为60% |
| C.反应速率v(B)=0.25mol/(L·min) | D.该反应方程式中,x=1 |
您最近一年使用:0次
2023-07-06更新
|
1984次组卷
|
49卷引用:湖北省鄂州市2019-2020学年高二上学期期末考试化学试题
湖北省鄂州市2019-2020学年高二上学期期末考试化学试题湖北省黄冈市黄梅国际育才高级中学2019-2020学年高二上学期12月月考化学试题【全国百强校】浙江省余姚中学2018-2019学年高一下学期3月月考化学试题【全国百强校】广西壮族自治区桂林市第十八中学2018-2019学年高一下学期期中段考化学试题广东省佛山市三水区实验中学2018-2019学年高一下学期第三学段考试化学试题江苏省宿迁市沭阳县修远中学2018-2019学年高二下学期第二次月考化学试题广西桂林市中山中学2018-2019学年高二下学期期中考试化学试题四川省武胜烈面中学2019-2020学年高二10月月考化学试题河北省石家庄二中雄安校区-河北安新中学2019-2020学年高二上学期期中考试化学试题(已下线)【南昌新东方】江西省南昌市第三中学2019-2020学年度高二上学期期中化学试题河北省张家口市第一中学2019-2020学年高二12月月考化学试题安徽省合肥市第八中学2019-2020学年高一下学期网络学习段考四化学试题河北省沧州市盐山中学2019-2020学年高二上学期期末考试(B)化学试题吉林省吉林市吉化第一高级中学校2019-2020学年高一下学期期末考试化学试题(已下线)第02章 化学反应速率和化学平衡(B卷提升篇)——2020-2021学年高二化学选修四同步单元AB卷(人教版)(已下线)2.1 化学反应速率(重点练)-2020-2021学年高二化学上学期十分钟同步课堂专练(人教版选修4)河南省三门峡市第一高级中学2020-2021学年高二上学期9月月考化学试题(已下线)2.1+化学反应速率-2020-2021学年高二化学同步课堂帮帮帮(人教版选修4)山东省惠民县第二中学致远部2020-2021学年高二上学期10月月考化学试题四川省自贡市富顺一中2020—2021学年度高二上学期期中考试化学试题(已下线)练习4 化学反应速率-2020-2021学年【补习教材·寒假作业】高二化学(人教版)吉林省公主岭市范家屯镇第一中学2020-2021学年高二上学期期末两校联考化学试题江苏省南菁高级中学2020-2021学年高二上学期第一次阶段性考试化学试题宁夏吴忠中学2020-2021学年高二上学期期末考试化学试题湖南省长沙市明德中学2020-2021学年高二下学期开学考化学试卷广西贵港市立德高级中学2020-2021学年高二下学期3月月考化学试题湖南省邵阳邵东市第一中学2020-2021学年高二下学期期中考试化学试题天津市实验中学滨海学校2020-2021学年高一下学期期中化学试题安徽省安庆市2020-2021学年高一下学期期末考试化学试题(已下线)2.1 化学反应速率-2021-2022学年高二化学课后培优练(人教版选修4)海南省北京师范大学万宁附属中学2021-2022学年高二上学期第一次月考化学试题 陕西省泾阳县2020-2021学年高二上学期期中考试化学试题甘肃省民乐县第一中学2021--2022学年高二上学期期中考试化学试题湖南省沅陵县第一中学2021-2022学年高二下学期入学考试化学试题河北省张家口市第一中学2021-2022学年高二上学期10月月考化学试题陕西省宝鸡市长岭中学2021-2022学年高二上学期期中考试化学试题黑龙江省哈尔滨市第七十三中学校2022-2023学年高二上学期第一次月考化学试题河北省行唐启明中学2022-2023学年高二上学期期末考试化学试题天津市和平区第五十五中学2022-2023学年高一下学期期中化学试试题四川省成都市第七中学2022-2023学年高一下学期期末考试化学试题四川省成都外国语学校2023-2024学年高二上学期9月月考化学试题(已下线)专题03 化学反应速率及影响因素、活化能【考题猜想】(9大题型)-2023-2024学年高二化学期中考点大串讲(人教版2019选择性必修1)黑龙江省齐齐哈尔市2023-2024学年高二上学期10月期中考试化学试题甘肃省张掖市高台县第一中学2023-2024学年高二上学期10月月考化学试题陕西省汉中市乡县第一中学2023-2024学年高二上学期10月月考化学试题四川省南充市嘉陵第一中学2023-2024学年高二上学期10月月考化学试题内蒙古赤峰二中2023-2024学年高二上学期10月月考化学试题陕西省咸阳市兴平市西郊高级中学2023-2024学年高二上学期期中考试化学试题浙江省绍兴市第一中学2023-2024学年高二上学期11月期中考试(平行班)化学试题
解题方法
10 . 溴单质是重要的化工原料之一,工业上从海水中提取溴的流程如下:(已知:海水中溴元素主要以 形式存在)
形式存在) 的空气按一定速率通入吸收塔,用
的空气按一定速率通入吸收塔,用 和水进行吸收,写出吸收反应的化学方程式:
和水进行吸收,写出吸收反应的化学方程式:___________ 。
(2)吸收后的空气进行循环利用。吹出时, 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。 流量过大,
流量过大, 吹出率反而下降的原因是:
吹出率反而下降的原因是:___________ 。___________ 。当有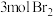 参加反应,发生转移的电子的物质的量为
参加反应,发生转移的电子的物质的量为___________ 。
(4)用于吸收 的
的 是工业制硫酸的重要物质,其中主反应是催化氧化
是工业制硫酸的重要物质,其中主反应是催化氧化 。现将
。现将 与足量
与足量 置于密闭容器中,在催化剂、
置于密闭容器中,在催化剂、 条件下发生反应。
条件下发生反应。 与
与 的物质的量浓度随时间的变化如图所示,请回答下列问题。
的物质的量浓度随时间的变化如图所示,请回答下列问题。 的浓度变化表示该反应的平均速率是
的浓度变化表示该反应的平均速率是___________ ;2min时,反应是否达到化学平衡状态___________ (填“是”或“否”)。
ii.关于该反应下列说法不正确的是___________ 。
a.催化剂可以加快化学反应速率
b.改变温度或压强,可以实现 的完全转化
的完全转化
c.当生成 且消耗
且消耗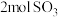 时,反应达到化学平衡状态
时,反应达到化学平衡状态
(5)我国科学家最新研发出了可充电的非水相镁—溴电池,其工作原理如图所示(正、负极区之间的离子选择性膜只允许 通过;反应前,正、负极区电解质溶液质量相等)。下列说法正确的是 。
通过;反应前,正、负极区电解质溶液质量相等)。下列说法正确的是 。
 形式存在)
形式存在)
 的空气按一定速率通入吸收塔,用
的空气按一定速率通入吸收塔,用 和水进行吸收,写出吸收反应的化学方程式:
和水进行吸收,写出吸收反应的化学方程式:(2)吸收后的空气进行循环利用。吹出时,
 吹出率与吸收塔中
吹出率与吸收塔中 流量的关系如图所示。
流量的关系如图所示。 流量过大,
流量过大, 吹出率反而下降的原因是:
吹出率反而下降的原因是:

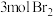 参加反应,发生转移的电子的物质的量为
参加反应,发生转移的电子的物质的量为(4)用于吸收
 的
的 是工业制硫酸的重要物质,其中主反应是催化氧化
是工业制硫酸的重要物质,其中主反应是催化氧化 。现将
。现将 与足量
与足量 置于密闭容器中,在催化剂、
置于密闭容器中,在催化剂、 条件下发生反应。
条件下发生反应。 与
与 的物质的量浓度随时间的变化如图所示,请回答下列问题。
的物质的量浓度随时间的变化如图所示,请回答下列问题。
 的浓度变化表示该反应的平均速率是
的浓度变化表示该反应的平均速率是ii.关于该反应下列说法不正确的是
a.催化剂可以加快化学反应速率
b.改变温度或压强,可以实现
 的完全转化
的完全转化c.当生成
 且消耗
且消耗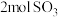 时,反应达到化学平衡状态
时,反应达到化学平衡状态(5)我国科学家最新研发出了可充电的非水相镁—溴电池,其工作原理如图所示(正、负极区之间的离子选择性膜只允许
 通过;反应前,正、负极区电解质溶液质量相等)。下列说法正确的是 。
通过;反应前,正、负极区电解质溶液质量相等)。下列说法正确的是 。
| A.Mg作负极,发生氧化反应 |
B.石墨电极上发生的电极反应为 |
| C.用该电池对铅蓄电池进行充电时,N端与铅蓄电池中的Pb电极相连 |
| D.当外电路通过0.2mol电子时,正、负极区电解质溶液质量差为2.4g |
您最近一年使用:0次



