名校
解题方法
1 . 已知在一定条件下 可转化为高附加值的燃料
可转化为高附加值的燃料 ,反应原理为
,反应原理为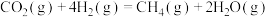 。实验测得在四种不同条件下的反应速率分别为①
。实验测得在四种不同条件下的反应速率分别为① 、②
、② 、③
、③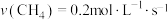 、④
、④ ,则四种条件下的速率关系为
,则四种条件下的速率关系为
 可转化为高附加值的燃料
可转化为高附加值的燃料 ,反应原理为
,反应原理为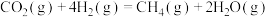 。实验测得在四种不同条件下的反应速率分别为①
。实验测得在四种不同条件下的反应速率分别为① 、②
、② 、③
、③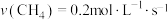 、④
、④ ,则四种条件下的速率关系为
,则四种条件下的速率关系为| A.②>①>④>③ | B.④>③>②>① |
| C.③>④>②>① | D.④=③>②>① |
您最近一年使用:0次
2023-10-17更新
|
979次组卷
|
11卷引用:湖北省十堰市部分普通高中2023-2024学年高二上学期11月期中考试化学试题
湖北省十堰市部分普通高中2023-2024学年高二上学期11月期中考试化学试题内蒙古部分名校2023-2024学年高二上学期10月联考化学试题山西省部分名校2023-2024学年高二上学期10月联合考试化学试题江西省部分高中学校2023-2024高二上学期10月联考化学试题福建省泉州市2023-2024学年高二上学期期中考试化学试题河南省新乡市2023-2024学年高二上学期期中考试化学试题【定心卷】2.2.1 化学反应速率随堂练习-人教版2023-2024学年选择性必修1江西省上饶市广信中学2023-2024学年高二上学期11月月考化学试题09-2023新东方高二上期中考化学山西省朔州市怀仁市第九中学高中部2023-2024学年高二上学期11月期中化学试题江西省赣州市大余县部分学校联考2023-2024学年高二上学期12月月考化学试题
名校
2 . 研究化学反应的原理,对掌握物质的应用有重要的意义。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:
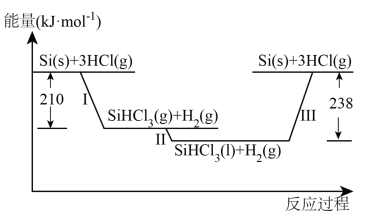
(1)工业上用 ,为原料制备粗硅。反应的化学方程式为
,为原料制备粗硅。反应的化学方程式为_______ 。
(2)反应Ⅲ生成2mol Si(s)时,_______ (填“吸收”或“放出”)_______ 热量。
(3)在2L密闭容器中投入过量Si(s)和3mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6 。
。
①反应开始到t min,用HCl浓度变化表示的平均反应速率为_______  。
。
②下列叙述不能说明反应Ⅰ一定达到平衡状态的是_______ (填标号)。
A.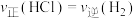 B.硅的质量保持不变
B.硅的质量保持不变
C.HCl的质量分数保持不变 D.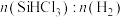 保持不变
保持不变
Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。
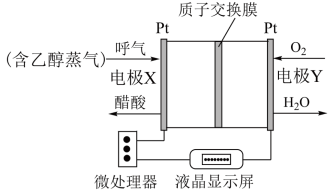
(4)电极X为_______ (填“正极”、“负极”)。
(5)电池工作时,质子通过交换膜_______ (填“从左到右”“从右到左”)迁移。
(6)正极的电极反应式为_______ 。
Ⅰ.硅是太阳能电池的重要材料。“精炼硅”反应历程中的能量变化如下图所示:

(1)工业上用
 ,为原料制备粗硅。反应的化学方程式为
,为原料制备粗硅。反应的化学方程式为(2)反应Ⅲ生成2mol Si(s)时,
(3)在2L密闭容器中投入过量Si(s)和3mol HCl(g)发生反应Ⅰ,经过t min反应达到平衡状态,测得容器中HCl的平衡浓度为0.6
 。
。①反应开始到t min,用HCl浓度变化表示的平均反应速率为
 。
。②下列叙述不能说明反应Ⅰ一定达到平衡状态的是
A.
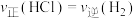 B.硅的质量保持不变
B.硅的质量保持不变C.HCl的质量分数保持不变 D.
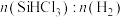 保持不变
保持不变Ⅱ.用于检测酒驾的酸性燃料电池酒精检测仪工作原理如图所示。

(4)电极X为
(5)电池工作时,质子通过交换膜
(6)正极的电极反应式为
您最近一年使用:0次
解题方法
3 . 氢能是一种非常清洁的能源,氨分解制备氢气是一种技术先进和经济可行的工艺。恒温恒容的密闭容器中,在某催化剂表面上发生氨的分解反应 ,测得不同起始浓度和催化剂表面积下
,测得不同起始浓度和催化剂表面积下 的浓度随时间的变化如下表所示:
的浓度随时间的变化如下表所示:
回答下列问题:
(1)已知 、
、 、
、 的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则
的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则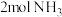 完全分解吸收的能量为
完全分解吸收的能量为_______ kJ。
(2)实验①中20~40min,
_______ 。
(3)实验③达到平衡后, 的体积分数约为
的体积分数约为_______ (保留三位有效数字)。
(4)下列能说明该反应达到平衡状态的是_______ (填序号)
a.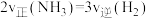 b.
b. 保持不变
保持不变
c. 保持不变 d.容器内混合气体密度保持不变
保持不变 d.容器内混合气体密度保持不变
e.容器内混合气体平均相对分子质量保持不变
(5)关于上述实验,下列说法正确的是_______ (填序号)
a.实验②,60min时处于平衡状态
b.相同条件下,增加氨气的浓度,反应速率增大
c.相同条件下,增加催化剂的表面积,反应速率增大
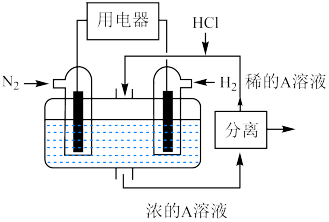
(6)有人设想以 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为_______ ,A为_______ (填化学式)。
 ,测得不同起始浓度和催化剂表面积下
,测得不同起始浓度和催化剂表面积下 的浓度随时间的变化如下表所示:
的浓度随时间的变化如下表所示:| 编号 | 时间min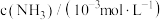 表面积/  | 0 | 20 | 40 | 60 | 80 |
| ① | a | 2.40 | 2.00 | 1.60 | 1.20 | 0.80 |
| ② | a | 1.20 | 0.80 | 0.40 | x | |
| ③ | 2a | 2.40 | 1.60 | 0.80 | 0.40 | 0.40 |
(1)已知
 、
、 、
、 的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则
的键能分别为436kJ/mol、946kJ/mol、391kJ/mol。则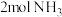 完全分解吸收的能量为
完全分解吸收的能量为(2)实验①中20~40min,

(3)实验③达到平衡后,
 的体积分数约为
的体积分数约为(4)下列能说明该反应达到平衡状态的是
a.
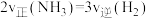 b.
b. 保持不变
保持不变c.
 保持不变 d.容器内混合气体密度保持不变
保持不变 d.容器内混合气体密度保持不变e.容器内混合气体平均相对分子质量保持不变
(5)关于上述实验,下列说法正确的是
a.实验②,60min时处于平衡状态
b.相同条件下,增加氨气的浓度,反应速率增大
c.相同条件下,增加催化剂的表面积,反应速率增大
(6)有人设想以
 和
和 为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式为
您最近一年使用:0次
4 . 研究氮氧化合物的治理是环保的一项重要工作,合理应用和处理氮的化合物,在生产生活中有着重要的意义。
(1)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g) 2ClNO(g) ΔH<0
2ClNO(g) ΔH<0
①一定温度下,将2molNO与2molCl2置于2L密闭容器中发生反应,若该反应4min后达平衡,此时压强是初始的0.8倍,则平均反应速率v(Cl2)___________ mol•L-1•min-1。下列可判断反应达平衡状态的是
___________ (填入字母代号)。
A.混合气体的平均相对分子质量不变 B.混合气体密度保持不变
C.NO和Cl2的物质的量之比保持不变 D.每消耗1molNO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有___________ (填选项序号字母)。
A.升高温度 B.缩小容器体积 C.再充入Cl2气体 D.使用合适的催化剂
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随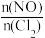 的变化图像如图所示。当
的变化图像如图所示。当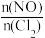 =3.0时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的
=3.0时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的___________ 点。

(2)已知2NO(g)+O2(g) 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g) N2O2(g)(快),v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g)(快),v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
②N2O2(g)+O2(g) 2NO2(g)(慢),v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢),v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________ E2(填“>”、“<”或“=”);2NO(g)+O2(g) 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________ 。
(1)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)
 2ClNO(g) ΔH<0
2ClNO(g) ΔH<0①一定温度下,将2molNO与2molCl2置于2L密闭容器中发生反应,若该反应4min后达平衡,此时压强是初始的0.8倍,则平均反应速率v(Cl2)
A.混合气体的平均相对分子质量不变 B.混合气体密度保持不变
C.NO和Cl2的物质的量之比保持不变 D.每消耗1molNO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有
A.升高温度 B.缩小容器体积 C.再充入Cl2气体 D.使用合适的催化剂
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随
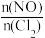 的变化图像如图所示。当
的变化图像如图所示。当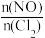 =3.0时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的
=3.0时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的
(2)已知2NO(g)+O2(g)
 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:①2NO(g)
 N2O2(g)(快),v1正=k1正c2(NO),v1逆=k1逆c(N2O2)
N2O2(g)(快),v1正=k1正c2(NO),v1逆=k1逆c(N2O2)②N2O2(g)+O2(g)
 2NO2(g)(慢),v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢),v2正=k2正c(N2O2)•c(O2),v2逆=k2逆c2(NO2)比较反应①的活化能E1与反应②的活化能E2的大小:E1
 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为
您最近一年使用:0次
5 . 将5molH2O(g)和1molCH4(g)混合气体通入2L容积恒定的密闭容器中,在一定条件下发生如下反应:CH4(g)+H2O(g) CO(g)+3H2(g)。维持容器内温度不变,10min末测定CH4的浓度为0.2mol/L,下列说法正确的是
CO(g)+3H2(g)。维持容器内温度不变,10min末测定CH4的浓度为0.2mol/L,下列说法正确的是
 CO(g)+3H2(g)。维持容器内温度不变,10min末测定CH4的浓度为0.2mol/L,下列说法正确的是
CO(g)+3H2(g)。维持容器内温度不变,10min末测定CH4的浓度为0.2mol/L,下列说法正确的是A.从反应开始到10min,H2的生成速率 (H2)=0.24mol•L-1•min-1 (H2)=0.24mol•L-1•min-1 |
| B.若单位时间内消耗amolCH4,同时产生3amolH2,则表明该反应达到化学平衡状态 |
| C.反应达到平衡后充入少量氦气,压强增大,平衡逆向移动,氢气产率下降 |
| D.当容器内混合气体的平均相对分子质量保持不变,则表明该反应达到化学平衡状态 |
您最近一年使用:0次
解题方法
6 . 氨基甲酸铵(H2NCOONH4)为尿素生产过程的中间产物,易分解。某小组对氨基甲酸铵的分解实验进行探究。
已知:Ⅰ.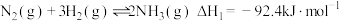
Ⅱ.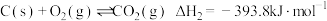
Ⅲ.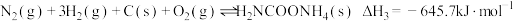
回答下列问题:
(1) 分子中含有键
分子中含有键___________ (填“极性”或“非极性”),写出二氧化碳的电子式___________ 。
(2)写出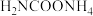 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:___________ 。
(3)在一定温度下,向 密闭容器中,加入
密闭容器中,加入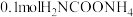 ,实验测得
,实验测得 物质的量变化如下表所示:
物质的量变化如下表所示:
从反应开始到2min,用 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为___________ ;平衡后,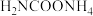 的转化率为
的转化率为___________ 。
(4)若在恒温恒压条件下进行反应,下列能够说明该反应已达到化学平衡状态的是___________。
(5)对该反应,改变某一条件,对化学反应速率的影响及解释不正确的是___________ 。
A.升高温度,使单位体积内活化分子百分数增加,反应速率加快
B.增加反应物的量,使活化分子百分数增加,有效碰撞增多,反应速率加快
C.使用催化剂能降低反应活化能,使单位体积内活化分子百分数增加,反应速率加快
已知:Ⅰ.
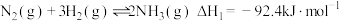
Ⅱ.
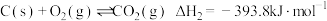
Ⅲ.
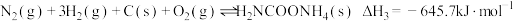
回答下列问题:
(1)
 分子中含有键
分子中含有键(2)写出
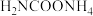 分解生成
分解生成 与
与 气体的热化学方程式:
气体的热化学方程式:(3)在一定温度下,向
 密闭容器中,加入
密闭容器中,加入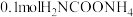 ,实验测得
,实验测得 物质的量变化如下表所示:
物质的量变化如下表所示: | 0 | 1 | 2 | 3 | 4 |
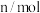 | 0 | a | b | c | c |
 的浓度变化表示的化学反应速率为
的浓度变化表示的化学反应速率为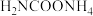 的转化率为
的转化率为(4)若在恒温恒压条件下进行反应,下列能够说明该反应已达到化学平衡状态的是___________。
A. 的浓度不再改变 的浓度不再改变 | B.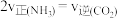 |
| C.容器体积不再改变 | D.容器内密度不再改变 |
A.升高温度,使单位体积内活化分子百分数增加,反应速率加快
B.增加反应物的量,使活化分子百分数增加,有效碰撞增多,反应速率加快
C.使用催化剂能降低反应活化能,使单位体积内活化分子百分数增加,反应速率加快
您最近一年使用:0次
名校
7 . 对利用甲烷消除 污染进行研究,
污染进行研究,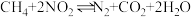 。在
。在 密闭容器中,控制不同温度,分别加入
密闭容器中,控制不同温度,分别加入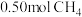 和
和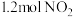 ,测得
,测得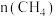 随时间变化的有关实验数据见下表。下列说法正确的是
随时间变化的有关实验数据见下表。下列说法正确的是
 污染进行研究,
污染进行研究,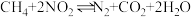 。在
。在 密闭容器中,控制不同温度,分别加入
密闭容器中,控制不同温度,分别加入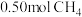 和
和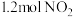 ,测得
,测得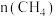 随时间变化的有关实验数据见下表。下列说法正确的是
随时间变化的有关实验数据见下表。下列说法正确的是| 组别 | 温度 | 时间  | 0 | 10 | 20 | 40 | 50 |
| ① |  | 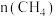 | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| ② |  | 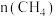 | 0.50 | 0.30 | 0.18 | 0.15 |
A.组别1中,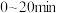 内, 内, 的降解速率为 的降解速率为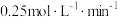 |
B.由实验数据可知实验控制的温度 |
C.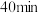 时,表格中 时,表格中 对应反应已经达到平衡状态 对应反应已经达到平衡状态 |
D. 内, 内, 的降解速率①>② 的降解速率①>② |
您最近一年使用:0次
2023-10-02更新
|
144次组卷
|
24卷引用:湖北省黄州中学(黄冈市外国语学校)2023-2024学年高二上学期9月月考化学试题
湖北省黄州中学(黄冈市外国语学校)2023-2024学年高二上学期9月月考化学试题浙江省丽水市四校2018-2019学年高一下学期期中化学试题高一必修第二册(人教2019版)全书综合训练河北省安平中学2020-2021学年高二上学期第一次月考化学试题黑龙江省鹤岗市第一中学2021届高三上学期第二次月考化学试题江苏省海安市2020-2021学年高二上学期期中考试化学试题江西省景德镇市昌江区景德镇一中2020-2021学年高二上学期期中考试化学试题(1班)山东师范大学附属中学2020-2021学年高一下学期期中学分认定考试化学(等级考)试题河北省任丘一中2021-2022学年高二上学期开学考试化学试题江苏省盐城市阜宁中学等四校2021-2022学年高一下学期期中考试化学试题江苏省南京市六校联合体2021-2022高一下学期期中考试化学试题山东省泰安市2021-2022学年高一下学期期末考试化学试题黑龙江省齐齐哈尔市恒昌中学校2021-2022学年高二上学期期中考试化学试题四川省成都市东部新区养马高级中学2022-2023学年高二上学期期中考试化学试题江苏省南通市海安高级中学2022-2023学年高一下学期第一次月考化学试题福建省福州格致中学2022-2023学年高一下学期期中考试化学试题河北省正定中学2022-2023学年高一下学期第二次月考化学试题黑龙江省牡丹江市第一高级中学2022-2023学年高一下学期5月期中考试化学试题安徽省亳州市第二完全中学2022-2023学年高一下学期期中考试化学试题(特培班)江西省九江市德安县第一中学2022-2023学年高一下学期5月期中考试化学试题江苏省南通市通州区金沙中学2021-2022学年高二上学期第一次调研考试化学试题云南省下关第一中学2023-2024学年高二上学期9月月考化学试题江苏省常州高级中学2023~2024 学年高二上学期10月阶段检测化学试题阶段重点练(四)
名校
8 . 下列实验操作描述正确且能达到实验目的的是
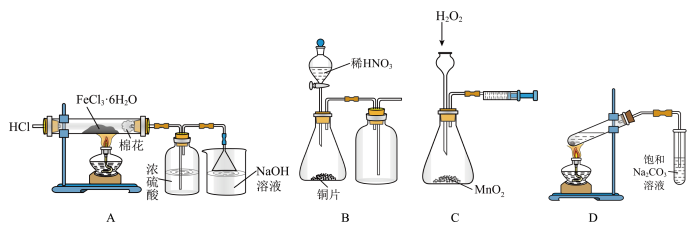

| A.制备无水氯化铁 | B.制取、收集NO | C.测定化学反应速率 | D.制备乙酸乙酯 |
您最近一年使用:0次
名校
9 . 在温度T1时,向一体积固定为2L的密闭容器中通入1molCO2和3molH2发生反应: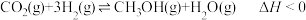 ,5min后反应达到平衡,CO2的转化率为20%。下列说法正确的是
,5min后反应达到平衡,CO2的转化率为20%。下列说法正确的是
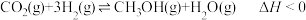 ,5min后反应达到平衡,CO2的转化率为20%。下列说法正确的是
,5min后反应达到平衡,CO2的转化率为20%。下列说法正确的是| A.前5min,平均反应速率v(H2)=0.03mol/(L·min) |
| B.该温度下反应平衡常数的值为0.014 |
| C.当3v正(CO2)=v正(H2)时,说明反应已达到平衡状态 |
| D.若平衡后升温,正反应速率减小,逆反应速率增大,平衡左移 |
您最近一年使用:0次
10 . 在容积为2L的恒容密闭容器中发生反应 ,图Ⅰ表示200℃时容器中A、B、C的物质的量随时间的变化关系,图Ⅱ表示不同温度下达到平衡时C的体积分数随起始
,图Ⅰ表示200℃时容器中A、B、C的物质的量随时间的变化关系,图Ⅱ表示不同温度下达到平衡时C的体积分数随起始 的变化关系,则下列结论正确的是
的变化关系,则下列结论正确的是

 ,图Ⅰ表示200℃时容器中A、B、C的物质的量随时间的变化关系,图Ⅱ表示不同温度下达到平衡时C的体积分数随起始
,图Ⅰ表示200℃时容器中A、B、C的物质的量随时间的变化关系,图Ⅱ表示不同温度下达到平衡时C的体积分数随起始 的变化关系,则下列结论正确的是
的变化关系,则下列结论正确的是
A.由图Ⅱ可知反应 的 的 ,且 ,且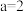 |
B.200℃时,反应从开始到平衡的平均速率 |
C.200℃时,向容器中充入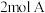 和 和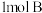 ,达到平衡时,A的体积分数等于0.5 ,达到平衡时,A的体积分数等于0.5 |
| D.若在图Ⅰ所示的平衡状态下,再向体系中充入He,重新达到平衡前v(正)<v(逆) |
您最近一年使用:0次