名校
解题方法
1 . 一定条件下发生反应2SO2(g)+O2(g) =2SO3(g),若SO2、O2、SO3的起始浓度分别为a mol/L、bmol/L、 cmol/L(均不为零),达到平衡状态时,SO2、O2、SO3浓度分别为0.18 mol/L、0.09 mol/L和0.2 mol/L,则下列判断错误的是
| A.a+c=0.38 |
| B.b的取值范围为:0<b<0.19 |
| C.平衡时,O2和SO3的生成速率之比为1:2 |
| D.起始时,消耗SO2的速率一定大于生成SO2的速率 |
您最近一年使用:0次
2 . 在恒温、恒容条件下发生下列反应:2X2O5(g) 4XO2(g) +O2(g)△H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g)△H>0,T温度下的部分实验数据为:
下列说法错误的是
 4XO2(g) +O2(g)△H>0,T温度下的部分实验数据为:
4XO2(g) +O2(g)△H>0,T温度下的部分实验数据为:| t/s | 0 | 50 | 100 | 150 |
| c(X2O5) mol/L | 4.00 | 2.50 | 2.00 | 2.00 |
| A.50s内X2O5分解速率为 0.03 mol/ (L•s) |
| B.T温度下的平衡常数为K=64 (mol/L)3,100s时转化率为50% |
| C.T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若T1>T2,则Kl>K2 |
| D.若只将恒容改为恒压,其它条件都不变,则平衡时X2O5的转化率和平衡常数都增大 |
您最近一年使用:0次
2024-03-24更新
|
102次组卷
|
2卷引用:湖北省荆州市沙市中学2023-2024学年高二下学期3月月考化学试题
3 .  、CO是常见的气体污染物,将其进行无害化处理是保护环境的重要举措。回答下列问题:
、CO是常见的气体污染物,将其进行无害化处理是保护环境的重要举措。回答下列问题:
(1)对于反应 来说,“
来说,“ ”可作为此反应的催化剂。其总反应分两步进行,第一步反应为
”可作为此反应的催化剂。其总反应分两步进行,第一步反应为 ,则第二步反应为
,则第二步反应为_____ 。已知第二步反应几乎不影响总反应达到平衡所用的时间,由此推知,第一步反应的活化能_____ (填“大于”或“小于”)第二步反应的活化能。
(2)在四个不同容积的恒容密闭容器中充入相应的气体,各气体的起始物质的量见下表。
发生反应: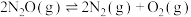 ,容器I、Ⅱ、Ⅲ中
,容器I、Ⅱ、Ⅲ中 的平衡转化率随温度变化的曲线如图所示。
的平衡转化率随温度变化的曲线如图所示。

①该反应为_____ (填“吸热”或“放热”)反应,容器I、Ⅱ、Ⅲ的容积由大到小的顺序为_____ (用I、Ⅱ、Ⅲ表示)。
②若容器I的体积为2L,反应在370℃下进行,10s后达到平衡,则0~10s内容器I中用 表示的反应速率为
表示的反应速率为_____  。B点对应的平衡常数
。B点对应的平衡常数
_____ (保留两位有效数字)。
③若容器Ⅳ的体积为1L,反应在370℃下进行,则起始时反应向_____ (填“正反应方向”或“逆反应方向”)进行。
 、CO是常见的气体污染物,将其进行无害化处理是保护环境的重要举措。回答下列问题:
、CO是常见的气体污染物,将其进行无害化处理是保护环境的重要举措。回答下列问题:(1)对于反应
 来说,“
来说,“ ”可作为此反应的催化剂。其总反应分两步进行,第一步反应为
”可作为此反应的催化剂。其总反应分两步进行,第一步反应为 ,则第二步反应为
,则第二步反应为(2)在四个不同容积的恒容密闭容器中充入相应的气体,各气体的起始物质的量见下表。
| 起始物质的量/mol 容器 |  |  |  |
| I | 0.1 | 0 | 0 |
| Ⅱ | 0.1 | 0 | 0 |
| Ⅲ | 0.1 | 0 | 0 |
| Ⅳ | 0.3 | 0.3 | 0.15 |
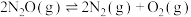 ,容器I、Ⅱ、Ⅲ中
,容器I、Ⅱ、Ⅲ中 的平衡转化率随温度变化的曲线如图所示。
的平衡转化率随温度变化的曲线如图所示。
①该反应为
②若容器I的体积为2L,反应在370℃下进行,10s后达到平衡,则0~10s内容器I中用
 表示的反应速率为
表示的反应速率为 。B点对应的平衡常数
。B点对应的平衡常数
③若容器Ⅳ的体积为1L,反应在370℃下进行,则起始时反应向
您最近一年使用:0次
4 . 向 溶液中通入过量
溶液中通入过量 ,过程和现象如图。
,过程和现象如图。
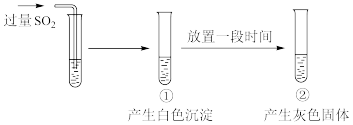
经检验,白色沉淀为 ;灰色固体中含有
;灰色固体中含有 。下列说法错误的是
。下列说法错误的是
 溶液中通入过量
溶液中通入过量 ,过程和现象如图。
,过程和现象如图。
经检验,白色沉淀为
 ;灰色固体中含有
;灰色固体中含有 。下列说法错误的是
。下列说法错误的是A.①中生成白色沉淀的离子方程式为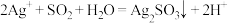 |
B.①中的白色沉淀不是 ,说明没有 ,说明没有 生成 生成 |
C.放置一段时间②中产生灰色固体是因为过量的 将部分 将部分 还原 还原 |
D.该实验条件下, 与 与 反应生成 反应生成 的速率大于生成 的速率大于生成 的速率 的速率 |
您最近一年使用:0次
5 . 草酸锰晶体(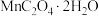 )是一种常见的化工产品,其在生产、生活中均有一定的运用。回答下列问题:
)是一种常见的化工产品,其在生产、生活中均有一定的运用。回答下列问题:
已知:①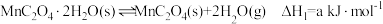
②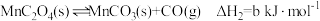
③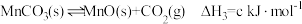
(1)
___________  。(用含a、b、c的代数式表示)
。(用含a、b、c的代数式表示)
(2)在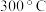 时,向密闭真空容器中加入足量
时,向密闭真空容器中加入足量 粉末,只发生反应③,达到平衡时测得
粉末,只发生反应③,达到平衡时测得 浓度为
浓度为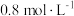 。保持温度不变,将容器体积变为原来的2倍并保持体积不变,达到新平衡时测得
。保持温度不变,将容器体积变为原来的2倍并保持体积不变,达到新平衡时测得 ,浓度等于___________(填标号)。
,浓度等于___________(填标号)。
(3)草酸锰在不同催化剂(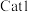 和
和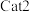 )作用下分解速率与温度的关系如图所示。已知:速率常数与温度的关系式为
)作用下分解速率与温度的关系如图所示。已知:速率常数与温度的关系式为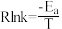 (
( 为活化能)。
为活化能)。___________ (填“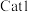 ”或“
”或“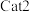 ”),判断的依据是
”),判断的依据是___________ 。
(4)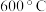 下,向恒容密闭容器中加入足量的
下,向恒容密闭容器中加入足量的 粉末及充入
粉末及充入 氧气,起始压强为
氧气,起始压强为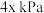 ,发生反应:
,发生反应:  ,经
,经 达到平衡,此时测得混合气体平均相对分子质量为41。
达到平衡,此时测得混合气体平均相对分子质量为41。
①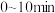 内O2分压变化率为
内O2分压变化率为___________ 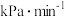 。
。
②此温度下,该反应的压强平衡常数
___________ 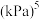 。
。
提示:用分压计算的平衡常数叫压强平衡常数 ,分压=总压×物质的量分数。
,分压=总压×物质的量分数。
(5)研究发现,碳酸盐 分解机理如下:①
分解机理如下:①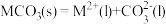 ,②
,②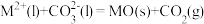 ,
,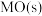 稳定性强弱决定
稳定性强弱决定 分解温度,即
分解温度,即 越稳定,越容易发生反应②,
越稳定,越容易发生反应②, 分解温度越低。已知:
分解温度越低。已知: 、
、 的半径依次为
的半径依次为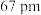 、
、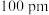 ,
, 、
、 的分解温度依次为
的分解温度依次为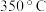 、
、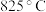 。试用结构理论解释
。试用结构理论解释 的分解温度远低于
的分解温度远低于 的原因:
的原因:___________ 。
(6)一定质量的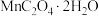 在空气中灼烧,固体质量与温度的关系如图。
在空气中灼烧,固体质量与温度的关系如图。___________ 。
②de段的化学方程式为___________ 。
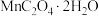 )是一种常见的化工产品,其在生产、生活中均有一定的运用。回答下列问题:
)是一种常见的化工产品,其在生产、生活中均有一定的运用。回答下列问题:已知:①
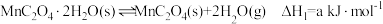
②
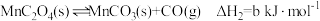
③
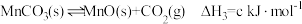
(1)

 。(用含a、b、c的代数式表示)
。(用含a、b、c的代数式表示)(2)在
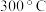 时,向密闭真空容器中加入足量
时,向密闭真空容器中加入足量 粉末,只发生反应③,达到平衡时测得
粉末,只发生反应③,达到平衡时测得 浓度为
浓度为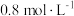 。保持温度不变,将容器体积变为原来的2倍并保持体积不变,达到新平衡时测得
。保持温度不变,将容器体积变为原来的2倍并保持体积不变,达到新平衡时测得 ,浓度等于___________(填标号)。
,浓度等于___________(填标号)。A.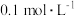 | B.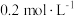 | C.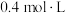 | D.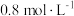 |
(3)草酸锰在不同催化剂(
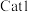 和
和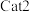 )作用下分解速率与温度的关系如图所示。已知:速率常数与温度的关系式为
)作用下分解速率与温度的关系如图所示。已知:速率常数与温度的关系式为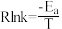 (
( 为活化能)。
为活化能)。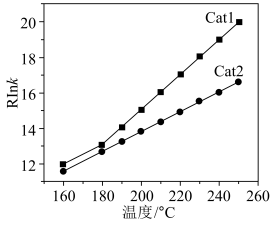
 ”或“
”或“ ”),判断的依据是
”),判断的依据是(4)
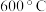 下,向恒容密闭容器中加入足量的
下,向恒容密闭容器中加入足量的 粉末及充入
粉末及充入 氧气,起始压强为
氧气,起始压强为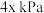 ,发生反应:
,发生反应:  ,经
,经 达到平衡,此时测得混合气体平均相对分子质量为41。
达到平衡,此时测得混合气体平均相对分子质量为41。①
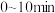 内O2分压变化率为
内O2分压变化率为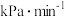 。
。②此温度下,该反应的压强平衡常数

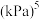 。
。提示:用分压计算的平衡常数叫压强平衡常数
 ,分压=总压×物质的量分数。
,分压=总压×物质的量分数。(5)研究发现,碳酸盐
 分解机理如下:①
分解机理如下:①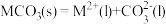 ,②
,②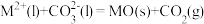 ,
,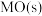 稳定性强弱决定
稳定性强弱决定 分解温度,即
分解温度,即 越稳定,越容易发生反应②,
越稳定,越容易发生反应②, 分解温度越低。已知:
分解温度越低。已知: 、
、 的半径依次为
的半径依次为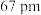 、
、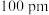 ,
, 、
、 的分解温度依次为
的分解温度依次为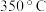 、
、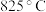 。试用结构理论解释
。试用结构理论解释 的分解温度远低于
的分解温度远低于 的原因:
的原因:(6)一定质量的
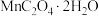 在空气中灼烧,固体质量与温度的关系如图。
在空气中灼烧,固体质量与温度的关系如图。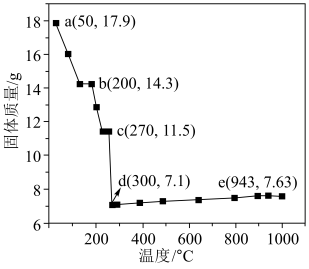
②de段的化学方程式为
您最近一年使用:0次
名校
解题方法
6 . 日常生活中常见的措施与化学反应速率也有密切的关系。下列措施中,其使用目的与速率无关的是
| A.夏天没有将牛奶放入冰箱中冷藏,易变质 | B.在月饼包装内放置抗氧化剂 |
| C.医疗上使用75%的酒精杀菌消毒 | D.用热水溶解食盐以加快溶解速率 |
您最近一年使用:0次
2024-02-19更新
|
215次组卷
|
3卷引用:湖北省武汉市新洲区第一中学2024届高二上学期期末联考化学试题
名校
解题方法
7 . I、II、III三个容积均为2L的恒容密闭容器中均投入1mol CO2 和3mol H2 ,在不同温度下发生反应:CO2(g) + 3H2⇌CH3OH(g) + H2O(g) 。反应10min,测得各容器内CO2的物质的量分别如图所示。下列说法正确的是
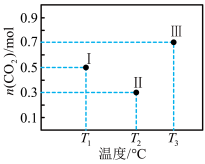

| A.升高温度、增大压强均有利于提高 H2的平衡转化率 |
| B.10min后,向容器Ⅲ中再加入1mol CO2 (g)和1mol H2O (g),此时反应逆向进行 |
| C.容器Ⅱ中的平均速率:v(CO2) =0.07 mol·L-1·min-1 |
| D.10min时,容器Ⅰ中 v(正) = v(逆) |
您最近一年使用:0次
8 . CH4重整技术对温室气体的减排具有重要意义,不仅能缓解大气变暖,对日益枯竭的石油资源也有一定的补充作用。体系内发生了如下反应:
反应Ⅰ:CH4(g) + H2O(g) CO(g) + 3H2(g)
CO(g) + 3H2(g)  = a kJ·mol-1
= a kJ·mol-1
反应Ⅱ: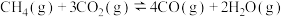
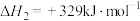
反应Ⅲ:_______。
(1)①断开(或形成) 化学键的能量变化数据如表中所示,则a=
化学键的能量变化数据如表中所示,则a=_______ 。
②反应Ⅲ是由反应Ⅱ中的生成物转化成H2和CO2,写出该反应的热化学方程式:_______ 。
(2)反应Ⅰ、反应Ⅱ、反应Ⅲ的平衡常数分别记作K1、K2、K3,,则K1=_______ (用含K2、K3,的表达式表达)
(3)T℃时,向2L恒容密闭容器中通入1mol CH4(g)和2mol H2O(g),仅发生反应Ⅰ,经过10min,反应达到平衡,此时c(CH4)=0.20 mol•L-1。
① 0~10min内,该反应的平均反应速率v(H2)=_______ 。
② 下列表述能说明该反应已达化学平衡状态的是_______ 。
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.反应速率v(CH4):v(H2)=1:3
D.断裂4mol C-H键的同时断裂3mol H-H键
(4)已知反应Ⅲ的正反应速率 v=k·c3(CO2) (k为正反应的速率常数),某温度时测得数据如表中所示。则此温度下表中b=_______ 。
反应Ⅰ:CH4(g) + H2O(g)
 CO(g) + 3H2(g)
CO(g) + 3H2(g)  = a kJ·mol-1
= a kJ·mol-1反应Ⅱ:
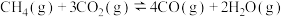
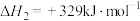
反应Ⅲ:_______。
(1)①断开(或形成)
 化学键的能量变化数据如表中所示,则a=
化学键的能量变化数据如表中所示,则a=| 化学键 | H-H | C-O | C=O | C≡O | C-H | O-H |
键能/ | 436 | 326 | 803 | 1072 | 414 | 465 |
(2)反应Ⅰ、反应Ⅱ、反应Ⅲ的平衡常数分别记作K1、K2、K3,,则K1=
(3)T℃时,向2L恒容密闭容器中通入1mol CH4(g)和2mol H2O(g),仅发生反应Ⅰ,经过10min,反应达到平衡,此时c(CH4)=0.20 mol•L-1。
① 0~10min内,该反应的平均反应速率v(H2)=
② 下列表述能说明该反应已达化学平衡状态的是
A.混合气体的密度不变
B.混合气体的平均相对分子质量不变
C.反应速率v(CH4):v(H2)=1:3
D.断裂4mol C-H键的同时断裂3mol H-H键
(4)已知反应Ⅲ的正反应速率 v=k·c3(CO2) (k为正反应的速率常数),某温度时测得数据如表中所示。则此温度下表中b=
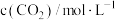 | 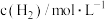 | 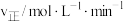 | |
| 1 | 0.01 | 0.01 |  |
| 2 | 0.02 | 0.01 | b |
您最近一年使用:0次
名校
9 . T℃时在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
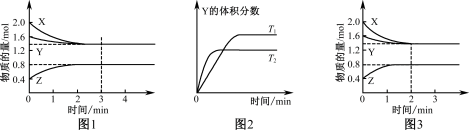

| A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol/(L·min) |
| B.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| C.保持温度和容器体积不变,4min时再向容器中充入2.0 mol X和1.6 mol Y及0.4 mol Z,达到平衡时,X的转化率增大 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强 |
您最近一年使用:0次
名校
解题方法
10 . 反应 ,分别向
,分别向 的密闭容器中通入
的密闭容器中通入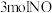 和一定量的
和一定量的 ,在不同温度下
,在不同温度下 的平衡转化率与投料比的关系如图所示。下列说法
的平衡转化率与投料比的关系如图所示。下列说法正确 的是

 ,分别向
,分别向 的密闭容器中通入
的密闭容器中通入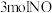 和一定量的
和一定量的 ,在不同温度下
,在不同温度下 的平衡转化率与投料比的关系如图所示。下列说法
的平衡转化率与投料比的关系如图所示。下列说法
| A.T1 < T2 |
| B.当容器内气体的密度不变时,说明反应达到平衡状态 |
C. 温度下,A点容器内的压强是反应开始时的0.8倍 温度下,A点容器内的压强是反应开始时的0.8倍 |
D. 温度下,反应开始至B点用时 温度下,反应开始至B点用时 , , 的平均反应速率 的平均反应速率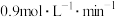 |
您最近一年使用:0次



