名校
1 . 按要求回答下列问题:
I.2018年10月15日新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101kPa时:①C(s)+ O2(g)=CO(g) ΔH=−126.4kJ∙mol−1
O2(g)=CO(g) ΔH=−126.4kJ∙mol−1
②2H2(g)+O2(g)=2H2O(l) ΔH=−571.6kJ∙mol−1
③H2O(g)=H2O(l) ΔH=−44kJ∙mol−1
则在25℃、101kPa时:C(s)和H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________ 。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)⇌Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。1100℃时测得高炉中,c(CO2)=0.025mol∙L−1,c(CO)=0.1mol∙L−1,则在这种情况下,该反应向___________ (填“正”或“逆”)方向进行。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=−49.0kJ∙mol−1,现向体积为2L的容积固定的密闭容器中,充入2molCO2和6molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如下图所示

从反应开始到平衡,氢气的平均反应速率υ(H2)=___________ 。
(4)下列措施能使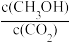 增大的是
增大的是___________ (填字母)。
A.升高温度
B.若维持容器内压强不变,充入He(g)
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
F.再充入H2
Ⅱ.活性炭还原NO2的反应为2NO2(g)+2C(s)⇌N2(g)+2CO2(g),在恒温条件下,1molNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
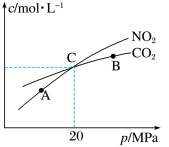
(5)A、B、C三点中NO2的转化率最低的是___________ (填“A”“B”或“C”)点。
(6)计算C点时该反应的物质的量分数平衡常数Kx=___________ (Kx是用物质的量分数代替平衡浓度计算的平衡常数)。
I.2018年10月15日新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101kPa时:①C(s)+
 O2(g)=CO(g) ΔH=−126.4kJ∙mol−1
O2(g)=CO(g) ΔH=−126.4kJ∙mol−1②2H2(g)+O2(g)=2H2O(l) ΔH=−571.6kJ∙mol−1
③H2O(g)=H2O(l) ΔH=−44kJ∙mol−1
则在25℃、101kPa时:C(s)和H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)⇌Fe(s)+CO2(g) ΔH>0。已知在1100℃时,该反应的化学平衡常数K=0.263。1100℃时测得高炉中,c(CO2)=0.025mol∙L−1,c(CO)=0.1mol∙L−1,则在这种情况下,该反应向
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) ΔH=−49.0kJ∙mol−1,现向体积为2L的容积固定的密闭容器中,充入2molCO2和6molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如下图所示

从反应开始到平衡,氢气的平均反应速率υ(H2)=
(4)下列措施能使
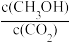 增大的是
增大的是A.升高温度
B.若维持容器内压强不变,充入He(g)
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
F.再充入H2
Ⅱ.活性炭还原NO2的反应为2NO2(g)+2C(s)⇌N2(g)+2CO2(g),在恒温条件下,1molNO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:

(5)A、B、C三点中NO2的转化率最低的是
(6)计算C点时该反应的物质的量分数平衡常数Kx=
您最近一年使用:0次
名校
解题方法
2 . 氨在能源、化肥生产等领域有着非常重要的用途。
(1)在一定条件下, 和
和 反应生成0.2mol
反应生成0.2mol ,放出9.24kJ的热量,写出该可逆反应的热化学方程式:
,放出9.24kJ的热量,写出该可逆反应的热化学方程式:___________ 。在下图中画出合成氨反应过程中焓(H)的变化示意图___________ 。

(2)将 和
和 通入体积为2L的恒温恒容密闭容器中5min后达到化学平衡,测得
通入体积为2L的恒温恒容密闭容器中5min后达到化学平衡,测得 的浓度为0.2mol/L,这段时间内用
的浓度为0.2mol/L,这段时间内用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为___________ mol/(L•min)。
(3)理论上,为了提高 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是___________ (写出一条即可)。
(4)下图是某压强下 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是___________ 。
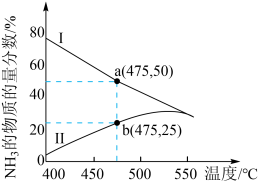
A.图中a点,容器内
B.图中b点,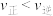
C.400~530℃,Ⅱ中 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
(5)在固定体积的密闭容器中,进行反应:
 其平衡常数K与温度T的关系如下表:
其平衡常数K与温度T的关系如下表:
①
___________  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
②一定温度下,在1L密闭容器中充入1mol 和3mol
和3mol 并发生反应,10min达到平衡时,气体的总物质的量变为原来的
并发生反应,10min达到平衡时,气体的总物质的量变为原来的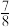 ,则
,则 的转化率
的转化率
___________ 。
(1)在一定条件下,
 和
和 反应生成0.2mol
反应生成0.2mol ,放出9.24kJ的热量,写出该可逆反应的热化学方程式:
,放出9.24kJ的热量,写出该可逆反应的热化学方程式:
(2)将
 和
和 通入体积为2L的恒温恒容密闭容器中5min后达到化学平衡,测得
通入体积为2L的恒温恒容密闭容器中5min后达到化学平衡,测得 的浓度为0.2mol/L,这段时间内用
的浓度为0.2mol/L,这段时间内用 的浓度变化表示的反应速率为
的浓度变化表示的反应速率为(3)理论上,为了提高
 的平衡转化率,可以采取的措施是
的平衡转化率,可以采取的措施是(4)下图是某压强下
 和
和 按物质的量之比1∶3投料进行反应,反应混合物中
按物质的量之比1∶3投料进行反应,反应混合物中 的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
的物质的量分数随温度的变化曲线。Ⅰ是平衡时的曲线,Ⅱ是不同温度下反应经过相同时间测得的曲线,下列说法正确的是
A.图中a点,容器内

B.图中b点,
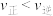
C.400~530℃,Ⅱ中
 的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大
的物质的量分数随温度升高而增大,原因是升高温度化学反应速率增大(5)在固定体积的密闭容器中,进行反应:

 其平衡常数K与温度T的关系如下表:
其平衡常数K与温度T的关系如下表:| T/K | 298 | 398 | 498 |
| 平衡常数K | 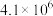 |  |  |

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。②一定温度下,在1L密闭容器中充入1mol
 和3mol
和3mol 并发生反应,10min达到平衡时,气体的总物质的量变为原来的
并发生反应,10min达到平衡时,气体的总物质的量变为原来的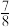 ,则
,则 的转化率
的转化率
您最近一年使用:0次
3 . 硫、氮是化工生产中的重要非金属元素,铁是生活中重要的金属元素。回答下列相关问题。
(1)硫在元素周期表中的位置为_____ , 失去一个氢原子剩余的部分为甲基(
失去一个氢原子剩余的部分为甲基(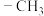 ),
), 失去一个氢原子剩余的部分为氨基(
失去一个氢原子剩余的部分为氨基(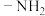 ),写出氨基的电子式
),写出氨基的电子式_____ 。
(2)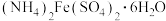 是一种重要的化工原料,用途十分广泛。一般从废铁屑中回收制备,铁屑经碱溶液洗净之后,用过量硫酸溶解。再加入稍过量硫酸铵饱和溶液,小火下蒸发溶剂直到晶膜出现,
是一种重要的化工原料,用途十分广泛。一般从废铁屑中回收制备,铁屑经碱溶液洗净之后,用过量硫酸溶解。再加入稍过量硫酸铵饱和溶液,小火下蒸发溶剂直到晶膜出现,_____ 、_____ 、用少量乙醇洗涤。(填写实验操作)
(3)在400℃时,将一定量的 和14mol
和14mol  充入一个盛有催化剂的10L恒容密闭容器中进行反应:
充入一个盛有催化剂的10L恒容密闭容器中进行反应: ,已知2min后,容器中剩余2mol
,已知2min后,容器中剩余2mol  和12mol
和12mol  ,则:
,则:
①2min内平均反应速率: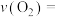
_____ 。
②发生反应前容器内压强与发生反应后容器中压强比值为_____ 。
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池放电时的总反应式为 ,则该电池放电时负极反应式为
,则该电池放电时负极反应式为_____ ,_____ (填“正”或“负”)极附近溶液的碱性增强。
(5)向100mL某硝酸和硫酸的混合稀溶液中加入5.04g铁粉,恰好完全反应,只收集到一种气体,溶液中只存在一种盐,溶液取样加入硫氰化钾无血红色,则原溶液中硫酸的物质的量浓度为_____ 。
(1)硫在元素周期表中的位置为
 失去一个氢原子剩余的部分为甲基(
失去一个氢原子剩余的部分为甲基(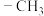 ),
), 失去一个氢原子剩余的部分为氨基(
失去一个氢原子剩余的部分为氨基(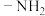 ),写出氨基的电子式
),写出氨基的电子式(2)
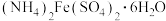 是一种重要的化工原料,用途十分广泛。一般从废铁屑中回收制备,铁屑经碱溶液洗净之后,用过量硫酸溶解。再加入稍过量硫酸铵饱和溶液,小火下蒸发溶剂直到晶膜出现,
是一种重要的化工原料,用途十分广泛。一般从废铁屑中回收制备,铁屑经碱溶液洗净之后,用过量硫酸溶解。再加入稍过量硫酸铵饱和溶液,小火下蒸发溶剂直到晶膜出现,(3)在400℃时,将一定量的
 和14mol
和14mol  充入一个盛有催化剂的10L恒容密闭容器中进行反应:
充入一个盛有催化剂的10L恒容密闭容器中进行反应: ,已知2min后,容器中剩余2mol
,已知2min后,容器中剩余2mol  和12mol
和12mol  ,则:
,则:①2min内平均反应速率:
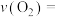
②发生反应前容器内压强与发生反应后容器中压强比值为
(4)高铁电池是一种新型可充电电池,与普通电池相比,该电池能较长时间保持稳定的放电电压。高铁电池放电时的总反应式为
 ,则该电池放电时负极反应式为
,则该电池放电时负极反应式为(5)向100mL某硝酸和硫酸的混合稀溶液中加入5.04g铁粉,恰好完全反应,只收集到一种气体,溶液中只存在一种盐,溶液取样加入硫氰化钾无血红色,则原溶液中硫酸的物质的量浓度为
您最近一年使用:0次
名校
解题方法
4 . 氨气是重要的化工原料,常用于制取硝酸、铵盐等物质。回答下列问题:
Ⅰ.氨气的催化氧化反应是制备硝酸的重要步骤之一: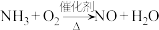 (未配平)
(未配平)
(1)液氨的用途为_______ (任写1个):配平上述反应方程式:_______
Ⅱ.工业上用合成氨的方法制取氨气. 时,向
时,向 恒容密闭容器内充入
恒容密闭容器内充入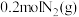 和
和 ,发生反应:
,发生反应: 。容器内
。容器内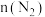 随时间的变化如表:
随时间的变化如表:
(2)容器内压强不变时,可以判断反应已经达到平衡状态的原因是_______ ;平衡时, 的转化率为
的转化率为_______ 。
(3)用 表示从
表示从 内该反应的平均速率
内该反应的平均速率
_______  ;
; 时,向容器中充入少量
时,向容器中充入少量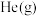 ,化学反应速率不变的原因是
,化学反应速率不变的原因是_______
(4) 时,在四个体积均为
时,在四个体积均为 的密闭容器中以不同投料进行合成氨反应。根据相同时间内测定的结果,反应速率最快的是_______(填字母)
的密闭容器中以不同投料进行合成氨反应。根据相同时间内测定的结果,反应速率最快的是_______(填字母)
Ⅰ.氨气的催化氧化反应是制备硝酸的重要步骤之一:
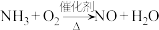 (未配平)
(未配平)(1)液氨的用途为
Ⅱ.工业上用合成氨的方法制取氨气.
 时,向
时,向 恒容密闭容器内充入
恒容密闭容器内充入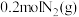 和
和 ,发生反应:
,发生反应: 。容器内
。容器内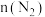 随时间的变化如表:
随时间的变化如表:时间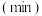 | 0 | 1 | 2 | 3 | 4 | 5 |
 的物质的量 的物质的量 | 0.20 | 0.17 | 0.16 | 0.15 | 0.15 | 0.15 |
 的转化率为
的转化率为(3)用
 表示从
表示从 内该反应的平均速率
内该反应的平均速率
 ;
; 时,向容器中充入少量
时,向容器中充入少量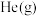 ,化学反应速率不变的原因是
,化学反应速率不变的原因是(4)
 时,在四个体积均为
时,在四个体积均为 的密闭容器中以不同投料进行合成氨反应。根据相同时间内测定的结果,反应速率最快的是_______(填字母)
的密闭容器中以不同投料进行合成氨反应。根据相同时间内测定的结果,反应速率最快的是_______(填字母)A. | B.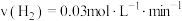 |
C.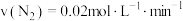 | D.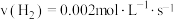 |
您最近一年使用:0次
2023-04-29更新
|
224次组卷
|
2卷引用:河南省开封市五县2022-2023学年高一下学期期中考试化学试题
名校
解题方法
5 . 甲醇 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: 。测得
。测得 和
和 的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
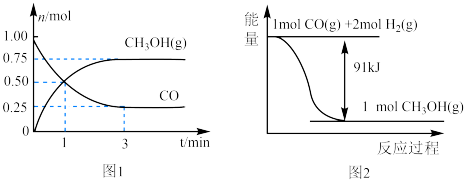
(1)从反应开始至达到平衡,以CO表示的反应的平均反应速率
_____ ;能说明该反应已经达到平衡状态的是_____ 。
a.
b.容器内压强保持不变
c.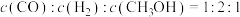
d.容器内的密度保持不变
e.容器内混合气体平均分子质量不变
(2)反应达到平衡状态时 的转化率为
的转化率为_____ ,该条件下此反应的平衡常数为_____ 。
(3)根据图2,计算当反应生成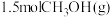 时,能量变化值是
时,能量变化值是_____ kJ。
 是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入
是一种重要的化工原料,在生产生活中有重要用途。现在2L的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: 。测得
。测得 和
和 的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
的物质的量变化如图1所示。反应过程中按图所给物质的量的能量变化如图2所示。
(1)从反应开始至达到平衡,以CO表示的反应的平均反应速率

a.

b.容器内压强保持不变
c.
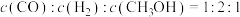
d.容器内的密度保持不变
e.容器内混合气体平均分子质量不变
(2)反应达到平衡状态时
 的转化率为
的转化率为(3)根据图2,计算当反应生成
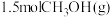 时,能量变化值是
时,能量变化值是
您最近一年使用:0次
2023高一下·浙江杭州·期中
6 . CH3OH是无色有刺激性气味的液体,在生产生活中有重要用途,同时也是一种重要的化工原料。
(1)已知CH3OH(g)+ O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是___________ (填字母)。
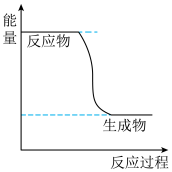
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.H2的生成速率与CH3OH的消耗速率之比为1
(2)化学键的键能如表所示,若1molCH3OH(g)完全转化为1molCO2(g)和2molH2(g),放出能量___________ kJ。
(3)某温度下,将10molCH3OH和4molO2充入2L的密闭容器中,经过5min反应达到平衡,测得c(O2)=0.4mol/L,5min内平均反应速率v(H2)=________ ,则CH3OH的转化率为_________ 。
(4)CH3OH燃料电池是目前较成熟的燃料电池之一,由甲醇、空气(氧气)、KOH(电解质溶液)构成其中负极反应式为CH3OH+8OH--6e-= +6H2O,则电池放电时通入空气的电极反应式为
+6H2O,则电池放电时通入空气的电极反应式为___________ ,电池放电时,电解质溶液的碱性逐渐___________ (填“增加“减小”或“不变”)若线路中转移0.2mol电子,则消耗的O2在标准状况下的体积为___________ L。
(5)工业上可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g),在体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。
①下列叙述中能说明上述反应达到平衡状态的是___________ 。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.CH3OH的质量分数在混合气体中保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
②若已知生成2.24LCH3OH(g)(已折算为标准状况下)时放出热量为4.9kJ,固定的密闭容器中投入1molCO和2molH2气体充分反应实际放热总量小于49kJ其原因是___________ 。
③下列措施不使提高反应速率的是___________ 。
A.升高温度
B.选择高效催化剂
C.向容器中充入一定量的氩气增大体系压强
D.及时分离出甲醇
(1)已知CH3OH(g)+
 O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
O2(g)⇌CO2(g)+2H2(g)的能量变化如图所示,下列说法正确的是
a.CH3OH转变成H2的过程是一个吸收能量的过程
b.1molH-O键断裂的同时2molC=O键断裂,则反应达最大限度
c.化学变化不仅有新物质生成,同时也一定有能量变化
d.H2的生成速率与CH3OH的消耗速率之比为1
(2)化学键的键能如表所示,若1molCH3OH(g)完全转化为1molCO2(g)和2molH2(g),放出能量
| 化学键 | C一H | C一O | O一H | O=O | C=O | H一H |
| 键能/kJ | 44 | 360 | 464 | 498 | 799 | 416 |
(4)CH3OH燃料电池是目前较成熟的燃料电池之一,由甲醇、空气(氧气)、KOH(电解质溶液)构成其中负极反应式为CH3OH+8OH--6e-=
 +6H2O,则电池放电时通入空气的电极反应式为
+6H2O,则电池放电时通入空气的电极反应式为(5)工业上可以用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)⇌CH3OH(g),在体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。
①下列叙述中能说明上述反应达到平衡状态的是
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.CH3OH的质量分数在混合气体中保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量不再改变
②若已知生成2.24LCH3OH(g)(已折算为标准状况下)时放出热量为4.9kJ,固定的密闭容器中投入1molCO和2molH2气体充分反应实际放热总量小于49kJ其原因是
③下列措施不使提高反应速率的是
A.升高温度
B.选择高效催化剂
C.向容器中充入一定量的氩气增大体系压强
D.及时分离出甲醇
您最近一年使用:0次
名校
解题方法
7 . 甲醇是一种重要的有机化工原料,可通过煤间接液化的方法制备,用途广泛。
I.一定温度下,在10L的恒容密闭容器中充入 和
和 ,一定条件下发生反应:
,一定条件下发生反应: ,2min时达到平衡状态,并测得容器内气体的总压强为初始压强的0.6倍,该反应过程中的能量变化如图所示。
,2min时达到平衡状态,并测得容器内气体的总压强为初始压强的0.6倍,该反应过程中的能量变化如图所示。
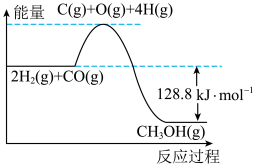
(1)已知断开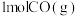 和
和 中的化学键需要吸收的能量为
中的化学键需要吸收的能量为 ,则断开
,则断开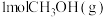 中的化学键需要吸收
中的化学键需要吸收___________  能量。
能量。
(2)从反应开始至达到平衡,以CO表示该反应的平均反应速率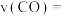
___________ 。
(3)下列描述能说明上述达到平衡状态的是___________ (填字母)。
A.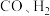 和
和 三种物质的浓度相等
三种物质的浓度相等
B.密闭容器中混合气体的密度不随时间的变化而变化
C.密闭容器中混合气体的压强不随时间的变化而变化
D.密闭容器中混合气体的平均相对分子质量不随时间的变化而变化
E.单位时间内消耗 的同时生成
的同时生成
(4)平衡时 的转化率为
的转化率为___________ (写百分数,保留2位有效数字)。
Ⅱ.甲醇燃料电池能量利用率高,且符合绿色化学理念。若以酸性溶液做电解质溶液:
(5) 应通入
应通入___________ 极(填“正”或“负”),
(6)写出甲醇所在电极的反应式:___________ 。
I.一定温度下,在10L的恒容密闭容器中充入
 和
和 ,一定条件下发生反应:
,一定条件下发生反应: ,2min时达到平衡状态,并测得容器内气体的总压强为初始压强的0.6倍,该反应过程中的能量变化如图所示。
,2min时达到平衡状态,并测得容器内气体的总压强为初始压强的0.6倍,该反应过程中的能量变化如图所示。
(1)已知断开
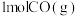 和
和 中的化学键需要吸收的能量为
中的化学键需要吸收的能量为 ,则断开
,则断开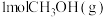 中的化学键需要吸收
中的化学键需要吸收 能量。
能量。(2)从反应开始至达到平衡,以CO表示该反应的平均反应速率
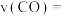
(3)下列描述能说明上述达到平衡状态的是
A.
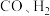 和
和 三种物质的浓度相等
三种物质的浓度相等B.密闭容器中混合气体的密度不随时间的变化而变化
C.密闭容器中混合气体的压强不随时间的变化而变化
D.密闭容器中混合气体的平均相对分子质量不随时间的变化而变化
E.单位时间内消耗
 的同时生成
的同时生成
(4)平衡时
 的转化率为
的转化率为Ⅱ.甲醇燃料电池能量利用率高,且符合绿色化学理念。若以酸性溶液做电解质溶液:
(5)
 应通入
应通入(6)写出甲醇所在电极的反应式:
您最近一年使用:0次
解题方法
8 . 氮的化合物被广泛应用于工业、航天和医药等领域。请回答下而有关氮的化合物的问题:
(1)一定温度下,在体积为2L的恒容密闭容器中发生 、
、 两种气体间的转化反应,
两种气体间的转化反应, 、
、 的物质的量随时间的变化情况如图所示。
的物质的量随时间的变化情况如图所示。

①该反应___________ (填“是”或“不是”)可逆反应;判断的依据是___________ 。
②该反应的化学方程式为___________ 。
③4min时,
___________  (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。
④若要增大该反应的速率,可采用的措施有___________ (写两条)。
⑤反应从始至7min时,用 表示的反应平均速率为
表示的反应平均速率为___________ 。
(2)肼( )具有强还原性,在工业上有广泛的用途,液态肼、空气、KOH溶液构成的燃料电池装置如下图所示:
)具有强还原性,在工业上有广泛的用途,液态肼、空气、KOH溶液构成的燃料电池装置如下图所示:

①b电极是电池的___________ (填“负”或“正”)极。
②放电时,电子的流动方向是___________ 。
③该电池的负极反应式为___________ 。
(1)一定温度下,在体积为2L的恒容密闭容器中发生
 、
、 两种气体间的转化反应,
两种气体间的转化反应, 、
、 的物质的量随时间的变化情况如图所示。
的物质的量随时间的变化情况如图所示。
①该反应
②该反应的化学方程式为
③4min时,

 (填“大于”“等于”或“小于”)。
(填“大于”“等于”或“小于”)。④若要增大该反应的速率,可采用的措施有
⑤反应从始至7min时,用
 表示的反应平均速率为
表示的反应平均速率为(2)肼(
 )具有强还原性,在工业上有广泛的用途,液态肼、空气、KOH溶液构成的燃料电池装置如下图所示:
)具有强还原性,在工业上有广泛的用途,液态肼、空气、KOH溶液构成的燃料电池装置如下图所示:
①b电极是电池的
②放电时,电子的流动方向是
③该电池的负极反应式为
您最近一年使用:0次
解题方法
9 . 亚氯酸及其盐类在工业生产和环境治理等方面用途非常广泛。
(1)已知:
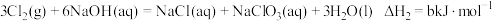
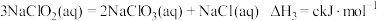
则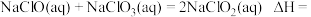
________  (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。
(2) 时,测得
时,测得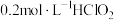 溶液的
溶液的 为1.4,则该温度下
为1.4,则该温度下 的电离常数为
的电离常数为___________ (已知 )。
)。
(3)工业上可用电解法制备 ,其工作原理如图所示(
,其工作原理如图所示( 足量),电解一段时间后,将
足量),电解一段时间后,将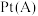 电极区的溶液除去微量二氧化氯后,喷雾干燥即得
电极区的溶液除去微量二氧化氯后,喷雾干燥即得 粗品。
粗品。

离子交换膜应选择___________ (填“阴”或“阳”)离子交换膜;当 电极区的溶液质量减少
电极区的溶液质量减少 时,理论上通入
时,理论上通入 的质量不少于
的质量不少于___________ g(用含a的代数式表示,计算结果保留三位有效数字)。
(4)以 为氧化剂是一种新型脱除
为氧化剂是一种新型脱除 的方法,其原理如下:
的方法,其原理如下:
第一步: 在碱性环境中被氧化为
在碱性环境中被氧化为 ,反应为
,反应为 ;
;
第二步: 继续被氧化为
继续被氧化为 ,反应为
,反应为 。
。
① 溶液吸收
溶液吸收 的过程中,适当增大压强,对
的过程中,适当增大压强,对 的脱除率的影响是
的脱除率的影响是___________ (填“升高”“无影响”或“降低”)。
② 时,将
时,将 匀速通过足量浓度为
匀速通过足量浓度为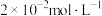 的
的 碱性溶液,
碱性溶液, 后测得溶液中
后测得溶液中 浓度为
浓度为 ,则
,则 内平均反应速率
内平均反应速率
___________ (溶液的体积变化忽略不计)。
(1)已知:

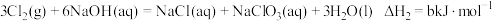
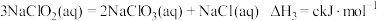
则
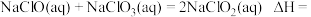
 (用含a、b、c的式子表示)。
(用含a、b、c的式子表示)。(2)
 时,测得
时,测得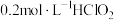 溶液的
溶液的 为1.4,则该温度下
为1.4,则该温度下 的电离常数为
的电离常数为 )。
)。(3)工业上可用电解法制备
 ,其工作原理如图所示(
,其工作原理如图所示( 足量),电解一段时间后,将
足量),电解一段时间后,将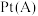 电极区的溶液除去微量二氧化氯后,喷雾干燥即得
电极区的溶液除去微量二氧化氯后,喷雾干燥即得 粗品。
粗品。
离子交换膜应选择
 电极区的溶液质量减少
电极区的溶液质量减少 时,理论上通入
时,理论上通入 的质量不少于
的质量不少于(4)以
 为氧化剂是一种新型脱除
为氧化剂是一种新型脱除 的方法,其原理如下:
的方法,其原理如下:第一步:
 在碱性环境中被氧化为
在碱性环境中被氧化为 ,反应为
,反应为 ;
;第二步:
 继续被氧化为
继续被氧化为 ,反应为
,反应为 。
。①
 溶液吸收
溶液吸收 的过程中,适当增大压强,对
的过程中,适当增大压强,对 的脱除率的影响是
的脱除率的影响是②
 时,将
时,将 匀速通过足量浓度为
匀速通过足量浓度为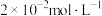 的
的 碱性溶液,
碱性溶液, 后测得溶液中
后测得溶液中 浓度为
浓度为 ,则
,则 内平均反应速率
内平均反应速率
您最近一年使用:0次
名校
10 . 近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,n(CO)和n(H2)按1:2 充入。在400 ℃时发生反应CO(g)+2H2(g) CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:
(1)图甲中表示CH3OH的变化的曲线是_______ (填序号)。
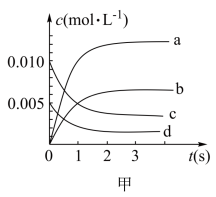
(2)此反应在前2s,H2 的反应速率是_______
(3)下列措施不能提高反应速率的有_______(填序号)。
(4)下列叙述能说明反应达到平衡状态的是_______ (填序号)。
a.CO和H2的浓度保持不变
b.v(H2)=2v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1 mol CH3OH的同时有2 mol H-H键断裂
(5)CO(g)+2H2(g) CH3OH(g),此反应的平衡常数的表达式为:
CH3OH(g),此反应的平衡常数的表达式为:_____
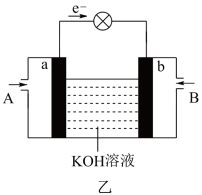
(6)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图乙所示,图中CH3OH从_______ (填“A”或“B”)处通入。
 CH3OH(g),体系中n(CO)随时间的变化如表:
CH3OH(g),体系中n(CO)随时间的变化如表:| 时间(s) | 0 | 1 | 2 | 3 | 5 |
| n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |

(2)此反应在前2s,H2 的反应速率是
(3)下列措施不能提高反应速率的有_______(填序号)。
| A.升高温度 |
| B.加入催化剂 |
| C.增大压强 |
| D.及时分离出CH3OH |
a.CO和H2的浓度保持不变
b.v(H2)=2v(CO)
c.CO的物质的量分数保持不变
d.容器内气体密度保持不变
e.每生成1 mol CH3OH的同时有2 mol H-H键断裂
(5)CO(g)+2H2(g)
 CH3OH(g),此反应的平衡常数的表达式为:
CH3OH(g),此反应的平衡常数的表达式为:(6)CH3OH与O2的反应可将化学能转化为电能,其工作原理如图乙所示,图中CH3OH从

您最近一年使用:0次



