解题方法
1 . 测量司机是否酒后驾驶的反应原理为:3C2H5OH+2CrO3+3H2SO4=3CH3CHO+Cr2(SO4)3+6H2O请回答下列问题:
(1)该反应涉及元素中,基态原子核外未成对电子数最多的元素在元素周期表中的位置为___________ ,价电子排布式___________ 。
(2)对于Cr2(SO4)3的组成元素,电负性从小到大的顺序为___________ 。(用元素符号表示)
(3)HOCH2CN的结构简式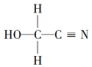 ,该分子中碳原子轨道的杂化类型分别是
,该分子中碳原子轨道的杂化类型分别是___________ 和___________ 。
(4)将CrCl3·6H2O溶解在适量水中,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在,[Cr(H2O)5Cl]2+中含有σ键的数目为___________ ;
(1)该反应涉及元素中,基态原子核外未成对电子数最多的元素在元素周期表中的位置为
(2)对于Cr2(SO4)3的组成元素,电负性从小到大的顺序为
(3)HOCH2CN的结构简式
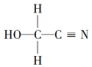 ,该分子中碳原子轨道的杂化类型分别是
,该分子中碳原子轨道的杂化类型分别是(4)将CrCl3·6H2O溶解在适量水中,溶液中Cr3+以[Cr(H2O)5Cl]2+形式存在,[Cr(H2O)5Cl]2+中含有σ键的数目为
您最近一年使用:0次
名校
解题方法
2 . 下列有关化学用语表述或性质比较正确的是
A.基态氧原子核外价电子排布轨道表示式 |
| B.磷化铜(Cu3P2)用于制造磷青铜,电负性:Cu<P |
C.用原子轨道描述氢分子中化学键的形成: |
D.在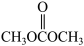 分子中, C 原子和O 原子均为 sp3杂化 分子中, C 原子和O 原子均为 sp3杂化 |
您最近一年使用:0次
2021-04-05更新
|
751次组卷
|
6卷引用:福建省南平市高级中学2022-2023学年高二下学期期中考试化学试题
3 . 二氟化二氧(O2F2)是一种极强的氧化剂和氟化剂,可以发生反应:H2S+4O2F2=SF6+2HF+4O2。下列有关说法不正确的是
| A.还原性:H2S>HF |
| B.离子半径:S2->O2->F- |
| C.上述反应中被还原的元素的基态原子的成对电子个数为4 |
D.上述反应的四种元素中电负性最强的元素的基态原子价层电子排布图为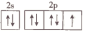 |
您最近一年使用:0次
2021-03-17更新
|
309次组卷
|
4卷引用:福建省建瓯市芝华中学2023-2024学年高二下学期第一次阶段考试化学试题
名校
解题方法
4 . 我国科学家团队采用自激发缺陷诱导的方法获得白光,合成了首例缺陷诱导的晶态无机硼酸盐单一组分白光材料Ba2[Sn(OH)6][B(OH)4]2。
(1)基态50Sn原子的价电子排布式为______ 。Ba、Sn、O三种元素的电负性由大到小的顺序为______ 。
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为______ ;硼砂中存在的作用力有______ (填标号)。
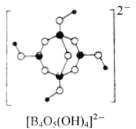
a.氢键 b.离子键 c.共价键 d.配位键
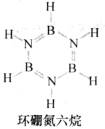
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是______ 。
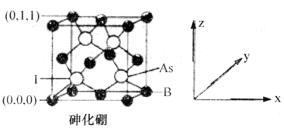
(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为______ 。已知阿伏加德罗常数的值为NA,若晶胞中As原子到B原子最近距离为a pm,则该晶体的密度为______ g·cm-3。(列出含a、NA的计算式即可)。
(1)基态50Sn原子的价电子排布式为
(2)Na2[B4O5(OH)4]·8H2O(硼砂)的阴离子的结构式如图所示。则硼原子的杂化方式为

a.氢键 b.离子键 c.共价键 d.配位键
(3)环硼氮六烷(结构如图)在热水中比冷水中溶解度显著增大的主要原因是

(4)超高热导率半导体材料——砷化硼(BAs)的晶胞结构如图所示,则1号砷原子的坐标为

您最近一年使用:0次
2021-02-04更新
|
274次组卷
|
2卷引用:福建省厦门双十中学2022-2023学年高三上学期期中考试化学试题
5 . 现有两种元素的基态原子的电子排布式如下:
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
① 1s22s22p63s23p4 ② 1s22s22p63s23p3 。则下列有关比较中正确的是
| A.未成对电子数:①>② | B.原子半径大小:①>② |
| C.电负性大小:②>① | D.第一电离能大小:②>① |
您最近一年使用:0次
2021-01-29更新
|
206次组卷
|
3卷引用:福建省三明市四地四校2021-2022学年高二下学期期中联考化学试题
解题方法
6 . A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: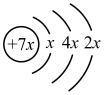 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________ ,碱性最强的是_________ 。
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是__________ ,电负性最大的元素是__________ 。
(3)D的氢化物比C的氢化物的沸点高,原因____________________ 。
(4)E元素在周期表的第_______ 周期,第________ 族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______ 区。
(5)B、C最高价氧化物的晶体类型是分别是______ 晶体、______ 晶体
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:(1)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是
(2)用元素符号表示D所在周期(除稀有气体元素外)第一电离能最大的元素是
(3)D的氢化物比C的氢化物的沸点高,原因
(4)E元素在周期表的第
(5)B、C最高价氧化物的晶体类型是分别是
您最近一年使用:0次
名校
解题方法
7 . 下列说法中错误的是
| A.SO2、SO3都是极性分子 |
B.在 和[Cu(NH3)4]2+中都存在配位键 和[Cu(NH3)4]2+中都存在配位键 |
| C.元素电负性越大的原子,吸引电子的能力越强 |
| D.CO可以和很多金属形成配合物,如Ni(CO)2,Ni与CO之间的键型为配位键 |
您最近一年使用:0次
8 . 以下有关元素性质的说法不正确的是( )
| A.具有下列电子排布式的原子中:①1s22s22p63s23p2,②1s22s22p3,③1s22s22p2,④1s22s22p63s23p4,原子半径最大的是① |
| B.下列价电子排布式的原子中:①3s23p1,②3s23p2,③3s23p3,④3s23p4,第一电离能最大的是③ |
| C.①Na、K、Rb,②N、P、As,③O、S、Se,④Na、P、Cl中,元素的电负性随原子序数增大而递增的是④ |
| D.某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
您最近一年使用:0次
2020-08-21更新
|
1220次组卷
|
37卷引用:福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题
福建省建瓯市芝华中学2021-2022学年高二下学期第一次阶段考化学试题福建省建瓯市芝华中学2023-2024学年高二下学期第一次阶段考试化学试题(已下线)2010-2011学年江西省新建二中高二下学期期末考试化学试卷(已下线)2014年高考化学苏教版总复习 12-1 原子结构与元素的性质练习卷2015-2016学年辽宁省沈阳二中高二下期中化学试卷黑龙江省牡丹江市第一高级中学2016-2017学年高二下学期期中考试化学试题山西省怀仁县第一中学2016-2017学年高二下学期第三次(5月)月考化学试题河南省洛阳名校2017-2018学年高二上学期第二次联考化学试题【全国百强校】黑龙江省实验中学2017-2018学年高二下学期期中考试(理)化学试题山西省沁县中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】吉林省延边第二中学2018-2019学年高二下学期第一次月考化学试题【全国百强校】黑龙江省牡丹江市第一高级中学2018-2019学年高二下学期期中考试化学试题吉林省白山市第七中学2018-2019学年高二下学期期中考试化学试题(已下线)2019年6月16日 《每日一题》选修3-每周一测甘肃省临泽一中2018-2019学年高二下学期期末模拟化学试题(已下线)2019年11月22日 《每日一题》2020年高考化学一轮复习——电离能和电负性江苏省南京师范大学苏州实验学校2019-2020学年高二上学期期中考试化学试题(已下线)专题11.3 晶体结构与性质(练)-《2020年高考一轮复习讲练测》辽宁省实验中学东戴河分校2019-2020学年高二12月月考化学试题2020届高三化学二轮物质结构题型专攻——元素性质的递变规律【选择基础专练】第1章 原子结构——B拓展区综合拓展(鲁科版选修3)甘肃省静宁县第一中学2019-2020学年高二下学期期中考试(第二次月考)化学试题(普通班)辽宁省大连市大连海湾高级中学2019-2020学年高二下学期第一次质量检测化学试题山东省潍坊昌乐县第二中学2020届高三上学期期末化学模拟试题二(已下线)山东省邹城市2018-2019学年高二上学期12月月考化学试卷(人教版2019)选择性必修2 第一章 原子结构与性质 综合检测卷鲁科版2019选择性必修2第1章综合检测卷高二选择性必修2(人教版2019)第一章 原子结构与性质 第二节综合训练(已下线)第一单元 原子结构(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)河南省开封市五县2020-2021学年高二下学期月考化学试题四川省汉源县第二中学2019-2020学年高二下学期第二次月考化学试题安徽省六安第一中学2021-2022学年高二上学期期末考试化学试题第二节 原子结构与元素的性质 第2课时 元素周期律——原子半径、电离能、电负性的递变规律四川省绵阳中学2022-2023学年高二上学期第一次月考化学试题河南省焦作市第一中学2022-2023学年高二下学期3月份教学质量检测 化学试题山东省青岛一中2023-2024学年高一下学期4月月考化学试卷新疆乌鲁木齐市第三十一中学2023-2024学年高二下学期3月月考 化学试题
9 . 现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素;D元素核外有三个电子层,最外层电子数是核外电子总数的1/6 ;E元素正三价离子的3d轨道为半充满状态;F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)G的元素名称为____________ 。
(2)A、B、C三种元素电负性由大到小的顺序为_____________ (用元素符号表示),第一电离能D______ Al(填“>”“<”或“=”),其原因是______________________ 。
(3)E3+的离子符号为________________ 。
(4)F元素基态原子的电子排布式为________________ 。
(5)G元素可能的性质_______________ 。
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小
(1)G的元素名称为
(2)A、B、C三种元素电负性由大到小的顺序为
(3)E3+的离子符号为
(4)F元素基态原子的电子排布式为
(5)G元素可能的性质
A.其单质可作为半导体材料 B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸 D.其第一电离能小
您最近一年使用:0次
2020-08-08更新
|
126次组卷
|
2卷引用:福建省三明第一中学2019-2020学年高二下学期期中考试化学试题
名校
解题方法
10 . 不能说明X的电负性比Y的大的是
| A.X原子的最外层电子数比Y原子的最外层电子数多 |
| B.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
| C.与H2化合时X单质比Y单质容易 |
| D.X单质可以把Y从其氢化物中置换出来 |
您最近一年使用:0次
2020-08-08更新
|
98次组卷
|
2卷引用:福建省三明第一中学2019-2020学年高二下学期期中考试化学试题



