名校
解题方法
1 . 下列说法错误的是
| A.石墨晶体中层内导电性强于层间导电性 |
| B.基态Cr3+的最高能层中成对电子与未成对电子的数目比为8∶3 |
| C.(CH3COO)2Ni·4H2O的空间构型为八面体,中心离子的配位数为6 |
| D.N元素的电负性比P元素的大,可推断NCl3分子的极性比PCl3的大 |
您最近一年使用:0次
2022-03-03更新
|
769次组卷
|
7卷引用:福建省漳平第二中学2021-2022学年高二下学期第一次月考化学试题
福建省漳平第二中学2021-2022学年高二下学期第一次月考化学试题山东省淄博市2022届高三下学期第一次模拟考试化学试题(已下线)提升卷05-【新高考新题型】2022年高考化学选择题标准化练习20卷(山东专用)(已下线)必刷卷03-2022年高考化学考前信息必刷卷(山东专用)湖北武汉市2022届高三5月第一次模拟考试化学试题(已下线)化学预测卷(四)-预测卷(浙江专版)江西省铜鼓中学2022-2023学年高二下学期4月月考化学试题
名校
2 . 短周期元素X、Y、Z、W、R的原子序数依次增大,Y与W同主族,Z与R同主族,它们形成的甲、乙两种物质(如图)是有机合成中常用的还原剂。下列说法正确的是
甲: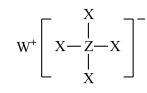 ,乙:
,乙: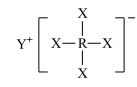
甲:
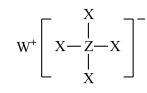 ,乙:
,乙: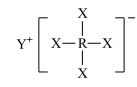
| A.电负性:X>Z>R |
| B.第一电离能:Y<Z<R |
| C.元素Z和R最高价氧化物对应的水化物都具有两性 |
| D.单质Y和W在空气中燃烧的产物所含化学键类型完全相同 |
您最近一年使用:0次
2022-03-03更新
|
722次组卷
|
6卷引用:福建省福安市第一中学2023届高三上学期第一次检测化学试题
福建省福安市第一中学2023届高三上学期第一次检测化学试题福建省福清虞阳中学2023-2024学年高三上学期第一次综合训练化学试题山东省淄博市2022届高三下学期第一次模拟考试化学试题广东省佛山市第四中学2021-2022学年高二下学期3月段考化学试题(已下线)专项08 物质结构 元素周期律-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)云南省富源县第一中学2021-2022学年高三下学期4月月考化学试题
名校
3 . 短周期元素W、X、Y、Z的原子序数依次增大,其中基态W原子的s能级电子总数是p能级电子总数的2倍,Y与W同主族,X的最简单氢化物的水溶液呈碱性,基态Z原子的核外电子中只有一个未成对电子。下列说法错误的是
| A.电负性:Z>W>Y | B.最简单氢化物的沸点:X>W>Y |
| C.原子半径:Y>W>X | D.Z的单质具有强氧化性 |
您最近一年使用:0次
4 . 钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(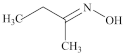 )。回答下列问题:
)。回答下列问题:
(1)基态硅原子的核外电子空间运动状态有___________ 种。
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为___________ ,氮原子的杂化方式为___________ ,C=N与C-C键夹角___________ (填“<”“>”或“=”)C=N与N-O键夹角。
(3) 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。
① 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为___________ ,其空间构型为___________ 。
② 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成 ,
, 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因___________ 。
 )。回答下列问题:
)。回答下列问题:(1)基态硅原子的核外电子空间运动状态有
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)
 和
和 均是制备钛硅分子筛的重要中间体。
均是制备钛硅分子筛的重要中间体。①
 与光气
与光气 反应可用于制取四氯化钛。
反应可用于制取四氯化钛。 中σ键和π键的数目比为
中σ键和π键的数目比为②
 与金属
与金属 在高温条件下可反应生成
在高温条件下可反应生成 ,
, 中
中 极易被氧化,还原性很强。试解释
极易被氧化,还原性很强。试解释 还原性强的原因
还原性强的原因
您最近一年使用:0次
5 . C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:
(1)科学家常利用___________ 区分晶体SiO2和非晶体SiO2。
(2)基态Ge原子核外电子的空间运动状态有___________ 种。
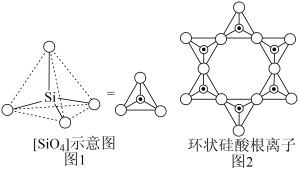
(3)Si为重要的半导体材料,硅与NaOH溶液反应生成Na2SiO3溶液,该溶液中四种元素电负性由小到大的顺序为___________ 。硅酸盐中的硅酸根离子通常以[ ]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:
]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:___________ 。
(4)实验中常用K3[Fe(CN)6]检验Fe2+,K3[Fe(CN)6]中Fe3+的配位数为___________ ,其中碳原子的杂化轨道类型为___________ 。1 mol K3[Fe(CN)6]中含有σ键与π键的数目之比为___________ 。
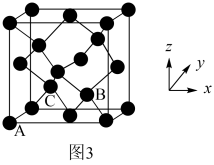
(5)灰锡的晶体结构(如图3所示)与金刚石相似,其中A处原子的原子分数坐标为(0,0,0),则C处原子的原子分数坐标为___________ 。
(1)科学家常利用
(2)基态Ge原子核外电子的空间运动状态有
(3)Si为重要的半导体材料,硅与NaOH溶液反应生成Na2SiO3溶液,该溶液中四种元素电负性由小到大的顺序为
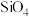 ]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:
]四面体(如图1所示)的方式形成链状、环状或网络状复杂阴离子,图2所示为一种环状硅酸根离子,写出其化学式:

(4)实验中常用K3[Fe(CN)6]检验Fe2+,K3[Fe(CN)6]中Fe3+的配位数为
(5)灰锡的晶体结构(如图3所示)与金刚石相似,其中A处原子的原子分数坐标为(0,0,0),则C处原子的原子分数坐标为
您最近一年使用:0次
名校
解题方法
6 . 下列对有关事实的原因分析错误的是
| 事实 | 原因 | |
| A | 白磷(P4)为正四面体分子 | 白磷分子中P−P键间的夹角是109°28′ |
| B | 分子内不同化学键之间存在一定的夹角 | 共价键具有方向性 |
| C | 键的极性H−O键>H−S键 | O的电负性大于S的电负性 |
| D | 通常状况下,1体积水溶解700体积氨气 | 氨是极性分子且有氢键的影响 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2022-01-24更新
|
1065次组卷
|
9卷引用:福建省连城县第一中学2021-2022学年高二下学期第一次月考化学试题
福建省连城县第一中学2021-2022学年高二下学期第一次月考化学试题山东省烟台市2021-2022学年高二上学期期末考试化学试题(已下线)第二章 分子结构与性质 章节过关检测-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)湖北省新高考联考协作体2021-2022学年高二3月考试化学试题山东省枣庄市第三中学2021-2022学年高二3月质量检测化学试题广东省佛山市顺德区第一中学 2021-2022学年高二下学期期中考试化学试题山东省沂南第一中学2021-2022学年高二4月月考化学试题(已下线)专题33 物质结构与性质基础-2023年高考化学毕业班二轮热点题型归纳与变式演练(新高考专用)广东省深圳市盐田高级中学2022-2023学年高二下学期第一次月考化学试题
7 . 2021年5月15日,“天问一号” 火星控测器成功着陆火星。“天问一号”的着陆巡视器突破了高强度铝合金贮箱壳体材料、焊接、250N发动机硅化钼高温抗氧化涂层等多项关键技术,为“天问一号”提供了可靠、精准、稳定的动力。回答下列问题:
(1)钼与铬为同族元素,则钼位于周期表的___________ 区。
(2)铝锂合金是航天飞机低温外贮箱的壳体材料。在合金中加入钪,可大大增加合金的强度。基态钪原子的电子排布式为___________ 。
(3)氢气还原SiHCl3(Si的化合价为+4价),得到高纯硅。将高纯硅和钼高温化合制得硅化钼。SiHCl3的分子空间构型是___________ ;SiHCl3中所含元素电负性由大到小的顺序为___________ 。
(4)火星大气层的主要成分是二氧化碳,其次是氮气、氩气,此外还含有少量的氧气和水蒸气,若将这几种气体降温液化,最先液化的气体是___________ ,原因是___________ 。
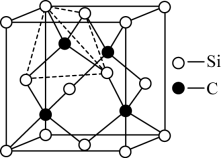
(5)文献报道,硅化钼涂层可提高碳化硅电热元件高温抗氧化性能,SiC的晶胞结构如图所示。晶体中硅原子的配位数为___________ 。图中晶胞含有硅原子数为___________ 。
(1)钼与铬为同族元素,则钼位于周期表的
(2)铝锂合金是航天飞机低温外贮箱的壳体材料。在合金中加入钪,可大大增加合金的强度。基态钪原子的电子排布式为
(3)氢气还原SiHCl3(Si的化合价为+4价),得到高纯硅。将高纯硅和钼高温化合制得硅化钼。SiHCl3的分子空间构型是
(4)火星大气层的主要成分是二氧化碳,其次是氮气、氩气,此外还含有少量的氧气和水蒸气,若将这几种气体降温液化,最先液化的气体是
(5)文献报道,硅化钼涂层可提高碳化硅电热元件高温抗氧化性能,SiC的晶胞结构如图所示。晶体中硅原子的配位数为

您最近一年使用:0次
名校
解题方法
8 . 根据元素性质递变规律,下列判断不正确的是
| A.酸性:H2SiO3 < H3PO4 < H2SO4 | B.电负性:F > Cl > Br > I |
| C.第一电离能:Na < Mg < Al | D.原子半径:N > O > F |
您最近一年使用:0次
2021-12-03更新
|
206次组卷
|
3卷引用:福建省莆田华侨中学2021-2022学年高二下学期期中考试化学试题
福建省莆田华侨中学2021-2022学年高二下学期期中考试化学试题浙江省绍兴市诸暨中学2021-2022学年高二上学期期中考试(平行班)化学试题(已下线)第1.2.2讲 元素周期律-2021-2022学年高二化学链接教材精准变式练(人教版2019选择性必修2)
名校
解题方法
9 . 下列有关微拉性质的比较中,正确的是
A.原子半径: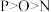 | B.最高正价: |
C.第一电离能: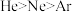 | D.电负性: |
您最近一年使用:0次
2021-09-22更新
|
463次组卷
|
5卷引用:福建泉州市第六中学2020-2021学年高二下学期期中考试化学试题
福建泉州市第六中学2020-2021学年高二下学期期中考试化学试题(已下线)第1章 原子结构与性质(章末检测)-2021-2022学年高二化学课时过关提优AB练(人教版2019选择性必修2)陕西省宝鸡市金台区2021-2022学年高二下学期期中考试化学试题吉林省吉林市田家炳高级中学2022-2023学年高二上学期期末线上考试化学试题四川省南充市阆中中学校2023-2024学年高二下学期3月月考化学试卷
名校
解题方法
10 . 回答下列问题:
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是___________ 。
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是___________ 。
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为___________ 。
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为___________ 。
②Co2+的最高能层电子排布式为___________ 。
③下列状态的钴中,电离最外层一个电子所需能量最大的是___________ (填标号)
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是___________ 。
(4)碳酸亚乙酯( )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因___________ 。
(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱___________ 。
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为___________ 。
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为___________ (用含a和ρ的最简代数式表示)
(1)氨基酸锌是研究最早和使用最广泛的第三代锌添加剂,该添加剂具有优良的营养功能。如图1是氨基酸锌的结构简式。

①组成氨基酸锌的C、N、O的电负性由大到小的顺序是
②氨基酸锌的Zn2+形成配位键,其中提供空轨道的是
③最简单的氨基酸是甘氨酸(结构简式如图2),其结构中π键与σ键的数量比为
(2)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(II)双核配合物的内界。

①配合物中每个中心离子的配位数为
②Co2+的最高能层电子排布式为
③下列状态的钴中,电离最外层一个电子所需能量最大的是
A.[Ar]3d74s1 B.[Ar]3d74s2 C.[Ar]3d74s14p1 D.[Ar]3d74p1
(3)二氯甲醛的结构简式为
 ,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是
,已知单键和双键的键角为124.1°,单键和单键的键角为111.8°,原因是(4)碳酸亚乙酯(
 )是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因
)是某锂离子电池电解液的添加剂,该物质能溶于水,请解释原因(5)化学上有一种见解,认为含氧酸的通式可以写成(HO)mROn,如果成酸元素R相同,则n值越大的R正电性越高,导致R-O-H中O的电子向R偏移,因而在水分子的作用下,也就越容易电离出H+,即酸性越强,用以上原理解释亚硫酸和硫酸的酸性强弱
(6)一氧化锰在医药、冶炼上应用广泛,其立方晶胞如图所示。

该晶胞中由O2-形成的正八面体的空隙数为
②晶胞中距离最近的两个O2-之间的距离为a pm,MnO晶体的密度为ρ g·cm-3,则阿伏加德罗常数的值为
您最近一年使用:0次



