解题方法
1 . Al、Fe、Cu是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为___ 。
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],沸点102.8℃,熔点-21℃,羰基铁[Fe(CO)5]属于___ 晶体。从电负性角度分析,Fe(CO)5中与Fe形成配位键的是原子___ (填名称)。
(3)已知Al的第一电离能为578 kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因___ 。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是___ ;SiO2中Si原子采取___ 杂化。
(5)金刚砂(SiC)晶胞如图所示:
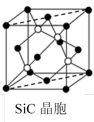
沿晶胞图中虚线方向的切面图为___ (填标号)。
a.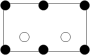 b.
b.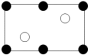
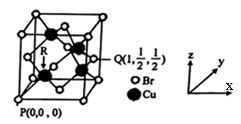
(6)一种铜的溴化物晶胞结构如图所示,该晶胞中铜的配位数是___ ,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为___ ;已知晶胞参数为a pm,其密度为___ g/cm3。(列出计算式即可)
(1)Fe4[Fe(CN)6]3是较早发现的CN-配合物,其中铁元素呈现两种不同的价态。配离子的中心原子核外电子排布式为
(2)铁单质在一定条件下可与CO反应生成配位化合物——羰基铁[Fe(CO)5],沸点102.8℃,熔点-21℃,羰基铁[Fe(CO)5]属于
(3)已知Al的第一电离能为578 kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是
(5)金刚砂(SiC)晶胞如图所示:

沿晶胞图中虚线方向的切面图为
a.
 b.
b.
(6)一种铜的溴化物晶胞结构如图所示,该晶胞中铜的配位数是

您最近一年使用:0次
名校
2 . 下列叙述正确的是
| A.钾原子由激发态转变为基态可获得吸收光谱 |
B.磷化铜(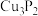 )用于制造磷青铜,电负性: )用于制造磷青铜,电负性: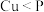 |
C.用原子轨道描述氢分子中化学键的形成: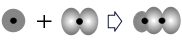 |
D.俗称光气的二氯甲醛(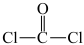 )分子中 )分子中 键角恰好为 键角恰好为 |
您最近一年使用:0次
2021-07-20更新
|
225次组卷
|
3卷引用:福建省宁德市2020-2021学年高二下学期期末考试化学试题
解题方法
3 . 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位。回答下列问题:
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。
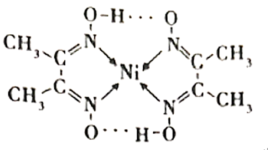
①基态Ni原子的电子排布式为___________ ,该元素在元素周期表中的位置是___________ 。
②元素C、N、O的电负性由大到小顺序为___________ 。
③二丁二酮肟合镍中存在的化学键有___________ (填标号)。
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为___________ 。
(2)工业上采用反应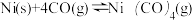 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有___________ 个δ键。
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。
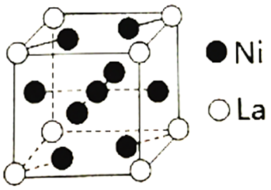
①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为___________ g·cm-3。
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为___________ 。
(1)镍能形成很多配合物,其中一种配合物二丁二酮肟合镍(Ⅱ)的结构如下图。

①基态Ni原子的电子排布式为
②元素C、N、O的电负性由大到小顺序为
③二丁二酮肟合镍中存在的化学键有
A.共价键 B.配位键 C.氢键 D.离子键 E.范德华力
④二丁二酮肟合镍中氮原子的杂化类型为
(2)工业上采用反应
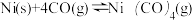 提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有
提纯粗镍,Ni(CO)4是呈正四面体形的配合物,0.5 mol Ni(CO)4中含有(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如下。

①测知镧镍合金晶胞边长为anm,则镧镍合金的晶体密度为
②若储氢后,氢原子占据晶胞上下底面的面心及棱的中点,则形成的储氢化合物的化学式为
您最近一年使用:0次
解题方法
4 . 磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为___________ ;价电子中成对电子数有___________ 个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是___________ 。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___________ H3PO4 (填“>”或“<”)
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn___________ P。(填“>”、“<”或 “=”)
(4)某磷青铜晶胞结构如图所示。
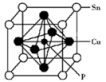
①则其化学式为___________ 。
②该晶体中距离Cu原子最近的Sn原子有___________ 个,这些Sn原子所呈现的构型为___________ 。
(1)基态铜原子的电子排布式为
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3
(3)磷青铜中的锡、磷两种元素电负性的大小为Sn
(4)某磷青铜晶胞结构如图所示。

①则其化学式为
②该晶体中距离Cu原子最近的Sn原子有
您最近一年使用:0次
名校
5 . (1)Cd与Zn同族且相邻,若Cd基态原子将次外层1个d电子激发进入最外层的np能级,则该激发态原子的外围电子排布式为_______ 。
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的 第二周期元素的第一电离能由大到小的顺序是_______ (用元素符号表示);
(3)噻吩(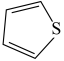 )和吡咯(
)和吡咯(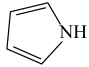 )形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:
)形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:_______ 。
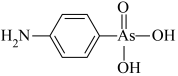
(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为_______ ,1mol对氨基苯胂酸含σ键数目为_______
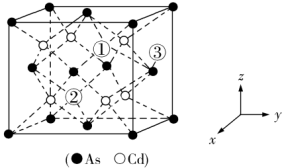
(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为( ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为_______ 。晶胞参数为apm,阿伏加德罗常数的值为NA,砷化镉的摩尔质量为Mg·mol-1,则该晶胞的密度为_______ g·cm-3(列计算式即可)
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的 第二周期元素的第一电离能由大到小的顺序是
(3)噻吩(
 )和吡咯(
)和吡咯( )形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:
)形成配位化合物。噻吩难溶于水,吡咯能溶于水,原因为:(4)含砷有机物“对氨基苯胂酸”的结构简式如图,As原子轨道杂化类型为

(5)砷化镉可以看作是石墨烯的3D版,其晶胞结构如图,As为面心立方堆积,Cd占据As围成的四面体空隙,空隙占有率75%,故Cd为“具有两个真空的立方晶格”,如图“①”和“②”位是“真空”。建立如图的原子坐标系,①号位的坐标为(
 ,
, ,
, ),则③号位原子坐标参数为
),则③号位原子坐标参数为
您最近一年使用:0次
2021-06-01更新
|
544次组卷
|
2卷引用:福建省厦门外国语学校2021届高三5月高考适应性考试化学试题
名校
解题方法
6 . 下列叙述正确的是
| A.某元素原子核外电子总数是最外层电子数的5倍,则其最高正价为+7 |
| B.钠元素的第一、第二电离能分别小于镁元素的第一、第二电离能 |
| C.通过比较氯的化合价即可确定氧化性:高氯酸>次氯酸 |
| D.元素电负性大的原子第一电离能也一定大 |
您最近一年使用:0次
名校
解题方法
7 . 一种元素原子的价电子构型为2s22p5,下列有关它的描述正确的有
| A.在周期表中电负性最大 | B.在周期表中第一电离能最大 |
| C.在周期表中原子半径最小 | D.核外电子只有7种运动状态 |
您最近一年使用:0次
名校
解题方法
8 . 氮元素可以形成多种化合物。回答以下问题:
(1)基态氮原子的电子轨道排布式是_______ 。
(2)C、N、O三种元素第一电离能从小到大的顺序是_______ 。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是_______ 。
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有_______ mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在_______ (填标号)。
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_______ (填标号)。
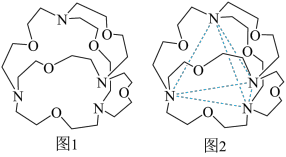
a.CF4 b.NH c.H2O d.CH4
c.H2O d.CH4
(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是_______ 。
(1)基态氮原子的电子轨道排布式是
(2)C、N、O三种元素第一电离能从小到大的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。
①N2H4分子中氮原子轨道的杂化类型是
②肼可用作火箭燃料,燃烧时发生的反应是:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH=-1038.7 kJ·mol-1;若该反应中有2 mol N-H键断裂,则形成的π键有
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内存在
a.离子键 b.共价键 c.范德华力 d.配位键
(4)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是

a.CF4 b.NH
 c.H2O d.CH4
c.H2O d.CH4(5)NH3BH3分子中,与N原子相连的H呈正电性(Hδ+),与B原子相连的H呈负电性(Hδ-),该分子中所有原子电负性由大到小顺序是
您最近一年使用:0次
2021-05-14更新
|
126次组卷
|
2卷引用:福建省三明市三地三校2020-2021学年高二下学期期中联考化学试题
9 . 科学工作者合成了含镁、镍、碳3种元素的超导材料,具有良好的应用前景,回答下列问题:
(1)镍元素位于周期表第_______ 列,基态镍原子d轨道中成对电子与单电子的数量比为_______ 。
(2)在CO分子中,C与O之间形成_______ 个σ键、_______ 个π键,在这些化学键中,O原子共提供了_______ 个电子。
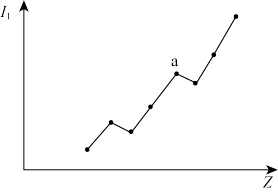
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是_______ 。原子核对外层电子的引力增大,导致I1在a点出现齿峰的原因是_______ 。
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是_______ 。
②NH3、PH3、AsH3中沸点最高的是_______ ,其主要原因是_______ 。
(1)镍元素位于周期表第
(2)在CO分子中,C与O之间形成
(3)第二周期元素的第一电离能(I1)随原子序数(Z)的变化情况如图。I1随Z的递增而呈增大趋势的原因是
(4)VA族元素及其化合物在生产、生活中用途广泛。如P4S3常用于制造火柴,As4S4俗称雄黄,那么
①P、S、As电负性由大到小的顺序是
②NH3、PH3、AsH3中沸点最高的是

您最近一年使用:0次
2021-05-11更新
|
128次组卷
|
2卷引用:福建省泉州一中2020-2021学年高三上学期期末化学试题
名校
解题方法
10 . 现有四种元素,其中两种元素基态原子的电子排布式如下:①1s22s22p63s23p4②1s22s22p63s23p3,另两种元素的价电子排布式为③2s22p3④2s22p5,则下列有关比较中正确的是
| A.原子半径:①>②>④>③ | B.第一电离能:④>③>②>① |
| C.电负性: ④>③>②>① | D.最高正化合价:④>③=②>① |
您最近一年使用:0次
2021-05-08更新
|
171次组卷
|
2卷引用:福建省福州高级中学2020-2021学年高二下学期期中考试化学试题



