名校
解题方法
1 . 铁触媒是重要的催化剂,铁触媒在500 ℃左右时的活性最大,这也是合成氨反应一般选择在500 ℃左右进行的重要原因之一。CO易与铁触媒作用导致其失去催化活性:Fe+5CO===Fe(CO)5;在溶液中除去CO的化学方程式为[Cu(NH3)2]OOCCH3+CO+NH3 = 刹[Cu(NH3)3(CO)]OOCCH3。请回答下列问题:
(1)基态Fe原子的核外电子排布式为[Ar]___ ;C、N、O的电负性由大到小的顺序为______ 。
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为______ ;配合物[Cu(NH3)2]OOCCH3中,铜显___ 价,碳原子的杂化轨道类型是______ ,NH3价电子对互斥理论模型是______ 。
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有________ (填字母)形成。
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是________ 。
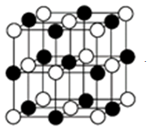
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为________ ,面心立方堆积与体心立方堆积的两种铁晶体的密度之比为________ (写出已化简的比例式即可)。(两种堆积中最邻近的铁原子的核间距相等)

(1)基态Fe原子的核外电子排布式为[Ar]
(2)Cu2+在水中呈现蓝色是因为形成了四水合铜(Ⅱ)离子,其化学式为
(3)用[Cu(NH3)2]OOCCH3溶液除去CO的反应中,肯定有
A.离子键 B.配位键 C.非极性键 D.σ键
(4)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是
(5)单质铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为

您最近一年使用:0次
2019-05-07更新
|
425次组卷
|
2卷引用:【校级联考】福建省莆田第一中学、第四中学2019届高三下学期一模理科综合化学试题
解题方法
2 . 硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃。
(1)锌离子的电子排布式是_____________ 。
(2)根据元素周期律,电负性S______ Se,第一电离能Se______ As(填“>”或“<”)。
(3)H2O的沸点______________ (填“>”或“<”)H2Se的沸点,其原因是:______ 。
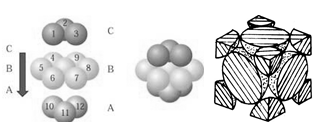
(4)NaCl晶胞如图所示,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。晶胞中Na+的配位数为____ ,若晶胞参数为a pm,阿伏伽德罗常数的值用NA表示,若晶体密度为_______ g·cm﹣3。(列出表达式)。
(5)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于_______ 。若已知铜的原子半径为rcm,表示原子空间占有率的表达式为__________ 。
(1)锌离子的电子排布式是
(2)根据元素周期律,电负性S
(3)H2O的沸点
(4)NaCl晶胞如图所示,阴、阳离子都具有球型对称结构,它们都可以看做刚性圆球,并彼此“相切”。晶胞中Na+的配位数为
(5)铜晶体中铜原子的堆积方式如图所示,铜晶体中原子的堆积模型属于
您最近一年使用:0次
名校
解题方法
3 . 氯磺酰氰酯(结构简式为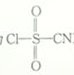 )是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
)是一种多用途的有机合成试剂,在HClO4-NaClO4介质中, K5[Co3+O4W12O36](简写为Co3+W)可催化合成氯磺酰氰酯。
(2)氯磺酰氰酯分子中硫原子和碳原子的杂化轨道类型分别是
(3)ClO4-的空间构型为
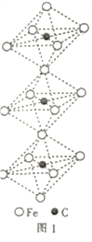
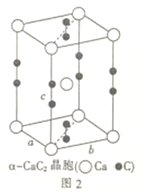
(4)一种由铁、碳形成的间隙化合物的晶体结构如图1所示,其中碳原子位于铁原子形成的八面体的中心,每个铁原子又为两个八面体共用,则该化合物的化学式为
您最近一年使用:0次
2018-05-25更新
|
261次组卷
|
3卷引用:【全国省级联考】福建省百校2018届高三下学期临考冲刺检测化学试题
4 . 下表是前20号元素中的部分元素的一些数据:
试回答下列问题:
(1)以上10种元素电负性最大的是_____ (填元素符号)。比元素B原子序数大7的元素在元素周期表中的位置:第_____ 周期,第_____ 族,其基态原子的核外电子排布式是________ 。
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)__________ 。
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成________ 个σ键,________ 个π键。
(4)I与氢元素形成的10电子分子X的空间构型为________ ;将X溶于水后的溶液滴入到CuSO4溶液中至过量,得到的络离子的化学式为________ ,其中X与Cu2+之间以_____________ 键结合。
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a._________________________________ 。
b._________________________________ 。

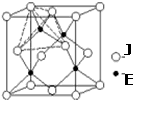
(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为_________ ,若晶胞边长为a cm,则晶体的密度为_______________ (用含a、NA的代数式表示)(g/mL)。
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
| 最高价态 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
| 最低价态 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
(1)以上10种元素电负性最大的是
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子。其分子中共形成
(4)I与氢元素形成的10电子分子X的空间构型为
(5)下图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:
a.
b.

(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为

您最近一年使用:0次
2017-12-20更新
|
309次组卷
|
3卷引用:2020届高三化学二轮选修大题必练—— 物质结构与性质大题练
名校
解题方法
5 . 不能说明X的电负性比Y的大的是
| A.与H2化合时X单质比Y单质容易 |
| B.X单质可以把Y从其氢化物中置换出来 |
| C.X原子的最外层电子数比Y原子的最外层电子数多 |
| D.X的最高价氧化物的水化物的酸性比Y的最高价氧化物的水化物的酸性强 |
您最近一年使用:0次
2017-12-06更新
|
162次组卷
|
2卷引用:福建省晋江市季延中学2017-2018学年高二上学期期中考试(理)化学试题
6 . Ⅰ、用下列:①H2O ②H2O2 ③Ba(OH)2 ④Na2O2 ⑤Cl2 ⑥Ar ⑦CO2 等物质填空。 (1—4小题填序号)
(1) 由离子键和非极性键构成的是_________________
(2) 由极性键和非极性键构成的是_________________
(3) 不存在化学键的是________
(4) 共价化合物有_________________
(5) 写出下列物质的电子式:Na2O2___________
Ⅱ、某元素原子的价电子构型为4s24p1,它属于第________ 周期________ 族,属________ 区元素
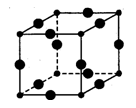
Ⅲ、Cu3N的晶胞结构如图,N3-的配位数为____ ,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为_________ g·cm-3。(阿伏加德罗常数用NA表示,Cu、N相对分子质量为64、14)
(1) 由离子键和非极性键构成的是
(2) 由极性键和非极性键构成的是
(3) 不存在化学键的是
(4) 共价化合物有
(5) 写出下列物质的电子式:Na2O2
Ⅱ、某元素原子的价电子构型为4s24p1,它属于第
Ⅲ、Cu3N的晶胞结构如图,N3-的配位数为

您最近一年使用:0次
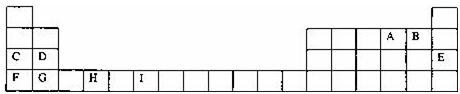
7 . 下表为周期表的一部分,其中的字母代表对应的元素,请针对这些元素回答下列问题.
请回答下列问题:
(1)元素I的元素符号 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期 族.
(2)表中元素第一电离能最小的是 (填元素符号,下同),电负性最大的是 ,化学性质最稳定的是 .
(3)表中元素处于d区的是 (填元素符号).
(4)请举出F的金属性比C强的实验事实: ,并用原子结构理论解释其原因: .

请回答下列问题:
(1)元素I的元素符号 ;已知M2+离子3d轨道中有6个电子,试推出M元素位于周期表的 周期 族.
(2)表中元素第一电离能最小的是 (填元素符号,下同),电负性最大的是 ,化学性质最稳定的是 .
(3)表中元素处于d区的是 (填元素符号).
(4)请举出F的金属性比C强的实验事实: ,并用原子结构理论解释其原因: .
您最近一年使用:0次
2016-12-09更新
|
181次组卷
|
2卷引用:2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷
名校
解题方法
8 . 元素化学性质随着原子序数的递增呈现周期性变化的原因是
| A.原子半径的周期性变化 |
| B.电负性的周期性变化 |
| C.第一电离能的周期性变化 |
| D.原子核外电子排布的周期性变化 |
您最近一年使用:0次
2016-12-09更新
|
172次组卷
|
3卷引用:2015-2016学年福建省泉州市晋江市平山中学高二上期末化学试卷
9 . 科学家正在研究温室气体CH4和CO2的转化和利用。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为______ 。
(2)下列关于CH4和CO2的说法正确的是______ (填序号)。
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为____________ ,Ni该元素位于元素周期表的第___ 族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有_____ molσ键。
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是______ 。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是___________________________ 。
(1)CH4和CO2所含的三种元素电负性从小到大的顺序为
(2)下列关于CH4和CO2的说法正确的是
a.固态CO2属于分子晶体
b. CH4分子中含有极性共价键,是极性分子
c.因为碳氢键键能小于碳氧键,所以CH4熔点低于CO2
d. CH4和CO2分子中碳原子的杂化类型分别是sp3和sp
(3)在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为
②Ni能与CO形成正四面体形的配合物Ni(CO)4,1mol Ni(CO)4中含有
(4)一定条件下,CH4和CO2都能与H2O形成笼状结构(如图所示)的水合物晶体,其相关参数见下表.CH4与H2O形成的水合物俗称“可燃冰”。


①“可燃冰”中分子间存在的2种作用力是
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想.已知图中笼状结构的空腔直径为0.586nm,根据上述图表,从物质结构及性质的角度分析,该设想的依据是
您最近一年使用:0次
2016-12-09更新
|
1721次组卷
|
3卷引用:2015年全国普通高等学校招生统一考试化学(福建卷)
解题方法
10 . 氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
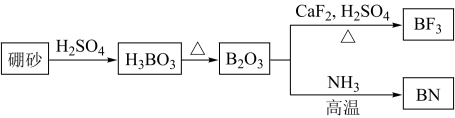
请回答下列问题:
(1)由B2O3制备BN的化学方程式是_____________________________________ ;
(2)B和N相比,电负性较大的是__________ ,BN中B元素的化合价为__________ ;
(3)在BF3分子中,F—B—F的键角是________ , B原子的杂化轨道类型为________ ;
(4)BF3和过量NaF作用可生成NaBF4,BF 的立体构型为
的立体构型为________ ;
(5)六方氮化硼与石墨相似,层内B原子与N原子之间的化学键为_________ ,N原子L层的P电子比S电子多_________ 个。
(6)写出CaF2的电子式:________ 。

请回答下列问题:
(1)由B2O3制备BN的化学方程式是
(2)B和N相比,电负性较大的是
(3)在BF3分子中,F—B—F的键角是
(4)BF3和过量NaF作用可生成NaBF4,BF
 的立体构型为
的立体构型为(5)六方氮化硼与石墨相似,层内B原子与N原子之间的化学键为
(6)写出CaF2的电子式:
您最近一年使用:0次



