解题方法
1 . 钛、铬、铁、镍、铜等金属及其化合物在工业上都有重要用途。
(1)基态钛原子外围电子的轨道表达式为_____ 。与钛同周期的元素中,基态原子的未成对电子数与钛原子相同的有_____ 种。
(2)TiCl4是氯化法制取钛的中间产物。TiCl4和SiC14在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是_____ (填化学式)。
(3)[Cr(C2O4)2(H2O2)]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有_____ 键。
(4)雷氐盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2] • H2O,是一种易溶于水和乙醇的暗红色固体。
①雷氏盐中铬元素的化合价为_____ 。
②NCS的立体构型是_____ ,其中碳原子的杂化轨道类型为_____ 。
③SO2、CO2、BeCl2、SCl2四种分子中,与NCS-互为等电子体的有_____ (填化学式)。
(5)Ni和La的合金是目前使用广泛的储氢材料,具有容量大、寿命长、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
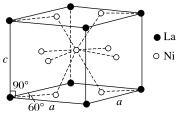
①晶体的化学式为_____ 。
②该晶胞的密度为dg•cm-3。设NA为阿伏加 德罗常数的值,则该晶胞的体积是____ (用含d、NA的代数式表示)cm3。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知: a=511pm,c=397pm;标准状况下,氢气的密度为8.98X10-5 g, ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_____ (保留整数)。
(1)基态钛原子外围电子的轨道表达式为
(2)TiCl4是氯化法制取钛的中间产物。TiCl4和SiC14在常温下都是液体,分子结构相同。采用蒸馏的方法分离TiCl4和SiCl4的混合物,先获得的馏分是
(3)[Cr(C2O4)2(H2O2)]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有
(4)雷氐盐(Reinecke salt)的化学式为NH4[Cr(NCS)4(NH3)2] • H2O,是一种易溶于水和乙醇的暗红色固体。
①雷氏盐中铬元素的化合价为
②NCS的立体构型是
③SO2、CO2、BeCl2、SCl2四种分子中,与NCS-互为等电子体的有
(5)Ni和La的合金是目前使用广泛的储氢材料,具有容量大、寿命长、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①晶体的化学式为
②该晶胞的密度为dg•cm-3。设NA为阿伏加 德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知: a=511pm,c=397pm;标准状况下,氢气的密度为8.98X10-5 g,
 ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2020-03-14更新
|
221次组卷
|
2卷引用:河北省2020届高三上学期11月百千联考理科综合化学试题
解题方法
2 . 钴的合金及其配合物用途非常广泛。已知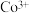 比
比 的氧化性更强,在水溶液中不能大量存在.
的氧化性更强,在水溶液中不能大量存在.
(1)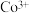 的核外电子排布式为
的核外电子排布式为_____________ 。
(2)无水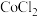 的熔点为
的熔点为 、沸点为
、沸点为 ,
, 熔点为
熔点为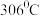 、沸点为
、沸点为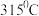 .
.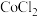 属于
属于_______ 晶体, 属于
属于_____ 晶体。
(3) 可用于激光起爆器等,可由
可用于激光起爆器等,可由 、
、 、
、 共反应制备.
共反应制备.
① 的空间构型为
的空间构型为______________________ 。
② 的化学式为
的化学式为 ,与
,与 (III)形成配位键的原子是
(III)形成配位键的原子是_____
已知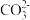 的结构式是
的结构式是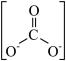
③ 可以
可以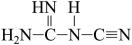 (双聚氰胺)为原料制备,
(双聚氰胺)为原料制备, 双聚氯胺分子中含
双聚氯胺分子中含 键的数目为
键的数目为___________ 。
(4) 与
与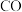 作用可生成
作用可生成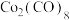 ,其结构如图所示,该分子中
,其结构如图所示,该分子中 原子的杂化方式为
原子的杂化方式为_____________________________ 。

(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为______ 。已知 为阿伏伽德罗常数的数值,则该晶胞的密度为
为阿伏伽德罗常数的数值,则该晶胞的密度为______ (用含 、
、 、
、 的代数式表示)
的代数式表示)
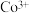 比
比 的氧化性更强,在水溶液中不能大量存在.
的氧化性更强,在水溶液中不能大量存在.(1)
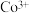 的核外电子排布式为
的核外电子排布式为(2)无水
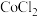 的熔点为
的熔点为 、沸点为
、沸点为 ,
, 熔点为
熔点为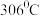 、沸点为
、沸点为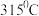 .
.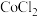 属于
属于 属于
属于(3)
 可用于激光起爆器等,可由
可用于激光起爆器等,可由 、
、 、
、 共反应制备.
共反应制备.①
 的空间构型为
的空间构型为②
 的化学式为
的化学式为 ,与
,与 (III)形成配位键的原子是
(III)形成配位键的原子是已知
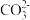 的结构式是
的结构式是
③
 可以
可以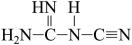 (双聚氰胺)为原料制备,
(双聚氰胺)为原料制备, 双聚氯胺分子中含
双聚氯胺分子中含 键的数目为
键的数目为(4)
 与
与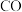 作用可生成
作用可生成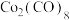 ,其结构如图所示,该分子中
,其结构如图所示,该分子中 原子的杂化方式为
原子的杂化方式为
(5)钴酸锂是常见锂电池的电极材料,其晶胞结构如图所示。该晶胞中氧原子的数目为
 为阿伏伽德罗常数的数值,则该晶胞的密度为
为阿伏伽德罗常数的数值,则该晶胞的密度为 、
、 、
、 的代数式表示)
的代数式表示)
您最近一年使用:0次
名校
解题方法
3 . [化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________ 、________ (填标号)

(2)H3BO3是一元弱酸,可用作医用消毒剂,其水溶液呈酸性的原理为:

则1mol硼酸分子中含有的共用电子对数为________ 个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________ ,硼原子杂化方式是________________ ;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________ 。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________ 个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。

①六方BN具有良好的润滑性,是因为________________________ ;六方BN不能像石墨一样具有导电性,其原因是________________________ 。
②已知立方BN的晶胞参数为0.3615nm,阿伏伽德罗常数的值为NA,则立方BN的密度为________________ g·cm-3(列出计算式)。
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为

(2)H3BO3是一元弱酸,可用作医用消毒剂,其水溶液呈酸性的原理为:

则1mol硼酸分子中含有的共用电子对数为
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。

①六方BN具有良好的润滑性,是因为
②已知立方BN的晶胞参数为0.3615nm,阿伏伽德罗常数的值为NA,则立方BN的密度为
您最近一年使用:0次
2019-01-05更新
|
671次组卷
|
3卷引用:【省级联考】河北省衡水金卷2019届高三第三次联合质量测评理综化学试题
名校
解题方法
4 . 已知A、B、C、D四种元素的原子序数之和等于36.A的单质是最轻的气体;B的基态原子有3个不同的能级,各能级中电子数相等;D有“生物金属”之称,其单质和化合物有广泛的用途,D4+离子和氩原子的核外电子排布相同.工业上利用DO2和碳酸钡在熔融状态下制取化合物甲(甲可看做一种含氧酸盐).化合物甲有显著的“压电性能”,应用于超声波的发生装置.经X射线分析,化合物甲晶体的晶胞结构为立方体(如下图所示),其中Ba2+占据体心位置,O2-占据棱心位置,D4+占据顶点位置.

请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是__________________ (填元素符号).
(2)BA4分子的空间构型是______________ ;B原子轨道的杂化类型为_____ .
(3)C的气态氢化物的电子式为____ ;其沸点高于同主族其他元素氢化物的沸点,主要原因是____________________ .
(4)D的基态原子核外电子排布式为____________________ .
(5)①制备化合物甲的化学方程式为____________________ .
②在甲晶体中,若将D4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的__________ .
③在甲晶体中,D4+的氧配位数为__________ .
④已知甲晶体的摩尔质量为M g/mol,其晶胞边长为4.03×10-10m,则甲晶体的密度为__________________ g/cm3(要求列出算式,阿伏伽德罗常数用NA表示).

请回答下列问题:
(1)A、B、C三种元素的电负性由大到小的顺序是
(2)BA4分子的空间构型是
(3)C的气态氢化物的电子式为
(4)D的基态原子核外电子排布式为
(5)①制备化合物甲的化学方程式为
②在甲晶体中,若将D4+置于立方体的体心,Ba2+置于立方体的顶点,则O2-处于立方体的
③在甲晶体中,D4+的氧配位数为
④已知甲晶体的摩尔质量为M g/mol,其晶胞边长为4.03×10-10m,则甲晶体的密度为
您最近一年使用:0次
2018-12-04更新
|
137次组卷
|
2卷引用:河北省石家庄市第二中学2019届高三上学期期中考试理科综合化学试题
名校
解题方法
5 . 磷的单质和化合物在科研与生产中有许多重要用途。请回答下列问题:
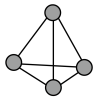
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有____ 对成键电子对和____ 对孤电子对。
(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为_______ 。但NCl5不存在,其原因是________________________ ;
(3)电负性比较:P_____ S(填“>”“=”“<”);而P的第一电离能比S大的原因是______ 。
(4)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。
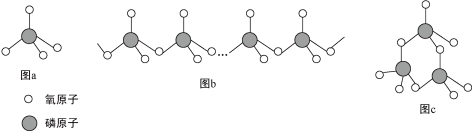
直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:_______ ;含3个磷原子的环状偏磷酸盐的酸根离子(图c)的化学式为________ 。
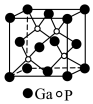
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
①与Ga紧邻的P个数为________ 。
②GaP晶体的密度为(列出计算式)______ g·cm-3(NA为阿伏加德罗常数)。
(1)白磷是磷的一种单质,其分子结构如图所示,则一个分子中有

(2)N和P都有+5价,PCl5能形成离子型晶体,晶格中含有[PCl4]+和[PCl6]-,则[PCl4]+空间构型为
(3)电负性比较:P
(4)复杂磷酸盐有直链多磷酸盐(如图b)和环状偏磷酸盐(如图c)。其酸根阴离子都是由磷氧四面体(图a)通过共用氧原子连接而成。

直链多磷酸盐的酸根离子(图b)中,磷原子和氧原子的原子个数比为n:
(5)磷化镓(GaP)材料是研制微电子器件、光电子器件的新型半导体材料。GaP的晶体结构是闪锌矿型结构(如图所示),晶胞参数apm。
①与Ga紧邻的P个数为
②GaP晶体的密度为(列出计算式)

您最近一年使用:0次
名校
6 . 锰及其化合物用途非常广泛。回答下列问题:
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是___________ 。
(2)基态Mn原子的价电子排布式为_________ ,未成对电子数为_____ 个。
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是____________ 。
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为________ 。
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是_____ ,该分子中碳原子的杂化方式为_______ ;C、H、N的电负性从大到小的顺序为________ 。
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是_________ 。
(6)某种含锰特殊材料的晶胞结构如下图所示:
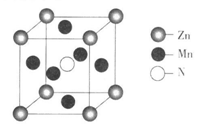
若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为____ ( 列出代数式即可)。
(1)Al70Pd21Mn9是一种准晶体(介于晶体和非晶体之间的固体),能准确证明其不是晶体的方法是
(2)基态Mn原子的价电子排布式为
(3)MnS熔点(1610℃)比MnO熔点(1650℃)低,其原因是
(4)锰的一种配合物的化学式为[Mn(CO)5(CH3CN)]Br。
①配合物中锰元素的价态为
②配体CH3CN与中心原子形成配位键时,提供孤对电子的原子是
(5)锰的含氧酸有HMnO4(高锰酸)、H2MnO3(亚锰酸),高锰酸的酸性比亚锰酸强,理由是
(6)某种含锰特殊材料的晶胞结构如下图所示:

若晶胞参数为a nm,用NA表示阿伏伽德罗常数的值,则该晶胞的密度为
您最近一年使用:0次
2018-05-17更新
|
386次组卷
|
2卷引用:河北省石家庄精英中学2020-2021学年高二下学期期末考试化学试题
名校
解题方法
7 . 甲醇(CH3OH )是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_____ ,其核外电子共占据_____ 个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_____ ,其组成元素的电负性由小到大的顺序为________ .
(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1℃)
①乙酸甲酯分子中心键和节键的个数之比为_________ ;
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为______________ 。
(3)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T一碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,如图所示。
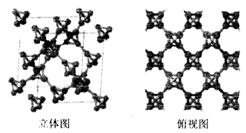
①T-碳与金刚石互称为_________ ;一个T-碳晶胞中含有______ 个碳原子。
②T-碳的密度非常小,约为金刚石的一半。试计算T-碳晶胞的边长和金刚石晶胞的边长之比为________ 。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为
②甲醇和甲醛中碳原子的杂化方式分别为
(2)在一定条件下,甲醇(沸点64.7℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1℃)
①乙酸甲酯分子中心键和节键的个数之比为
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为
(3)科研团队通过皮秒激光照射悬浮在甲醇溶液中的多臂碳纳米管合成T一碳,T-碳的晶体结构可以看成金刚石晶体中每个碳原子被- 一个由四个碳原子组成的正四面体结构单元取代,如图所示。

①T-碳与金刚石互称为
②T-碳的密度非常小,约为金刚石的一半。试计算T-碳晶胞的边长和金刚石晶胞的边长之比为
您最近一年使用:0次
2018-03-27更新
|
407次组卷
|
3卷引用:河北省石家庄市2018届高三第一次教学质量检测理综化学试题
名校
解题方法
8 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Cu的基态原子价电子排布式为_____________ ,
②Ni的基态原子共___________ 有种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,______ (用元素符号表示)。
②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为______ ;中心原子的杂化方式为______ 。
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.910-2nm和7.810-2nm,则熔点NiO____ FeO (填“>”、“<”或“=”),原因是_______ 。
(3)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如下图所示:

①该晶体的化学式为__________ 。
②已知该晶体的摩尔质量为Mg /mol,密度为dg/cm3,设NA为阿伏伽德罗常数的值。则该晶胞的体积是__________ cm3 (用M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3,储氢能力=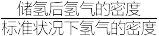 ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为__________ (用M、d、ρ的代数式表示) 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Cu的基态原子价电子排布式为
②Ni的基态原子共
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑
①上述化学方程式中非金属元素电负性由大到小的顺序是,
②COCl2分子中各原子均满足8电子稳定结构,COCl2分子中σ键和π键的个数比为
③NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.910-2nm和7.810-2nm,则熔点NiO
(3)Ni和La的合金是目前使用广泛的储氢材料。该合金的晶胞结构如下图所示:

①该晶体的化学式为
②已知该晶体的摩尔质量为Mg /mol,密度为dg/cm3,设NA为阿伏伽德罗常数的值。则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:标准状况下氢气的密度为ρg/cm3,储氢能力=
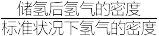 ,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
,若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2018-03-24更新
|
548次组卷
|
3卷引用:【全国校级联考】河北省唐山市五校2018届高三联考A卷理综化学试题
9 . 硼、砷、锑的化合物用途非常广泛。回答下列问题:
(1)基态砷原子的价电子轨道表达式(电子排布图)为_______________ ,其未成对电子所在原子的轨道轮廓图形为____________________ 。
(2)B4C的熔点为2350 ℃、沸点为3500 ℃,说明它属于____________ 晶体,AsF3的沸点(60.4℃)比SbF3的沸点(376℃)低,其原因是____________________________________ 。
(3)已知反应:(CH3)3C—F+SbF6→(CH3)3CSbF6,该反应可生成(CH3)3C+,其碳正离子中碳原子杂化方式有____________________________________ 。
(4)与BF3互为等电子体的分子和离子分别为_______________ (各举1例);已知分子中的大π键可用符号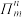 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为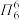 ),则BF3中的大π键应表示为
),则BF3中的大π键应表示为_________________ 。

(5)砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有_________ 个,与每个硼原子紧邻的硼原子有_________ 个,若其晶胞参数为bpm,则其晶体的密度为_________________ (列出表达式,设NA为阿伏伽德罗常数的数值)g·cm-3。
(1)基态砷原子的价电子轨道表达式(电子排布图)为
(2)B4C的熔点为2350 ℃、沸点为3500 ℃,说明它属于
(3)已知反应:(CH3)3C—F+SbF6→(CH3)3CSbF6,该反应可生成(CH3)3C+,其碳正离子中碳原子杂化方式有
(4)与BF3互为等电子体的分子和离子分别为
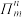 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为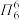 ),则BF3中的大π键应表示为
),则BF3中的大π键应表示为
(5)砷化硼的晶胞结构如图所示。与砷原子紧邻的硼原子有
您最近一年使用:0次
2018-01-31更新
|
222次组卷
|
3卷引用:河北省承德市联校2018届高三上学期期末考试化学试题
名校
解题方法
10 . 2017年5月5日,中国国产大飞机C919首飞成功。为了减轻机身重量,飞机某些部件使用了镁合金。
(1)基态镁原子核外电子的轨道表达式为___________ ,其核外有_________ 种能量不同的电子。
(2)①第二电离能:Na_______ Mg(填“>”“<”或“=”),其原因为______________ 。
②热稳定性:CaCO3>MgCO3,其原因为___________________________ 。
(3)镁不仅在工业生产中用途广泛,也是动植物生命活动中必不可少的微量元素,下图为叶绿素的结构示意图。

①图中与Mg形成配位键的N原子的标号为________ (填写“Ⅰ”“Ⅱ”“Ⅲ”“Ⅳ”)。
②叶绿素中,碳原子的杂化形式为________ 。
(4)碳化镁是一种在化工行业用途广泛的金属碳化物,某种碳化镁的晶体结构如图1所示,图2为其俯视图。

①晶体中Mg的配位数为________ 。
②已知阿伏伽德罗常数的值为NA,据图1中计算该碳化镁的密度为________ g·cm-3.
(1)基态镁原子核外电子的轨道表达式为
(2)①第二电离能:Na
②热稳定性:CaCO3>MgCO3,其原因为
(3)镁不仅在工业生产中用途广泛,也是动植物生命活动中必不可少的微量元素,下图为叶绿素的结构示意图。

①图中与Mg形成配位键的N原子的标号为
②叶绿素中,碳原子的杂化形式为
(4)碳化镁是一种在化工行业用途广泛的金属碳化物,某种碳化镁的晶体结构如图1所示,图2为其俯视图。

①晶体中Mg的配位数为
②已知阿伏伽德罗常数的值为NA,据图1中计算该碳化镁的密度为
您最近一年使用:0次
2018-05-28更新
|
380次组卷
|
2卷引用:【全国市级联考】河北省石家庄市2018届高三高中毕业班模拟考试(二)理综化学试题



