1 . 铬能形成多种配合物,许多铬的配合物都具有广泛用途。回答下列问题:
(1) 成为阳离子时首先失去的是
成为阳离子时首先失去的是_______ 轨道上的电子。
(2) 、
、 、C三种配合物的化学式和颜色如下:
、C三种配合物的化学式和颜色如下:
A.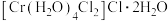 深绿色
深绿色
B. 绿色
绿色
C.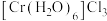 灰蓝色
灰蓝色
① 、
、 、
、 之间的关系是
之间的关系是_____ 。
②化合物 中与
中与 (Ⅲ)形成配位键的原子或离子是
(Ⅲ)形成配位键的原子或离子是_____ ,配位数为_____ 。
③相同物质的量的 、
、 、
、 分别与足量
分别与足量 溶液反应,生成
溶液反应,生成 的物质的量之比为
的物质的量之比为_____ 。
(3)Reineckesalt的结构如图所示。
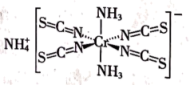
①阳离子的立体结构为_______ ; 的立体结构为
的立体结构为_____ 。
② 中碳原子的杂化方式为
中碳原子的杂化方式为_____ 。
(1)
 成为阳离子时首先失去的是
成为阳离子时首先失去的是(2)
 、
、 、C三种配合物的化学式和颜色如下:
、C三种配合物的化学式和颜色如下:A.
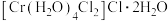 深绿色
深绿色B.
 绿色
绿色C.
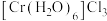 灰蓝色
灰蓝色①
 、
、 、
、 之间的关系是
之间的关系是②化合物
 中与
中与 (Ⅲ)形成配位键的原子或离子是
(Ⅲ)形成配位键的原子或离子是③相同物质的量的
 、
、 、
、 分别与足量
分别与足量 溶液反应,生成
溶液反应,生成 的物质的量之比为
的物质的量之比为(3)Reineckesalt的结构如图所示。

①阳离子的立体结构为
 的立体结构为
的立体结构为②
 中碳原子的杂化方式为
中碳原子的杂化方式为
您最近一年使用:0次
名校
2 . 铁、钴均为第四周期第Ⅷ族元素,它们的单质及化合物具有广泛用途。回答下列问题:
(1)基态Co2+中的未成对电子数为___ ;Fe和Co的第四电离能I4(Fe)___ I4(Co)(填“>”、“<”或“=”)。
(2)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为___ ;已知孤电子对与成键电子的排斥作用大于成键电子对与成键电子的排斥作用,试判断NH3分子与钴离子形成配合物后H—N—H键角___ (填“变大”、“变小”或“不变”)。
(3)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
①丙酮(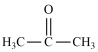 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是___ ,1mol丙酮分子中含有σ键的数目为___ 。
②C、H、O三种元素的电负性由小到大的顺序为___ 。
③乙醇的沸点高于丙酮,这是因为___ 。
(4)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。
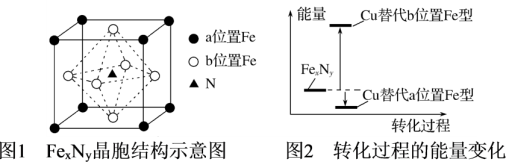
①该结构中单纯分析铁的堆积,其堆积方式为___ 。
②其中更稳定的Cu替代型产物的化学式为____ 。
③若更稳定的Cu替代型产物的密度为ρg/cm3,则该晶胞中相邻的两个Fe原子的距离为___ nm。
(1)基态Co2+中的未成对电子数为
(2)将1molCoCl3·4NH3溶于水中,加入足量AgNO3溶液生成1molAgCl沉淀。则CoCl3·4NH3中配离子的化学式为
(3)铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
①丙酮(
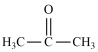 )分子中碳原子轨道的杂化类型是
)分子中碳原子轨道的杂化类型是②C、H、O三种元素的电负性由小到大的顺序为
③乙醇的沸点高于丙酮,这是因为
(4)某FexNy的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示。

①该结构中单纯分析铁的堆积,其堆积方式为
②其中更稳定的Cu替代型产物的化学式为
③若更稳定的Cu替代型产物的密度为ρg/cm3,则该晶胞中相邻的两个Fe原子的距离为
您最近一年使用:0次
名校
3 . 铁、钴均为第四周期第Ⅷ族元素,它们的单质及化合物具有广泛用途。回答下列问题:
(1)基态Co2+中单电子的数目为____ 。
(2)Fe和Co的第三电离能I3(Fe)____ I3(Co)(填“>”、“<”或“=”),原因为___ 。
(3)化学上可用RO取代二硫代磷酸(R代表烃基)萃取铁和钴的离子。萃取原理如图:

①萃取剂中电负性最大的元素是___ ,物质(A)中S原子轨道杂化类型为___ 。
②物质(A)中存在的化学键有____ (填序号)。
a.离子键 b.共价键 c.σ键 d.π键 e.配位键
③物质(B)中X原子的化合价为___ 。
(4)CoCl3·4NH3的中心原子的配位数为6。将1molCoCl3·4NH3溶于水,加入足量AgNO3溶液后生成1molAgCl沉淀。则
①CoCl3·4NH3中配离子的化学式为____ 。
②试判断NH3分子与钴离子形成配合物后H—N—H键角___ (填“变大”、“变小”或“不变”)。
(5)钴铁氧体为反尖晶石结构,其晶胞结构如图所示,已知半数的Fe与O形成[FeO4]四面体,半数的Fe与O形成[FeO6]八面体,Co与O形成[CoO6]八面体。则该化合物的化学式为____ 。已知该晶胞中相邻的两个O2-间的距离为apm,阿伏加德罗常数的值为NA,则该晶体的密度为___ g·cm-3(列出计算式)。

(1)基态Co2+中单电子的数目为
(2)Fe和Co的第三电离能I3(Fe)
(3)化学上可用RO取代二硫代磷酸(R代表烃基)萃取铁和钴的离子。萃取原理如图:

①萃取剂中电负性最大的元素是
②物质(A)中存在的化学键有
a.离子键 b.共价键 c.σ键 d.π键 e.配位键
③物质(B)中X原子的化合价为
(4)CoCl3·4NH3的中心原子的配位数为6。将1molCoCl3·4NH3溶于水,加入足量AgNO3溶液后生成1molAgCl沉淀。则
①CoCl3·4NH3中配离子的化学式为
②试判断NH3分子与钴离子形成配合物后H—N—H键角
(5)钴铁氧体为反尖晶石结构,其晶胞结构如图所示,已知半数的Fe与O形成[FeO4]四面体,半数的Fe与O形成[FeO6]八面体,Co与O形成[CoO6]八面体。则该化合物的化学式为

您最近一年使用:0次
名校
解题方法
4 . 钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为________________ 。
②Fe的基态原子共有________ 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是____________________ (用元素符号表示)。
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为________ ,中心原子的杂化方式为________ 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO________ (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。
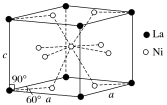
①该晶体的化学式为________________ 。
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是________ cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力= 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________ 。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
①Ti的基态原子价电子排布式为
②Fe的基态原子共有
(2)制备CrO2Cl2的反应为K2Cr2O7+3CCl4=2KCl+2CrO2Cl2+3COCl2↑。
①上述化学方程式中非金属元素电负性由大到小的顺序是
②COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为
②已知该晶胞的摩尔质量为Mg·mol-1,密度为dg·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511pm,c=397pm;标准状况下氢气的密度为8.98×10-5g·cm-3;储氢能力=
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为
您最近一年使用:0次
2020-11-12更新
|
346次组卷
|
13卷引用:2016届河北省晋州一中高三上学期期末理综化学试卷
2016届河北省晋州一中高三上学期期末理综化学试卷2016届安徽省安庆一中高三热身考试理综化学试卷2016届湖北省襄阳五中高三5月模拟三理综化学试卷2017届安徽省黄山市屯溪一中高三上月考二化学卷四川省内江市2017届高三第五次模拟考试理综化学试题陕西省师范大学附属中学2017届高三下学期第十一次模考理综化学试题苏教版2017届高三单元精练检测十一化学试题湖北省孝感市八校2018届高三上学期期末考试理综化学试题(已下线)2018年6月1日 押高考化学第35题(2)——《每日一题》2018年高三化学四轮复习(已下线)解密21 物质的结构与性质(教师版)——备战2018年高考化学之高频考点解密(已下线)2019年5月31日《每日一题》四轮复习—— 押高考化学第35题(2)四川省成都附属实验中学2021届高三上学期11月月考理科综合化学试题(已下线)第三单元 物质的聚集状态性质与物质性质(能力提升)-2020-2021学年高二化学单元测试定心卷(鲁科版选修3)
解题方法
5 . 第四周期某些过渡元素在工业生产中有着极其重要的作用。
Ⅰ.中国锰矿资源较多,分布广泛。
(1)写出基态锰原子的价电子排布图:___________ 。
(2) 用于
用于 分解制氧气的催化剂,
分解制氧气的催化剂, 中氧原子的杂化轨道类型为
中氧原子的杂化轨道类型为___________ 。
Ⅱ.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1) 常作净水剂和补铁剂,SO
常作净水剂和补铁剂,SO 的立体构型是
的立体构型是___________ 。
(2)铁氰化钾 是检验
是检验 的重要试剂。
的重要试剂。
①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式___________ 。
②铁氰化钾中存在的化学键有___________ (填字母标号)。
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
Ⅲ.锌在工业中有重要作用,也是人体必需的微量元素。硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图所示。
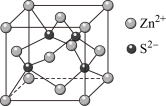
(1)该晶胞中 的配位数为
的配位数为___________ 。
(2)若晶胞参数为 ,则该晶体密度的计算式为
,则该晶体密度的计算式为___________  (用
(用 表示阿伏加德罗常数的值,不用化简)。
表示阿伏加德罗常数的值,不用化简)。
Ⅰ.中国锰矿资源较多,分布广泛。
(1)写出基态锰原子的价电子排布图:
(2)
 用于
用于 分解制氧气的催化剂,
分解制氧气的催化剂, 中氧原子的杂化轨道类型为
中氧原子的杂化轨道类型为Ⅱ.铁被称为“第一金属”,铁及其化合物在生产、生活中有广泛用途。
(1)
 常作净水剂和补铁剂,SO
常作净水剂和补铁剂,SO 的立体构型是
的立体构型是(2)铁氰化钾
 是检验
是检验 的重要试剂。
的重要试剂。①写出一种与铁氰化钾中配体互为等电子体的极性分子的化学式
②铁氰化钾中存在的化学键有
A.离子键 B.σ键 C.π键 D.氢键 E。金属键
Ⅲ.锌在工业中有重要作用,也是人体必需的微量元素。硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图所示。

(1)该晶胞中
 的配位数为
的配位数为(2)若晶胞参数为
 ,则该晶体密度的计算式为
,则该晶体密度的计算式为 (用
(用 表示阿伏加德罗常数的值,不用化简)。
表示阿伏加德罗常数的值,不用化简)。
您最近一年使用:0次
2021-05-18更新
|
258次组卷
|
2卷引用:河北省张家口市2021届高考三模化学试题
解题方法
6 . 公元前,人们曾用硼砂制造玻璃和焊接黄金。现如今硼及其化合物在新材料、功能生产等方面用途依然很广。请回答下列问题:
(1)硼元素的基态原子的价电子排布为___________ ,同周期元素中,未成对电子数与B相同的有___________ (填元素符号);第一电离能在B与N之间的第二周期主族元素有___________ 种。
(2)硼的最简单氢化物-乙硼烷分子中存在两个氢桥键(3中心2电子键),球棍模型如图,由它制取硼氢化锂的反应为 。
。

①乙硼烷分子中硼原子的杂化轨道类型为___________ 。写出一种与 具有相同空间构型的阳离子的化学式为
具有相同空间构型的阳离子的化学式为___________ 。
②根据以上反应判断,其中涉及的元素的电负性从小到大的顺序为___________ (用元素符号表示)。
③硼的最简单氢化物是 而不是
而不是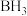 ,其原因是
,其原因是___________ 。
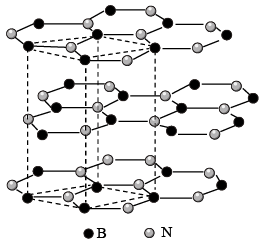
(3)六方氮化硼( )的晶体结构与石墨相似,如图所示。同层
)的晶体结构与石墨相似,如图所示。同层 原子与
原子与 原子最小核间距为
原子最小核间距为 ,相邻层间的距离为
,相邻层间的距离为 ,该晶体的密度计算式为
,该晶体的密度计算式为___________  (用含d、h、NA的代数式表示)。
(用含d、h、NA的代数式表示)。
(1)硼元素的基态原子的价电子排布为
(2)硼的最简单氢化物-乙硼烷分子中存在两个氢桥键(3中心2电子键),球棍模型如图,由它制取硼氢化锂的反应为
 。
。
①乙硼烷分子中硼原子的杂化轨道类型为
 具有相同空间构型的阳离子的化学式为
具有相同空间构型的阳离子的化学式为②根据以上反应判断,其中涉及的元素的电负性从小到大的顺序为
③硼的最简单氢化物是
 而不是
而不是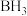 ,其原因是
,其原因是(3)六方氮化硼(
 )的晶体结构与石墨相似,如图所示。同层
)的晶体结构与石墨相似,如图所示。同层 原子与
原子与 原子最小核间距为
原子最小核间距为 ,相邻层间的距离为
,相邻层间的距离为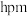 ,该晶体的密度计算式为
,该晶体的密度计算式为 (用含d、h、NA的代数式表示)。
(用含d、h、NA的代数式表示)。
您最近一年使用:0次
解题方法
7 . 铜的化合物用途非常广泛。已知下列反应:[Cu(NH3)2]++NH3+CO ⇌ [Cu(NH3)3CO]+,2CH3COOH +2CH2=CH2+O2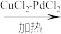 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。
(1)Cu2+基态核外电子排布式为______ 。
(2)NH3分子空间构型为_______ , 其中心原子的杂化类型是______ 。
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是_______ ,1mol CH3COOCH=CH2中含 键数目为
键数目为_____ 。
(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为__________ 。
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构示意图表示为____
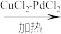 2CH3COOCH=CH2+2H2O。
2CH3COOCH=CH2+2H2O。(1)Cu2+基态核外电子排布式为
(2)NH3分子空间构型为
(3)CH3COOCH=CH2分子中碳原子轨道的杂化类型是
 键数目为
键数目为(4)CH3COOH可与H2O混溶,除因为它们都是极性分子外,还因为
(5)配离子[Cu(NH3)3CO]+中NH3及CO中的C与Cu(Ⅰ)形成配位键。不考虑空间构型,[Cu(NH3)3CO]+的结构示意图表示为
您最近一年使用:0次
名校
解题方法
8 . 铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式为________ 。
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
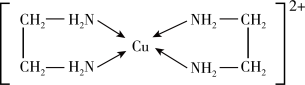
①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有________ 。
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为________ ,C、N、H三种元素的电负性由大到小顺序是 ___ 。
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是________ 。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是______ 。
(4)Cu和S形成某种晶体的晶胞如图所示。
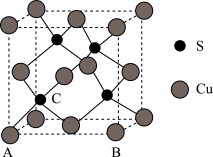
①该晶体的化学式为________ 。
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为________
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率________ 。
(1)铜元素基态原子的价电子排布式为
(2)铜元素能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。

①Cu2+与乙二胺所形成的配离子内部粒子间的作用力类型有
A.配位键 B.极性键 C.离子键 D.非极性键 E.氢键 F.金属键
②乙二胺分子中氮原子的杂化轨道类型为
③乙二胺和三甲胺 [N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是
(4)Cu和S形成某种晶体的晶胞如图所示。

①该晶体的化学式为
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为
③已知该晶体的密度为 dg•cm-3,Cu2+和S2-的半径分别为apm和bpm,阿伏加 德罗常数值为NA。列式表示该晶体中原子的空间利用率
您最近一年使用:0次
2020-09-01更新
|
805次组卷
|
4卷引用:河北省河北衡水中学2021届高三下学期第二次调研考试化学试题
名校
解题方法
9 . 张亭栋研究小组受民间中医启发,发现As2O3(俗称砒霜)对白血病有明显的治疗作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,该族元素的化合物在研究和生产中有许多重要用途。回答下列问题:
(1)As原子的核外电子排布式为_____ 。
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是_____ 。
(3) 中H-N-H的键角比NH3中H-N-H的键角
中H-N-H的键角比NH3中H-N-H的键角_____ (填“大”或“小”)
(4)Na3AsO4中含有的化学键类型包括_____ ; 的空间构型为
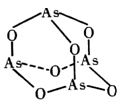
的空间构型为_____ ,As4O6的分子结构如图所示,则在该化合物中As的杂化方式是_____ 。
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是____ 晶体。
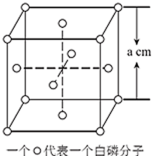
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为a cm,阿伏加 德罗常数为NAmol﹣l,该晶体的密度为_____ g•cm﹣3(用含NA、a的式子表示)。
(1)As原子的核外电子排布式为
(2)P和S是同一周期的两种元素,P的第一电离能比S大,原因是
(3)
 中H-N-H的键角比NH3中H-N-H的键角
中H-N-H的键角比NH3中H-N-H的键角(4)Na3AsO4中含有的化学键类型包括
 的空间构型为
的空间构型为
(5)化合物NH5中的所有原子最外层都满足稳定结构,则NH5是
(6)白磷(P4)的晶体属于分子晶体,其晶胞结构如图(小圆圈表示白磷分子)。已知晶胞的边长为a cm,阿伏加 德罗常数为NAmol﹣l,该晶体的密度为

您最近一年使用:0次
2020-08-13更新
|
40次组卷
|
2卷引用:河北省鸡泽县第一中学2021届高三上学期第一次月考化学试题
解题方法
10 . 氮及其化合物有许多用途。回答下列问题:
(1)基态 原子的电子排布式为
原子的电子排布式为________ ,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________ 。
(2) 的沸点(71℃)比
的沸点(71℃)比 的沸点(25.7℃)高,主要原因是
的沸点(25.7℃)高,主要原因是______________________ 。
(3)根据价层电子对互斥理论, 、
、 、
、 三种微粒中,中心原子价层电子对数不同于其他微粒的是
三种微粒中,中心原子价层电子对数不同于其他微粒的是_______ 。
(4) (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为 (列出计算式)。
(列出计算式)。________________________________________________________

(1)基态
 原子的电子排布式为
原子的电子排布式为(2)
 的沸点(71℃)比
的沸点(71℃)比 的沸点(25.7℃)高,主要原因是
的沸点(25.7℃)高,主要原因是(3)根据价层电子对互斥理论,
 、
、 、
、 三种微粒中,中心原子价层电子对数不同于其他微粒的是
三种微粒中,中心原子价层电子对数不同于其他微粒的是(4)
 (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为 (列出计算式)。
(列出计算式)。
您最近一年使用:0次



