解题方法
1 . 甲醇(CH3OH)是一种用途广泛的基础有机原料和优质燃料。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为_______ ,其核外电子共占据_______ 个能级。
②甲醇和甲醛中碳原子的杂化方式分别为_______ ,其组成元素的电负性由小到大的顺序为_______ 。
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为_______ 。
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为_______ 。
(1)甲醇可以在铜作催化剂的条件下直接氧化成甲醛(HCHO)
①基态Cu原子的价层电子的轨道表达式为
②甲醇和甲醛中碳原子的杂化方式分别为
(2)在一定条件下,甲醇(沸点64.7 ℃)可转化为乙酸甲酯(CH3COOCH3,沸点57.1 ℃)。
①乙酸甲酯分子σ键和π的个数之比为
②甲醇与乙酸甲酯的混合物因沸点接近而不易分离,工业上用蒸馏的方法分离二者时常先加适量水,理由为
您最近一年使用:0次
名校
2 . (Ⅰ)如图所示为高温超导领域里的一种化合物——钙钛矿晶胞结构,该结构是具有代表性的最小重复单位。

(1)该晶胞结构中,元素氧、钛、钙的离子个数比是___________ ,该物质的化学式可表示为___________ 。
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶胞结构图中正方体边长(钛原子之间的距离)为 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞的密度为
,则该晶胞的密度为___________  。
。
(Ⅱ)氮化碳的结构如下图所示:已知氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定。

(3)氮化硅的硬度___________ (填“大于”或“小于”)氮化碳的硬度,原因是___________ ;
(4)已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足最外层8电子稳定结构,请写出氮化硅的化学式:___________ 。
(5)第ⅢA、ⅤA族元素组成的化合物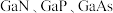 等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在
等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在 晶体中与同一个
晶体中与同一个 原子相连的N原子构成的空间构型为
原子相连的N原子构成的空间构型为___________ , 属于
属于___________ 晶体。

(1)该晶胞结构中,元素氧、钛、钙的离子个数比是
(2)若钙、钛、氧三元素的相对原子质量分别为a、b、c,晶胞结构图中正方体边长(钛原子之间的距离)为
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则该晶胞的密度为
,则该晶胞的密度为 。
。(Ⅱ)氮化碳的结构如下图所示:已知氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定。

(3)氮化硅的硬度
(4)已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足最外层8电子稳定结构,请写出氮化硅的化学式:
(5)第ⅢA、ⅤA族元素组成的化合物
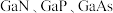 等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在
等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在 晶体中与同一个
晶体中与同一个 原子相连的N原子构成的空间构型为
原子相连的N原子构成的空间构型为 属于
属于
您最近一年使用:0次
名校
解题方法
3 . 已知:红磷在氯气中燃烧可以生成两种化合物:PCl3和PCl5,PCl5分子中,P原子的1个3s轨道、3个3p轨道和1个3d轨道发生杂化形成5个sp3d杂化轨道;PCl5分子呈三角双锥形,其结构如图1所示:

(1)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是_______ 。
(2)下列关于PCl5分子的说法正确的有 _______。
(3)PCl5是一种白色晶体,熔融时形成一种能导电的液体,测得其中含有一种正四面体形阳离子和一种 正八面体形阴离子,该晶体的晶胞如图2所示,熔体中P﹣Cl的键长只有198nm和206nm两种,这两种离子的化学式为 _______ 。

(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因_______ 。

(1)N、P是同一族元素,P能形成PCl3、PCl5两种氯化物,而N只能形成一种氯化物NCl3,而不能形成NCl5,原因是
(2)下列关于PCl5分子的说法正确的有 _______。
| A.PCl5分子中磷原子没有孤对电子 |
| B.PCl5分子中没有形成π键 |
| C.PCl5分子中所有的Cl﹣P﹣Cl键角都相等 |
| D.SF4分子中S原子也采取sp3d杂化 |

(4)PBr5气态分子的结构与PCl5相似,它的熔体也能导电,经测定知其中只存在一种P-Br键长,试用电离方程式解释PBr5熔体能导电的原因
您最近一年使用:0次
4 . 钒的化合物能有效调节血糖,化合物丁有望成为抗糖尿病的新型药物,其制备流程如下:
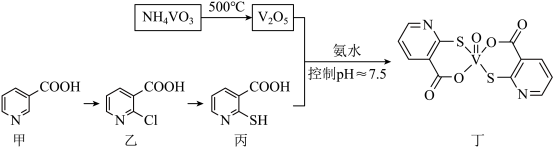
(1)钒在元素周期表中的位置为_______ ,基态V的原子结构示意图为_______ 。
(2) 转化为
转化为 的化学方程式是
的化学方程式是_______ 。
(3)下列说法正确的是_______(填字母)
(4)分析丙的分子结构与性质
①比较丙中 键角和
键角和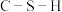 键角的大小并解释原因:
键角的大小并解释原因:_______
②丙为有机弱酸,请写出1mol丙与2mol一水合氨反应的离子方程式_______ 。
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域 键”,下列物质中存在“离域
键”,下列物质中存在“离域 键”的是_______。
键”的是_______。
(6)丁是一种配合物含有化合物丁的样品中,含钒量的测定方法是:先把样品中的钒元素经处理转化为 溶液,再用硫酸酸化的
溶液,再用硫酸酸化的 标准溶液进行滴定,生成
标准溶液进行滴定,生成 。取样品10.2g,用上述方法测定其中钒的含量,消耗
。取样品10.2g,用上述方法测定其中钒的含量,消耗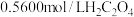 标准溶液25.00mL,则样品中钒元素的质量分数为
标准溶液25.00mL,则样品中钒元素的质量分数为_______ (写出计算结果)。

(1)钒在元素周期表中的位置为
(2)
 转化为
转化为 的化学方程式是
的化学方程式是(3)下列说法正确的是_______(填字母)
A.元素的第一电离能: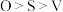 |
B.共价键的极性:丙中 乙中 乙中 |
| C.甲分子中所有原子可能在同一平面内 |
D.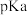 :乙>甲 :乙>甲 |
①比较丙中
 键角和
键角和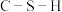 键角的大小并解释原因:
键角的大小并解释原因:②丙为有机弱酸,请写出1mol丙与2mol一水合氨反应的离子方程式
(5)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域
 键”,下列物质中存在“离域
键”,下列物质中存在“离域 键”的是_______。
键”的是_______。A. | B. | C. | D. |
 溶液,再用硫酸酸化的
溶液,再用硫酸酸化的 标准溶液进行滴定,生成
标准溶液进行滴定,生成 。取样品10.2g,用上述方法测定其中钒的含量,消耗
。取样品10.2g,用上述方法测定其中钒的含量,消耗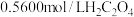 标准溶液25.00mL,则样品中钒元素的质量分数为
标准溶液25.00mL,则样品中钒元素的质量分数为
您最近一年使用:0次
解题方法
5 . 下表为元素周期表的一部分,其中的编号代表对应的元素。
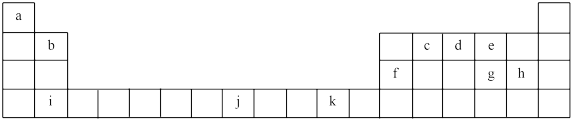
请回答下列问题:
(1)表中属于d区的元素是_______ (填元素名称),其形成的常见阳离子中化学性质较稳定的是_______ (填离子符号)。
(2)e基态原子中能量最高的电子,其电子云轮廓图的取向有_______ 个。
(3)下列状态的f的微粒中,电离最外层的一个电子所需能量最小的是_______(填序号)。
(4)某种离子化合物由a、d两元素形成,猜测其电子式为_______ 。
(5)与k同周期的所有元素的基态原子中未成对电子数最多的是_______ (填元素符号),写出该元素的基态原子的价电子排布式:_______ 。
(6)常温下,液态化合物geh2与水剧烈反应,产生能使品红溶液褪色的ge2气体,向反应后的溶液中加入AgNO3溶液,有不溶于稀硝酸的白色沉淀析出。根据实验现象,写出geh2与水反应的化学方程式_______ 。
(7)碱性条件下,ca4燃料电池的负极反应式为:_______ 。
(8)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为_______ ,下列对XeF2中心原子杂化方式推断合理的是_______ (填标号)。
A.sp B.sp2 C.sp3 D.sp3d

请回答下列问题:
(1)表中属于d区的元素是
(2)e基态原子中能量最高的电子,其电子云轮廓图的取向有
(3)下列状态的f的微粒中,电离最外层的一个电子所需能量最小的是_______(填序号)。
| A.[Ne] | B.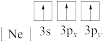 | C.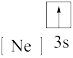 | D. |
(5)与k同周期的所有元素的基态原子中未成对电子数最多的是
(6)常温下,液态化合物geh2与水剧烈反应,产生能使品红溶液褪色的ge2气体,向反应后的溶液中加入AgNO3溶液,有不溶于稀硝酸的白色沉淀析出。根据实验现象,写出geh2与水反应的化学方程式
(7)碱性条件下,ca4燃料电池的负极反应式为:
(8)Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为
A.sp B.sp2 C.sp3 D.sp3d
您最近一年使用:0次
名校
解题方法
6 . H与O可以形成H2O和H2O2两种化合物。请回答:
(1)H+可与H2O形成H3O+,H3O+的空间构型名称为_____ 。
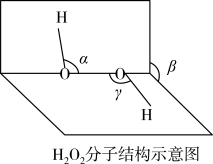
(2)H2O2分子结构如图所示,α、β、γ中相等的角是_____ ,H2O2是_____ 分子(填“极性”或“非极性”)。H2O2晶体中有4种作用力:①O-O键、②O-H键、③范德华力、④氢键,这4种作用力由强到弱依次为:_____ (用序号表示)。
(3)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是_____ 。
A.Al3+ B.Mg2+ C.Cu2+ D.Mn2+ E.Fe2+
(4)实验测得,25℃时H2O2的pKa1小于H2O的pKa(pKa=-lgKa),原因是_____ (运用物质结构原理解释)。
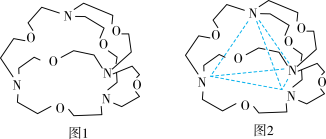
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是_____ (填标号)。
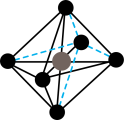
(6)SF6分子的空间结构为正八面体形,如图所示。1molSF6中含有_____ molS-F键,它的二氯代物SF4Cl2有_____ 种。
(1)H+可与H2O形成H3O+,H3O+的空间构型名称为
(2)H2O2分子结构如图所示,α、β、γ中相等的角是

(3)哈勃-韦斯(Haber-Weiss)原理表明,某些金属离子可以催化双氧水分解的原因是:其次外层未排满的d轨道可以存取电子,降低活化能,使分解反应容易发生。根据以上原理,下列金属离子不能催化双氧水分解的是
A.Al3+ B.Mg2+ C.Cu2+ D.Mn2+ E.Fe2+
(4)实验测得,25℃时H2O2的pKa1小于H2O的pKa(pKa=-lgKa),原因是
(5)图1表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的4个顶点(见图2),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是

| A.CCl4 | B.CH4 | C.NH | D.H2O |

您最近一年使用:0次
名校
解题方法
7 . 回答下列问题:
(1)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。铝原子核外有_____ 种不同空间运动状态的电子,其最高能级的电子云形状为_____ 。
(2)过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
①对于基态Cr原子,下列叙述正确的是_____ (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
②[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
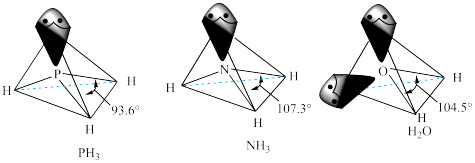
PH3中P的杂化类型是_____ ,H2O的键角小于NH3的,分析原因:_____ 。
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π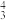 ,则
,则 (咪唑)中的“离域π键”可表示为
(咪唑)中的“离域π键”可表示为________ 。
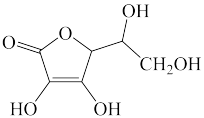
(4)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为_____ ;推测抗坏血酸在水中的溶解性:_____ (填“难溶”或“易溶”)于水;坏血酸分子_____ (填“是”或“不是”)手性分子。
(1)金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。铝原子核外有
(2)过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
①对于基态Cr原子,下列叙述正确的是
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
②[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。

PH3中P的杂化类型是
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”,如SO2分子中存在“离域π键”,可表示成π
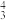 ,则
,则 (咪唑)中的“离域π键”可表示为
(咪唑)中的“离域π键”可表示为(4)抗坏血酸的分子结构如图所示,分子中碳原子的轨道杂化类型为

您最近一年使用:0次
解题方法
8 . 我国政府承诺要在2030年前实现碳达峰, 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
(1) 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
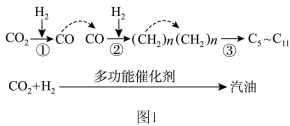
下列对该反应过程的说法正确的是_______ (填标号)。
A.整个反应过程中,有非极性键和极性键的断裂和形成
B. 中C原子的杂化类型为sp
中C原子的杂化类型为sp
C.汽油为纯净物
(2)已知 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
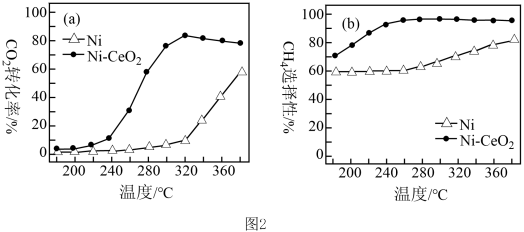
①四羰基镍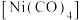 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为_______ 。
②以Ni为催化剂,高于320℃后,单位时间内 转化率上升的原因是
转化率上升的原因是_______ ;工业上应选择的催化剂是_______ 。
(3)以 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:
Ⅰ.

Ⅱ.

①反应

_______ 。(用含 和
和 的代数式表示)
的代数式表示)
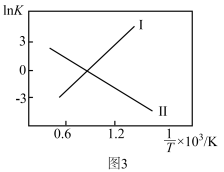
②反应Ⅰ、Ⅱ的 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将_______ (填“增大”、“减小”或“不变”,下同),CO的含量将_______ 。
③某温度下往恒容密闭容器中充入1 mol 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
_______ (用平衡分压代替平衡浓度,分压=总压 物质的量分数)。
物质的量分数)。
 相关转化的研究对解决环境、能源问题意义重大。回答下列问题:
相关转化的研究对解决环境、能源问题意义重大。回答下列问题:(1)
 催化加氢制取汽油时,
催化加氢制取汽油时, 的转化过程如图1:
的转化过程如图1:
下列对该反应过程的说法正确的是
A.整个反应过程中,有非极性键和极性键的断裂和形成
B.
 中C原子的杂化类型为sp
中C原子的杂化类型为spC.汽油为纯净物
(2)已知
 甲烷化技术的反应原理为
甲烷化技术的反应原理为
 ,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得
,该技术的核心是催化剂的选择。其他条件均相同,在两种不同催化剂条件下反应相同时间,测得 转化率和
转化率和 选择性随温度变化的曲线如图2所示。
选择性随温度变化的曲线如图2所示。
①四羰基镍
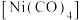 是镍的一种配合物,该配合物中中心原子的配位数为
是镍的一种配合物,该配合物中中心原子的配位数为②以Ni为催化剂,高于320℃后,单位时间内
 转化率上升的原因是
转化率上升的原因是(3)以
 、
、 为原料合成
为原料合成 涉及的主要反应如下:
涉及的主要反应如下:Ⅰ.


Ⅱ.


①反应


 和
和 的代数式表示)
的代数式表示)②反应Ⅰ、Ⅱ的
 (K代表化学平衡常数)随
(K代表化学平衡常数)随 (温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中
(温度的倒数)的变化如图3所示。据图判断,升高温度时,体系中 的含量将
的含量将
③某温度下往恒容密闭容器中充入1 mol
 和3 mol
和3 mol  ,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的
,恒温条件下仅发生反应Ⅰ,平衡时混合气体的总压(此时总压为p)为起始总压的 ,该反应的压强平衡常数
,该反应的压强平衡常数
 物质的量分数)。
物质的量分数)。
您最近一年使用:0次
2023-01-02更新
|
366次组卷
|
3卷引用:湖北省十堰市2023届高三元月调研考试化学试题
解题方法
9 . 已知和氮元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y的原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是 。试回答:
。试回答:
(1)X元素的基态原子的核外电子排布式为_________ ,Y元素原子价电子排布图(也叫轨道表示式)为_________ 。
(2)X、Y两元素之间形成的化学键为_________ (填“共价键”或“离子键”)。
(3) 的空间结构为
的空间结构为_________ 形,中心原子采取_________ 杂化,分子为_________ (填“极性分子”或“非极性分子”)。
(4) 的沸点与
的沸点与 比较:
比较:_________ (填化学式)的高,原因_________ 。
 。试回答:
。试回答:(1)X元素的基态原子的核外电子排布式为
(2)X、Y两元素之间形成的化学键为
(3)
 的空间结构为
的空间结构为(4)
 的沸点与
的沸点与 比较:
比较:
您最近一年使用:0次
10 . 据报道,我国化学研究人员用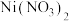 和
和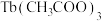 等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
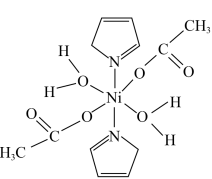
请回答下列问题:
(1)基态 原子的价电子排布式为
原子的价电子排布式为_______ , 在元素周期表中的位置是
在元素周期表中的位置是_______ 。
(2)C、N、O三种元素第一电离能最大的是_______ (填元素符号)。
(3)镍的一维链状配位聚合物中,碳原子的杂化方式为_______ 。已知: 的沸点为117.9℃,
的沸点为117.9℃,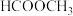 的沸点为32℃。
的沸点为32℃。 的沸点高于
的沸点高于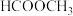 的沸点的主要原因是
的沸点的主要原因是_______ 。
(4)氧化镍的晶胞结构如图所示。若 为阿伏加德罗常数的值,晶胞中最近的
为阿伏加德罗常数的值,晶胞中最近的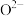 之间的距离为anm,则氧化镍的密度为
之间的距离为anm,则氧化镍的密度为_______ 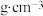 。
。

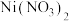 和
和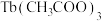 等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
等合成了一个镍的一维链状配位聚合物(如图),对镍配合物在磁性、电化学性质等方面的研究提出了理论指导。
请回答下列问题:
(1)基态
 原子的价电子排布式为
原子的价电子排布式为 在元素周期表中的位置是
在元素周期表中的位置是(2)C、N、O三种元素第一电离能最大的是
(3)镍的一维链状配位聚合物中,碳原子的杂化方式为
 的沸点为117.9℃,
的沸点为117.9℃,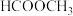 的沸点为32℃。
的沸点为32℃。 的沸点高于
的沸点高于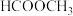 的沸点的主要原因是
的沸点的主要原因是(4)氧化镍的晶胞结构如图所示。若
 为阿伏加德罗常数的值,晶胞中最近的
为阿伏加德罗常数的值,晶胞中最近的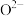 之间的距离为anm,则氧化镍的密度为
之间的距离为anm,则氧化镍的密度为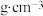 。
。
您最近一年使用:0次



