1 . 用富含铁元素的食品,可以补充人体所需的铁元素。某班级研究性学习小组对菠菜中的铁元素展开了检测,实验如下:

(1)下列图示装置或操作合理的是________ 。
(2)写出试剂B的化学式___________ 。
(3)试剂C若为双氧水,请写出该反应的离子方程式:___________ ;该实验证明菠菜中含有的铁元素为_____ 价。
(4)其中一名同学在研究过程中向滤液A中先加入氯水,再加入试剂B,也看到溶液变红,由此也得出和其他同学一样的结论。他的做法是否正确?______ ,原因是什么?___________ 。
(5)另取少量滤液 ,向其中加入少量NaOH溶液,观察到的现象是
,向其中加入少量NaOH溶液,观察到的现象是________ ;原因是___________ 、________ (用离子方程式解释)。

(1)下列图示装置或操作合理的是
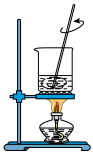 | 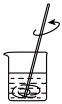 | 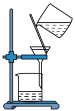 |  |
| A.灼烧 | B.溶解 | C.过滤 | D.检测菠菜液中的铁元素 |
(2)写出试剂B的化学式
(3)试剂C若为双氧水,请写出该反应的离子方程式:
(4)其中一名同学在研究过程中向滤液A中先加入氯水,再加入试剂B,也看到溶液变红,由此也得出和其他同学一样的结论。他的做法是否正确?
(5)另取少量滤液
 ,向其中加入少量NaOH溶液,观察到的现象是
,向其中加入少量NaOH溶液,观察到的现象是
您最近一年使用:0次
名校
2 . 实验室常采用点滴板来完成部分实验,这样既可以节约药品的用量,又便于观察实验现象。图中所示的实验点滴板上描述的实验现象或推论正确的是


A.往 固体中滴加 固体中滴加 溶液,有气体产生且生成大量的白色沉淀 溶液,有气体产生且生成大量的白色沉淀 |
| B.新制氯水滴加到pH试纸或淀粉KI溶液孔穴中,都体现新制氯水的漂白性 |
C.生锈铁屑加过量稀硫酸后,通过滴加 溶液的褪色来验证原溶液中存在 溶液的褪色来验证原溶液中存在 |
D.生锈铁屑加过量稀硫酸后,若滴加KSCN溶液变成血红色可验证原溶液存在 |
您最近一年使用:0次
3 . 室温下,探究0.1mol/LFeSO4溶液的性质,下列实验方案能达到探究目的的是
| 选项 | 探究目的 | 实验方案 |
| A | Fe2+能否催化H2O2分解 | 向2mL5%H2O2溶液中滴加几滴FeSO4溶液,观察气泡产生情况 |
| B | 溶液中是否含有Fe2+ | 向2mLFeSO4溶液中滴加几滴新制氯水,再滴加KSCN溶液,观察溶液颜色变化 |
| C | Fe2+是否水解 | 向2mLFeSO4溶液中滴加2~3滴酚酞试液,观察溶液颜色变化 |
| D | Fe2+是否有还原性 | 向2mLFeSO4溶液中滴加几滴酸性KMnO4溶液,观察溶液颜色变化 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
4 . 为测定某补血剂样品(主要成分是硫酸亚铁晶体 )中铁元素的含量,某学兴趣小组设计了如下实验方案:
)中铁元素的含量,某学兴趣小组设计了如下实验方案:
方案一:将 转化为
转化为 ,测定质量变化.
,测定质量变化.
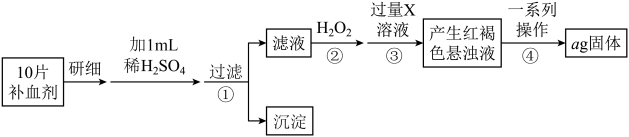
(1)写出步骤②中发生的反应的离子方程式__________________________
(2)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量,写出发生反应的化学方程式_______________________________ .
(3)假设实验无损耗,则每片补血剂含铁元素的质量为____________ g(用含a的代数式表示)。
方案二:用酸性 溶液滴定测定铁元素的含量
溶液滴定测定铁元素的含量
实验前,首先要准确配制 的酸性
的酸性 溶液250mL
溶液250mL
(4)计算所需 固体的质量为
固体的质量为____________ g.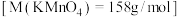
(5)配制溶液时,必须用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、________________
(6)配制过程中,下列操作导致溶液浓度偏小的是(填序号)_______
A.加水定容时俯视刻度线
B.定容加水时超过刻度线后,立即吸出多余的水
C.溶液从烧杯转移到容量瓶后没有洗涤烧杯
(7)若某同学取5片补血剂样品配成100mL溶液,取20.00mL,用上述操作配置的 溶液滴定,耗去
溶液滴定,耗去 ,反应的离子方程式为
,反应的离子方程式为______________________ ,每片补血剂含铁元素的质量____________ g(用代数式表示).
 )中铁元素的含量,某学兴趣小组设计了如下实验方案:
)中铁元素的含量,某学兴趣小组设计了如下实验方案:方案一:将
 转化为
转化为 ,测定质量变化.
,测定质量变化.
(1)写出步骤②中发生的反应的离子方程式
(2)步骤④中一系列操作依次是:过滤、洗涤、灼烧、冷却、称量,写出发生反应的化学方程式
(3)假设实验无损耗,则每片补血剂含铁元素的质量为
方案二:用酸性
 溶液滴定测定铁元素的含量
溶液滴定测定铁元素的含量实验前,首先要准确配制
 的酸性
的酸性 溶液250mL
溶液250mL(4)计算所需
 固体的质量为
固体的质量为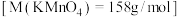
(5)配制溶液时,必须用到的玻璃仪器有烧杯、量筒、玻璃棒、胶头滴管、
(6)配制过程中,下列操作导致溶液浓度偏小的是(填序号)
A.加水定容时俯视刻度线
B.定容加水时超过刻度线后,立即吸出多余的水
C.溶液从烧杯转移到容量瓶后没有洗涤烧杯
(7)若某同学取5片补血剂样品配成100mL溶液,取20.00mL,用上述操作配置的
 溶液滴定,耗去
溶液滴定,耗去 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
名校
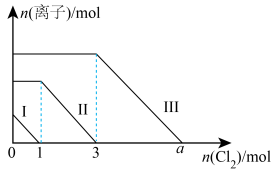
5 . 向 、
、 的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示(已知:
的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示(已知: 、
、 、
、 )。下列说法正确的是
)。下列说法正确的是
 、
、 的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示(已知:
的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示(已知: 、
、 、
、 )。下列说法正确的是
)。下列说法正确的是
A. |
B.折线II表示 的变化情况,折线III表示 的变化情况,折线III表示 的变化情况 的变化情况 |
C.若 ,溶液中发生离子反应: ,溶液中发生离子反应: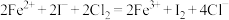 |
D.原溶液中 |
您最近一年使用:0次
2023-12-23更新
|
237次组卷
|
2卷引用:湖南省长沙市名校联合体2023-2024学年高一上学期第二次联考化学试题
6 . 对于下列实验,能正确描述其反应的离子方程式是
A.向饱和碳酸钠溶液中通入过量 : : |
B.向 溶液中通入过量的 溶液中通入过量的 : :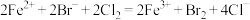 |
C.漂白粉溶液中通入少量 气体: 气体: |
D.向 溶液中加入 溶液中加入 : : |
您最近一年使用:0次
名校
7 . 硫酸锰是一种重要的化工中间体,是锰行业研究的热点。工业以软锰矿(主要成分是 ,含有
,含有 、
、 等少量杂质)为主要原料制备
等少量杂质)为主要原料制备 。其工业流程如图:
。其工业流程如图:

(1)为了提高浸锰的浸取率可采取的措施是_______ (任写一条),滤渣Ⅱ为_______ 。
(2)浸锰过程中 与
与 反应的离子方程式为
反应的离子方程式为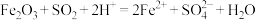 ,该反应是经历以下两步反应实现的:
,该反应是经历以下两步反应实现的:
Ⅰ.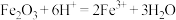
Ⅱ.……
写出Ⅱ的离子方程式:_______ 。
(3)过滤1所得滤液中主要存在的金属阳离子为_______ (填离子符号)。
(4)氧化过程中被 氧化的主要微粒为
氧化的主要微粒为_______ 。
(5)加入 溶液后,生成
溶液后,生成 沉淀,同时还有气体生成,写出反应的离子方程式:
沉淀,同时还有气体生成,写出反应的离子方程式:_______ 。
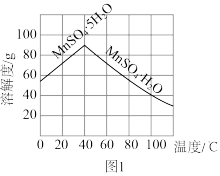
(6)已知 的溶解度曲线如图1所示,从酸溶后析出
的溶解度曲线如图1所示,从酸溶后析出 晶体的“系列操作”是
晶体的“系列操作”是_______ 、洗涤、低温干燥。
(7)通过锻烧 可制得软磁铁氧体材料
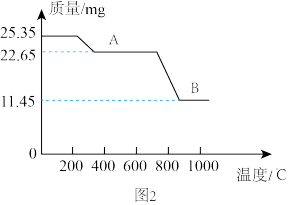
可制得软磁铁氧体材料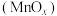 ,在不同温度下锻烧
,在不同温度下锻烧 时剩余质量变化的曲线如图2所示,根据图2中数据可得
时剩余质量变化的曲线如图2所示,根据图2中数据可得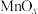 中
中 的值为
的值为_______ 。
 ,含有
,含有 、
、 等少量杂质)为主要原料制备
等少量杂质)为主要原料制备 。其工业流程如图:
。其工业流程如图:
(1)为了提高浸锰的浸取率可采取的措施是
(2)浸锰过程中
 与
与 反应的离子方程式为
反应的离子方程式为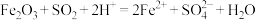 ,该反应是经历以下两步反应实现的:
,该反应是经历以下两步反应实现的:Ⅰ.
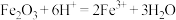
Ⅱ.……
写出Ⅱ的离子方程式:
(3)过滤1所得滤液中主要存在的金属阳离子为
(4)氧化过程中被
 氧化的主要微粒为
氧化的主要微粒为(5)加入
 溶液后,生成
溶液后,生成 沉淀,同时还有气体生成,写出反应的离子方程式:
沉淀,同时还有气体生成,写出反应的离子方程式:(6)已知
 的溶解度曲线如图1所示,从酸溶后析出
的溶解度曲线如图1所示,从酸溶后析出 晶体的“系列操作”是
晶体的“系列操作”是
(7)通过锻烧
 可制得软磁铁氧体材料
可制得软磁铁氧体材料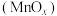 ,在不同温度下锻烧
,在不同温度下锻烧 时剩余质量变化的曲线如图2所示,根据图2中数据可得
时剩余质量变化的曲线如图2所示,根据图2中数据可得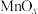 中
中 的值为
的值为
您最近一年使用:0次
8 . 乳酸亚铁晶体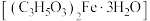 是一种吸收效果很好的食品铁强化剂,易溶于水,难溶于乙醇。某兴趣小组用废铁屑(部分被氧化)制备
是一种吸收效果很好的食品铁强化剂,易溶于水,难溶于乙醇。某兴趣小组用废铁屑(部分被氧化)制备 ,再与乳酸反应制得乳酸亚铁晶体。
,再与乳酸反应制得乳酸亚铁晶体。
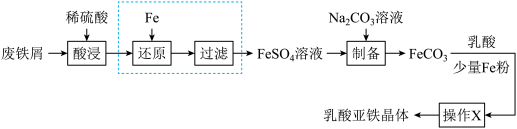
(1)“酸浸”时, 单质发生反应的离子方程式有
单质发生反应的离子方程式有___________ 。
(2)向酸浸液中滴加___________ (填化学式)溶液可判断是否要进行“还原”、“过滤”操作;在实验室中进行过滤操作需要的玻璃仪器有___________ 。
(3)制备过程中将 溶液加入
溶液加入 溶液中制得
溶液中制得 。
。
①该反应的离子方程式为___________ 。
②若 置于空气中时间过长,表面生成
置于空气中时间过长,表面生成 ,其原因是
,其原因是___________ (用化学方程式表示)。
(4) 与乳酸反应过程中加入少量铁粉的目的是
与乳酸反应过程中加入少量铁粉的目的是___________ 。
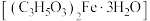 是一种吸收效果很好的食品铁强化剂,易溶于水,难溶于乙醇。某兴趣小组用废铁屑(部分被氧化)制备
是一种吸收效果很好的食品铁强化剂,易溶于水,难溶于乙醇。某兴趣小组用废铁屑(部分被氧化)制备 ,再与乳酸反应制得乳酸亚铁晶体。
,再与乳酸反应制得乳酸亚铁晶体。
(1)“酸浸”时,
 单质发生反应的离子方程式有
单质发生反应的离子方程式有(2)向酸浸液中滴加
(3)制备过程中将
 溶液加入
溶液加入 溶液中制得
溶液中制得 。
。①该反应的离子方程式为
②若
 置于空气中时间过长,表面生成
置于空气中时间过长,表面生成 ,其原因是
,其原因是(4)
 与乳酸反应过程中加入少量铁粉的目的是
与乳酸反应过程中加入少量铁粉的目的是
您最近一年使用:0次
名校
解题方法
9 . 下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中: 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、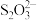 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO 、I-、Cl-
、I-、Cl-
①无色溶液中:K+、Na+、Cu2+、OH-
②pH=11的溶液中:
 、Na+、[Al(OH)4]-、
、Na+、[Al(OH)4]-、
③加入Al能放出H2的溶液中:Cl-、
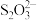 、
、 、
、
④由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、Br-
⑤有较多Fe3+的溶液中:Na+、
 、SCN-、
、SCN-、
⑥酸性溶液中:Fe2+、Al3+、NO
 、I-、Cl-
、I-、Cl-| A.①② | B.③⑥ | C.②④ | D.③⑤ |
您最近一年使用:0次
2023-08-26更新
|
1314次组卷
|
3卷引用:第1课时 离子反应发生的条件
名校
解题方法
10 . 向仅含Fe2+、I-、Br-的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知:b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法错误的是
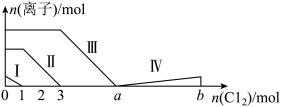

| A.线段Ⅰ、Ⅱ、Ⅲ、Ⅳ分别代表I-、Fe2+、Br-、HIO3的变化情况 |
| B.Fe2+、I-和Br-的物质的量之比为1∶2∶3 |
| C.根据图像可计算b=11 |
| D.线段Ⅳ对应的反应中氧化剂和还原剂的物质的量之比是5∶1 |
您最近一年使用:0次
2023-08-14更新
|
495次组卷
|
3卷引用:河北省迁安市第一中学2022-2023学年高三上学期期中考试化学试题



