名校
解题方法
1 . 元素周期表在学习、研究和生产实践中有很重要的作用。下表显示了元素周期表中的短周期,①~⑤代表5种元素。

(1)②在元素周期表中的位置是_________________________ 。
(2)⑤的最高价氧化物对应的水化物的化学式是_____________________________ 。
(3)①和⑤可形成共价化合物,用电子式表示其形成过_____________________ 。
(4)①分别与④、⑤形成的化合物中,稳定性强的是_____________ (用化学式表示),从原子结构角度解释原因_____________________________ 。
(5)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是_____________________________ 。
(6)元素 的原子结构示意图为
的原子结构示意图为 。下列推断正确的是 (填序号)。
。下列推断正确的是 (填序号)。
(7) 在一定条件下可与
在一定条件下可与  溶液反应,生成一种正盐和水,该正盐化学式为
溶液反应,生成一种正盐和水,该正盐化学式为_________________ 。

(1)②在元素周期表中的位置是
(2)⑤的最高价氧化物对应的水化物的化学式是
(3)①和⑤可形成共价化合物,用电子式表示其形成过
(4)①分别与④、⑤形成的化合物中,稳定性强的是
(5)③和④分别形成的最高价氧化物对应的水化物可以发生反应,离子方程式是
(6)元素
 的原子结构示意图为
的原子结构示意图为 。下列推断正确的是 (填序号)。
。下列推断正确的是 (填序号)。A. 位于第四周期、与④同主族 位于第四周期、与④同主族 | B. 的最低负化合价为 的最低负化合价为  价 价 |
C. 具有还原性 具有还原性 | D. 的酸性强于 的酸性强于  |
(7)
 在一定条件下可与
在一定条件下可与  溶液反应,生成一种正盐和水,该正盐化学式为
溶液反应,生成一种正盐和水,该正盐化学式为
您最近一年使用:0次
名校
2 . A、B、C、D、E、F是原子序数依次增大的元素,其相关信息如下。
回答下列问题:
(1)元素A和E形成的化合物的电子式为___________ ,该化合物含有的化学键类型是___________ 。
(2)元素B在元素周期表中的位置为___________ ,其原子结构示意图为___________ 。
(3)元素D形成的单质在元素C形成的单质中燃烧的化学方程式为___________ ;元素D形成的单质久置于空气中最终得到的化合物的化学式为___________ 。
(4)下列事实,能证明元素E的非金属性强于S(硫)的非金属性的是___________(填字母)。
| 元素 | 特征 | 元素 | 特征 |
| A | 该元素的某种原子不含中子 | B | 简单氢化物的分子结构模型为 |
| C | 在人体中含量最多 | D | 该元素形成的化合物灼烧时火焰呈现黄色 |
| E | 该元素形成的单质常温下是黄绿色的有毒气体 | F | 由该元素形成的合金是目前我国用途最广的合金 |
(1)元素A和E形成的化合物的电子式为
(2)元素B在元素周期表中的位置为
(3)元素D形成的单质在元素C形成的单质中燃烧的化学方程式为
(4)下列事实,能证明元素E的非金属性强于S(硫)的非金属性的是___________(填字母)。
A.酸性: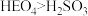 | B. 通入 通入 溶液能产生黄色沉淀 溶液能产生黄色沉淀 |
C.氢化物稳定性: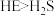 | D.常温下,E的单质为气态,S的单质为固态 |
您最近一年使用:0次
解题方法
3 . 实验室用已经称量好的 固体配制
固体配制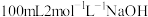 溶液,回答下列问题:
溶液,回答下列问题:
(1)该实验中要用到玻璃棒,其作用是______________ 。
(2)容量瓶用蒸馏水洗净后未烘干,使所配制溶液的浓度______________ (偏高、偏低、无影响)。
(3)定容时,俯视容量瓶刻度线,会导致所记溶液浓度______________ (偏高、偏低、无影响)。
(4)用放置时间较长的 来配制溶液,可能导致所配溶液浓度
来配制溶液,可能导致所配溶液浓度______________ (偏高、偏低、无影响)。
 固体配制
固体配制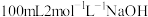 溶液,回答下列问题:
溶液,回答下列问题:(1)该实验中要用到玻璃棒,其作用是
(2)容量瓶用蒸馏水洗净后未烘干,使所配制溶液的浓度
(3)定容时,俯视容量瓶刻度线,会导致所记溶液浓度
(4)用放置时间较长的
 来配制溶液,可能导致所配溶液浓度
来配制溶液,可能导致所配溶液浓度
您最近一年使用:0次
4 . 某工厂的工业废水中含有大量的 、较多的
、较多的 ,为了减少污染并促进废物利用,工厂计划从该废水中回收
,为了减少污染并促进废物利用,工厂计划从该废水中回收 和金属铜.请根据以下流程图,完成下列问题.
和金属铜.请根据以下流程图,完成下列问题.
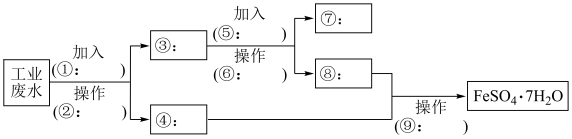
(1)试剂①的化学式为_______________ ,物质⑦的化学式为_______________ ,操作②需要的玻璃仪器有_______________ 。
(2)操作⑨的名称为_______________ 、过滤、洗涤、干燥。
(3)鉴别溶液⑧中金属阳离子时,应滴加的试剂依次为_______________ .请写出该鉴别过程中属于氧化还原反应的离子方程式_______________ 。
(4)溶液⑧与氢氧化钠溶液生成的白色沉淀在空气中不稳定,最后会转化为红褐色沉淀,此现象对应的化学方程式为_______________ 。
 、较多的
、较多的 ,为了减少污染并促进废物利用,工厂计划从该废水中回收
,为了减少污染并促进废物利用,工厂计划从该废水中回收 和金属铜.请根据以下流程图,完成下列问题.
和金属铜.请根据以下流程图,完成下列问题.
(1)试剂①的化学式为
(2)操作⑨的名称为
(3)鉴别溶液⑧中金属阳离子时,应滴加的试剂依次为
(4)溶液⑧与氢氧化钠溶液生成的白色沉淀在空气中不稳定,最后会转化为红褐色沉淀,此现象对应的化学方程式为
您最近一年使用:0次
解题方法
5 . 完成下列问题
(1)用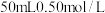 盐酸与
盐酸与 溶液测定计算中和反应的反应热。回答下列问题:
溶液测定计算中和反应的反应热。回答下列问题:
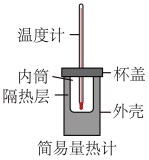
①从实验装置上看,图中缺少的一种玻璃用品是___________ 。
②如改用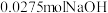 固体与该盐酸进行实验,则实验中测得的“中和热”数值将
固体与该盐酸进行实验,则实验中测得的“中和热”数值将___________ (填“偏大”、“偏小”或“无影响”)。
(2)反应 过程中的能量变化如图,回答下列问题。
过程中的能量变化如图,回答下列问题。
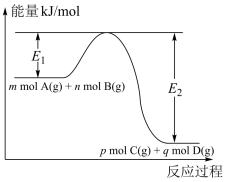
①该反应
___________ (用含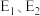 式子表示);
式子表示);
②在反应体系中加入催化剂,
___________ (填“增大”、“减小”、“不变”),
___________ (填“增大”、“减小”、“不变”)。
(3)发射卫星时可用肼 为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:①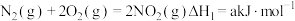
②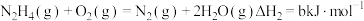
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:___________ 。
(1)用
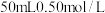 盐酸与
盐酸与 溶液测定计算中和反应的反应热。回答下列问题:
溶液测定计算中和反应的反应热。回答下列问题:
①从实验装置上看,图中缺少的一种玻璃用品是
②如改用
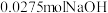 固体与该盐酸进行实验,则实验中测得的“中和热”数值将
固体与该盐酸进行实验,则实验中测得的“中和热”数值将(2)反应
 过程中的能量变化如图,回答下列问题。
过程中的能量变化如图,回答下列问题。
①该反应

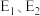 式子表示);
式子表示);②在反应体系中加入催化剂,


(3)发射卫星时可用肼
 为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:①
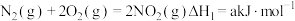
②
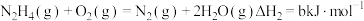
写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:
您最近一年使用:0次
6 . 某兴趣小组设计实验模拟探究氨气催化还原焦炉煤气中的 ,装置如图。
,装置如图。
(1)装置a中盛装生石灰的仪器名称为________ 。
(2)装置d中发生反应的化学方程式为_________ 。
(3)装置b中应盛装的药品为_________(填标号)。
(4)管式炉中反应一段时间后,催化剂表面开始有淡黄色固体生成,反应为 。可以用一组化学方程式表示其反应进程,补充过程Ⅲ的化学方程式。
。可以用一组化学方程式表示其反应进程,补充过程Ⅲ的化学方程式。
过程Ⅰ:
过程Ⅱ: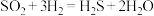
过程Ⅲ:___________ 。
(5)气体流量计可用于观察气体的流速。通过______ (填操作)调节气体流速,以控制装置c中 与
与 的比例。
的比例。
(6)该装置存在不足之处是_______ 。
 ,装置如图。
,装置如图。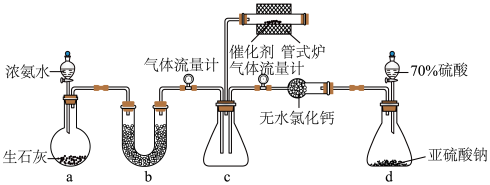
(1)装置a中盛装生石灰的仪器名称为
(2)装置d中发生反应的化学方程式为
(3)装置b中应盛装的药品为_________(填标号)。
A.无水 | B.无水 | C.浓硫酸 | D.碱石灰 |
(4)管式炉中反应一段时间后,催化剂表面开始有淡黄色固体生成,反应为
 。可以用一组化学方程式表示其反应进程,补充过程Ⅲ的化学方程式。
。可以用一组化学方程式表示其反应进程,补充过程Ⅲ的化学方程式。过程Ⅰ:

过程Ⅱ:
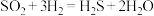
过程Ⅲ:
(5)气体流量计可用于观察气体的流速。通过
 与
与 的比例。
的比例。(6)该装置存在不足之处是
您最近一年使用:0次
名校
解题方法
7 .  具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。
(1)以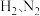 合成
合成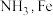 是常用的催化剂。
是常用的催化剂。
①基态 原子的电子排布式为
原子的电子排布式为___________ ,基态N原子轨道表示式___________ 。
②实际生产中采用铁的氧化物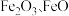 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
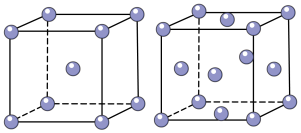
ⅰ.两种晶胞所含铁原子个数比为___________ 。
ⅱ.图1晶胞的棱长为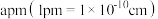 ,则其密度ρ=
,则其密度ρ=__________ g/cm3。
③我国科学家开发出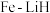 双中心催化剂,在合成
双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能 :
:
 ,从原子结构角度解释原因
,从原子结构角度解释原因___________ 。
(2)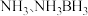 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
① 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为___________ 。
② 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是___________ 。其他含氮配合物,如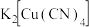 的配离子是
的配离子是___________ 、配合物 的配体是
的配体是___________ 。
(3)常温下 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
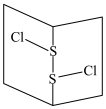
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有___________ 键(填“极性”、“非极性”,下同),是___________ 分子, 与
与 分子结构相似,熔沸点S2Br2
分子结构相似,熔沸点S2Br2______ S2Cl2(填“>”或“<”)。
 具有易液化、含氢密度高、应用广泛等优点,
具有易液化、含氢密度高、应用广泛等优点, 的合成及应用是科学研究的重要课题。
的合成及应用是科学研究的重要课题。(1)以
 合成
合成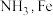 是常用的催化剂。
是常用的催化剂。①基态
 原子的电子排布式为
原子的电子排布式为②实际生产中采用铁的氧化物
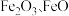 ,使用前用
,使用前用 和
和 的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
的混合气体将它们还原为具有活性的金属铁。铁的两种晶胞(所示图形为正方体)结构示意如下:
ⅰ.两种晶胞所含铁原子个数比为
ⅱ.图1晶胞的棱长为
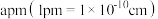 ,则其密度ρ=
,则其密度ρ=③我国科学家开发出
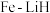 双中心催化剂,在合成
双中心催化剂,在合成 中显示出高催化活性。第一电离能
中显示出高催化活性。第一电离能 :
: ,从原子结构角度解释原因
,从原子结构角度解释原因(2)
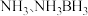 (氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。
(氨硼烷)储氢量高,是具有广泛应用前景的储氢材料。①
 的中心原子的杂化轨道类型为
的中心原子的杂化轨道类型为②
 存在配位键,提供空轨道的是
存在配位键,提供空轨道的是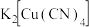 的配离子是
的配离子是 的配体是
的配体是(3)常温下
 是橙黄色液体,其分子结构如图所示。
是橙黄色液体,其分子结构如图所示。
少量泄漏会产生窒息性气味,遇水易水解,并产生酸性悬浊液。
 分子中含有
分子中含有 与
与 分子结构相似,熔沸点S2Br2
分子结构相似,熔沸点S2Br2
您最近一年使用:0次
解题方法
8 . 下表列出9种元素在元素周期表(元素周期表只给出部分)中的位置。
请回答下列问题:
(1)考古工作者利用表中某元素的一种核素测定一些文物的年代,这种核素的原子符号是__________ 。
(2)由元素②和元素④形成原子个数比为 的化合物的电子式为
的化合物的电子式为__________ 。
(3)元素⑦的最高价氧化物与元素⑥的最高价氧化物的水化物的水溶液反应的离子方程式为__________ 。
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是__________ (填化学式,用“>”连接)。
(5)元素④和⑥形成的淡黄色固体与元素①和④形成的常用化合物反应的离子方程式为__________ 。
(6)将元素⑧的单质通入元素⑥和⑨形成的化合物水溶液中,观察到的现象是__________ 。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | |||||
4 | ⑨ |
(1)考古工作者利用表中某元素的一种核素测定一些文物的年代,这种核素的原子符号是
(2)由元素②和元素④形成原子个数比为
 的化合物的电子式为
的化合物的电子式为(3)元素⑦的最高价氧化物与元素⑥的最高价氧化物的水化物的水溶液反应的离子方程式为
(4)③、④、⑤三种元素的简单氢化物稳定性顺序是
(5)元素④和⑥形成的淡黄色固体与元素①和④形成的常用化合物反应的离子方程式为
(6)将元素⑧的单质通入元素⑥和⑨形成的化合物水溶液中,观察到的现象是
您最近一年使用:0次
名校
9 . Ⅰ.为实现碳达峰、碳中和,研发二氧化碳的利用技术,降低空气中二氧化碳的含量,成为研究热点。
(1) 由气体变成固体的过程中,下列判断正确的是___________。
由气体变成固体的过程中,下列判断正确的是___________。
Ⅱ.二氧化碳加氢制甲醇的总反应可表示为: ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:
①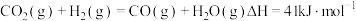
②
(2)总反应的
___________  。
。
(3)若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________。
(4)根据以上信息判断 与
与 制取甲醇的反应自发进行的条件是___________。
制取甲醇的反应自发进行的条件是___________。
Ⅲ.煤转化为水煤气的主要反应为: ,
,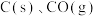 和
和 完全燃烧的热化学方程式分别为:
完全燃烧的热化学方程式分别为:
①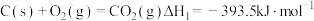 ;
;
②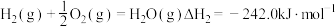 ;
;
③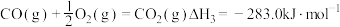 。
。
(5)请你根据以上数据,写出 与水蒸气反应生成
与水蒸气反应生成 和
和 的热化学方程式:
的热化学方程式:___________ 。
(6)比较反应热数据可知,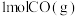 和
和 完全燃烧放出的热量之和,比
完全燃烧放出的热量之和,比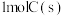 完全燃烧放出的热量
完全燃烧放出的热量___________ 。(填“多”或“少”)
(1)
 由气体变成固体的过程中,下列判断正确的是___________。
由气体变成固体的过程中,下列判断正确的是___________。A.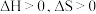 | B.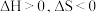 | C.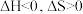 | D.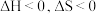 |
Ⅱ.二氧化碳加氢制甲醇的总反应可表示为:
 ,该反应一般认为通过如下步骤来实现:
,该反应一般认为通过如下步骤来实现:①
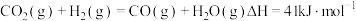
②

(2)总反应的

 。
。(3)若反应①为慢反应,下列示意图中能体现上述反应能量变化的是___________。
A.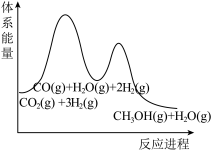 | B.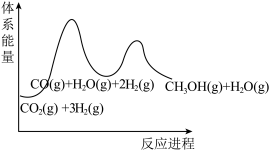 |
C.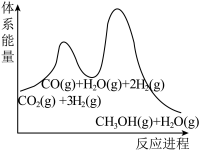 | D.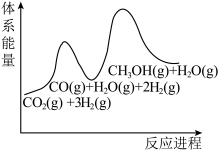 |
(4)根据以上信息判断
 与
与 制取甲醇的反应自发进行的条件是___________。
制取甲醇的反应自发进行的条件是___________。| A.高温 | B.低温 | C.任何温度 | D.任何条件下均不能自发 |
Ⅲ.煤转化为水煤气的主要反应为:
 ,
,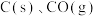 和
和 完全燃烧的热化学方程式分别为:
完全燃烧的热化学方程式分别为:①
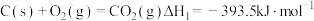 ;
;②
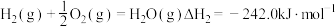 ;
;③
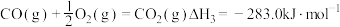 。
。(5)请你根据以上数据,写出
 与水蒸气反应生成
与水蒸气反应生成 和
和 的热化学方程式:
的热化学方程式:(6)比较反应热数据可知,
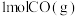 和
和 完全燃烧放出的热量之和,比
完全燃烧放出的热量之和,比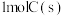 完全燃烧放出的热量
完全燃烧放出的热量
您最近一年使用:0次
2024-01-15更新
|
181次组卷
|
2卷引用:上海师范大学附属中学闵行分校2023-2024学年高二上学期期末考试 化学试卷(等级)
解题方法
10 . 绿矾( )可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含
)可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含 、FeO,还有一定量的
、FeO,还有一定量的 )可用于制绿矾晶体,其工艺流程如下:
)可用于制绿矾晶体,其工艺流程如下:
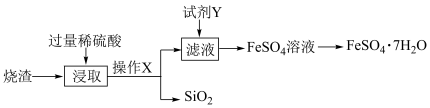
查阅资料: 不溶于水,也不与稀硫酸反应。
不溶于水,也不与稀硫酸反应。
(1)操作X的名称为________ 。
(2)“浸取”步骤中,反应的离子方程式分别为________ 、________ 。
(3)试剂Y的作用是将 转化为
转化为 。
。
①若试剂Y是 ,转化原理用离子方程式表示为
,转化原理用离子方程式表示为 ,
, 属于
属于________ (填“氧化产物”或“还原产物”)。
②若试剂Y是Fe,转化原理用离子方程式表示为________ ,化工生产中②比①好,从物质利用率角度考虑,其原因是________ 。
(4)加入试剂Y充分反应后,如何证明滤液中已不含 ,写出实验操作和现象:
,写出实验操作和现象:________ 。
 )可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含
)可用作局部收敛剂及补血剂。某工厂产生的烧渣(主要含 、FeO,还有一定量的
、FeO,还有一定量的 )可用于制绿矾晶体,其工艺流程如下:
)可用于制绿矾晶体,其工艺流程如下:
查阅资料:
 不溶于水,也不与稀硫酸反应。
不溶于水,也不与稀硫酸反应。(1)操作X的名称为
(2)“浸取”步骤中,反应的离子方程式分别为
(3)试剂Y的作用是将
 转化为
转化为 。
。①若试剂Y是
 ,转化原理用离子方程式表示为
,转化原理用离子方程式表示为 ,
, 属于
属于②若试剂Y是Fe,转化原理用离子方程式表示为
(4)加入试剂Y充分反应后,如何证明滤液中已不含
 ,写出实验操作和现象:
,写出实验操作和现象:
您最近一年使用:0次



