名校
1 . 对燃油尾气污染物进行脱硝处理有助于减少空气污染,可使用氨将氮氧化物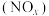 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为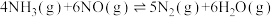 。下列说法正确的是
。下列说法正确的是
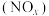 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为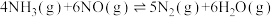 。下列说法正确的是
。下列说法正确的是A.标准状况下,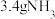 的体积约为 的体积约为 |
B. 可用作食品的保护气,原因是 可用作食品的保护气,原因是 的化学性质不活泼 的化学性质不活泼 |
C.该反应中, 与足量的 与足量的 反应,理论上可得到 反应,理论上可得到 |
D.该反应中,每断裂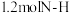 键,同时转移电子的物质的量为 键,同时转移电子的物质的量为 |
您最近一年使用:0次
名校
2 . 燃煤产生的烟气中含有较多 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
 、
、 、
、 等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是
等影响环境的气体,如何综合利用这些气体一直是科研人员研究的热点。下列说法正确的是A.将 通入足量的 通入足量的 溶液中,发生反应的化学方程式为 溶液中,发生反应的化学方程式为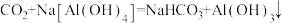 |
B.将 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为 通入足量的酸性高锰酸钾溶液中,发生反应的离子方程式为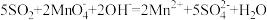 |
C.将 通入烧碱溶液中,发生反应的化学方程式为 通入烧碱溶液中,发生反应的化学方程式为 |
D.将 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 通入足量的次氯酸钠溶液中,发生反应的离子方程式为 |
您最近一年使用:0次
3 . 氧钒(Ⅳ)碱式碳酸铵晶体{化学式为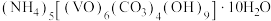 ,
,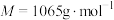 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:

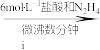
 溶液
溶液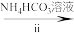 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为_____ ,第二步电离方程式为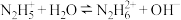 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:_____ 。
(2)步骤ii可通过如图装置完成。 的优点为
的优点为_____ ,检查其气密性的操作为_____ 。
②实验开始时,先打开_____ (填“K1”或“K2”)。
③盛装NH4HCO3溶液的仪器名称为_____ 。
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg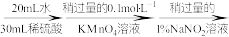
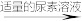
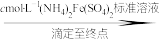 再重复实验两次。
再重复实验两次。
已知: 。
。
①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:_____ 。
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为_____  。
。
③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果_____ (填“偏大”“偏小”或“无影响”)。
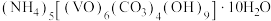 ,
,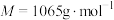 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
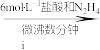
 溶液
溶液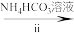 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为
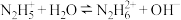 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:(2)步骤ii可通过如图装置完成。
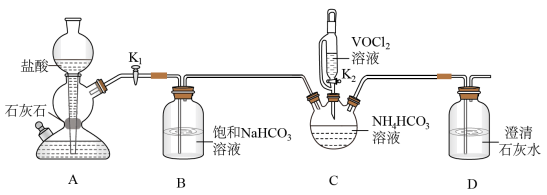
 的优点为
的优点为②实验开始时,先打开
③盛装NH4HCO3溶液的仪器名称为
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg
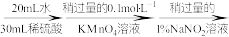
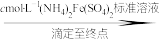 再重复实验两次。
再重复实验两次。已知:
 。
。①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
 。
。③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果
您最近一年使用:0次
2024-05-08更新
|
225次组卷
|
2卷引用:湖南省衡阳市祁东县2024届高三第三次联考(三模)化学试题
4 . 下列类比或推理结果正确的是
A.已知 和浓硫酸可发生归中反应,则 和浓硫酸可发生归中反应,则 和硝酸也可发生归中反应 和硝酸也可发生归中反应 |
B.已知加热时Cu与 反应生成 反应生成 ,则加热时Cu与S反应生成 ,则加热时Cu与S反应生成 |
C.已知C、Si形成的氧化物晶体类型不同,可推知等物质的量的 和 和 中σ键数目不相同 中σ键数目不相同 |
D.已知氧化性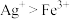 ,根据溶液中 ,根据溶液中 和 和 易发生氧化还原反应,推断溶液中 易发生氧化还原反应,推断溶液中 和 和 也易发生氧化还原反应 也易发生氧化还原反应 |
您最近一年使用:0次
5 . 硝酸镍、硝酸钠在陶瓷、玻璃工业应用广泛。以废弃镍板(含有少量的氧化铝杂质)生产硝酸镍、硝酸钠工艺流程如下:
(1)工业生产普通玻璃的主要原料有石英砂、__________ 、__________ 。
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是__________ ;若温度太高,可能导致的后果是__________ 。
(3)假如Ni与浓硝酸反应产生的混合气体中 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)向“浸取液”中加入 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为_______ 。__________ 。
(6)向“转化器”中加入稀硝酸的目的是__________ 。
(7)已知:①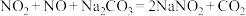 ;
;
②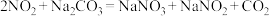 。
。
若将一定体积的 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为__________ 。

(1)工业生产普通玻璃的主要原料有石英砂、
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是
(3)假如Ni与浓硝酸反应产生的混合气体中
 ,该反应的离子方程式为
,该反应的离子方程式为(4)向“浸取液”中加入
 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为__________+
 +
+ __________
__________ +
+ _________+
_________+
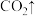 。
。
(6)向“转化器”中加入稀硝酸的目的是
(7)已知:①
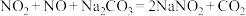 ;
;②
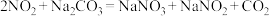 。
。若将一定体积的
 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
您最近一年使用:0次
名校
6 . 将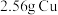 投入
投入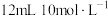 硝酸中,恰好完全反应,向反应后的溶液中加入
硝酸中,恰好完全反应,向反应后的溶液中加入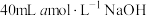 溶液,
溶液, 恰好完全沉淀,将生成的气体与
恰好完全沉淀,将生成的气体与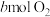 一起通入足量
一起通入足量 溶液中,气体恰好被完全吸收生成
溶液中,气体恰好被完全吸收生成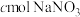 。下列判断正确的是
。下列判断正确的是
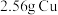 投入
投入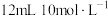 硝酸中,恰好完全反应,向反应后的溶液中加入
硝酸中,恰好完全反应,向反应后的溶液中加入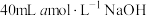 溶液,
溶液, 恰好完全沉淀,将生成的气体与
恰好完全沉淀,将生成的气体与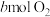 一起通入足量
一起通入足量 溶液中,气体恰好被完全吸收生成
溶液中,气体恰好被完全吸收生成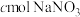 。下列判断正确的是
。下列判断正确的是| A.生成的气体中只有NO | B. |
C. | D.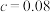 |
您最近一年使用:0次
名校
解题方法
7 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。河南焦作的山药富含硒( ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。
(1) 的原子结构示意图为
的原子结构示意图为______________ ,其在周期表中的位置为______________ 。
(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是______________ (填标号)。
A.还原性: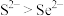
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性: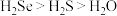
D.氧化性: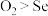
② 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为______________ ; 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为______________ 。
(3)某混合物中硒主要以 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将该混合物与浓硫酸混合焙烧,产生 、
、 的烟气
的烟气
ⅱ.用水吸收ⅰ中烟气,可得 固体
固体
已知: 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。
①可用足量 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为__________ 。
② 中
中 的化合价为
的化合价为_________ 价;焙烧时, 与浓
与浓 反应的化学方程式为
反应的化学方程式为_________________ ,理论上该反应每转移1 电子,得到的
电子,得到的 的质量为
的质量为_________ g。
 ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。(1)
 的原子结构示意图为
的原子结构示意图为(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是
A.还原性:
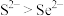
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性:
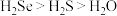
D.氧化性:
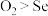
②
 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为(3)某混合物中硒主要以
 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:ⅰ.将该混合物与浓硫酸混合焙烧,产生
 、
、 的烟气
的烟气ⅱ.用水吸收ⅰ中烟气,可得
 固体
固体已知:
 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。①可用足量
 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为②
 中
中 的化合价为
的化合价为 与浓
与浓 反应的化学方程式为
反应的化学方程式为 电子,得到的
电子,得到的 的质量为
的质量为
您最近一年使用:0次
2024-04-21更新
|
242次组卷
|
3卷引用:湖南省衡阳市衡阳县三校2023-2024学年高一下学期三月联考化学试题
解题方法
8 . 某煤矸石经化学成分分析可知,其含有大量的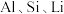 元素,还含有少量
元素,还含有少量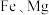 等杂质。下图为硝酸浸出铝、铁、锂等工业流程。按要求回答下列问题:
等杂质。下图为硝酸浸出铝、铁、锂等工业流程。按要求回答下列问题: 的操作是
的操作是______ 。
(2)富铁渣中的主要成分是______ (填化学式)。
(3)低温热解过程中有红棕色气体放出,则铝盐发生反应的化学方程式为______ (假设热解过程中只有一种含氮化合物生成);此时热解温度不宜过高的原因是______ 。
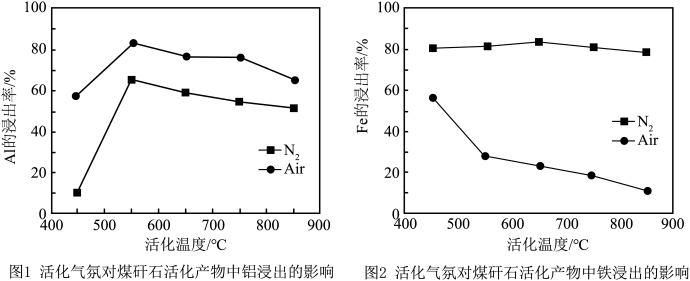
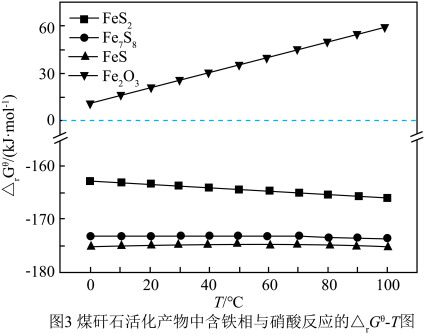
(4)热活化过程可在氮气或空气气氛中进行,其活化气氛在不同温度下对铝(图1)、铁(图2)浸出的影响,以及铁的活化产物与硝酸反应的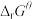 与温度的关系(图3)如下图所示。则热活化过程所选用的合适的条件是
与温度的关系(图3)如下图所示。则热活化过程所选用的合适的条件是______ (填标号)。
A. 气氛、
气氛、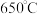 B.空气气氛、
B.空气气氛、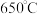 C.
C. 气氛、
气氛、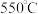 D.空气气氛、
D.空气气氛、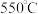
空气气氛中温度越高,铁的浸出率越小的原因可能是______ 。 )和碳酸酯类有机溶剂组成,充电过程中,石墨
)和碳酸酯类有机溶剂组成,充电过程中,石墨 电极发生阴离子插层反应得
电极发生阴离子插层反应得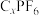 。则碳酸酯类为
。则碳酸酯类为______ (填“极性”或“非极性”)溶剂,放电时,正极发生的电极反应方程式为______ 。
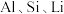 元素,还含有少量
元素,还含有少量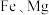 等杂质。下图为硝酸浸出铝、铁、锂等工业流程。按要求回答下列问题:
等杂质。下图为硝酸浸出铝、铁、锂等工业流程。按要求回答下列问题: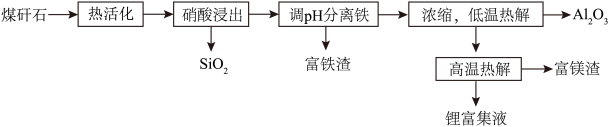
 的操作是
的操作是(2)富铁渣中的主要成分是
(3)低温热解过程中有红棕色气体放出,则铝盐发生反应的化学方程式为
(4)热活化过程可在氮气或空气气氛中进行,其活化气氛在不同温度下对铝(图1)、铁(图2)浸出的影响,以及铁的活化产物与硝酸反应的
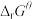 与温度的关系(图3)如下图所示。则热活化过程所选用的合适的条件是
与温度的关系(图3)如下图所示。则热活化过程所选用的合适的条件是A.
 气氛、
气氛、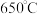 B.空气气氛、
B.空气气氛、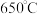 C.
C. 气氛、
气氛、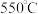 D.空气气氛、
D.空气气氛、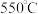
空气气氛中温度越高,铁的浸出率越小的原因可能是
 )和碳酸酯类有机溶剂组成,充电过程中,石墨
)和碳酸酯类有机溶剂组成,充电过程中,石墨 电极发生阴离子插层反应得
电极发生阴离子插层反应得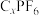 。则碳酸酯类为
。则碳酸酯类为
您最近一年使用:0次
名校
9 . 实验室以 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体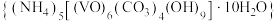 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是
 溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体
溶液和碳酸氢铵溶液制备氧钒(IV)碱式碳酸铵晶体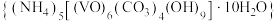 ,装置如图所示。已知:
,装置如图所示。已知: 能被
能被 氧化。下列说法不正确的是
氧化。下列说法不正确的是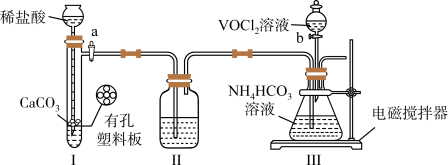
A.Ⅱ中的试剂为饱和 溶液 溶液 |
B.实验开始时应先打开活塞 ,一段时间后,再打开活塞 ,一段时间后,再打开活塞 |
| C.Ⅲ中的反应为氧化还原反应 |
D.反应完全,小心取下分液漏斗,停止通气,立即塞上橡胶塞,将锥形瓶置于 保护下的干燥器中,静置过夜,得到晶体 保护下的干燥器中,静置过夜,得到晶体 |
您最近一年使用:0次
2024-04-21更新
|
324次组卷
|
3卷引用:湖南省新高考教学教研联盟2023-2024学年高三下学期第二次联考化学试题
10 . 一种利用 和
和 直接合成
直接合成 的反应历程如下图所示。下列说法中错误的是
的反应历程如下图所示。下列说法中错误的是
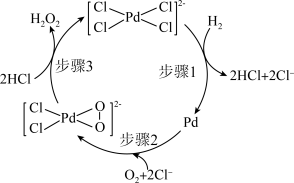
| A.总反应的原子利用率理论上可达100% |
B.步骤2中,若 完全反应,则理论上转移电子数目为2NA 完全反应,则理论上转移电子数目为2NA |
C.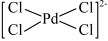 降低了反应的活化能,加快了反应速率 降低了反应的活化能,加快了反应速率 |
D. 和 和 中Pd的化合价不相同 中Pd的化合价不相同 |
您最近一年使用:0次



