1 . 白硼钙石的主要成分是Ca4B10O19·7H2O(含有少量Fe2O3、FeO、CaCO3和SiO2等杂质),利用白硼钙石制取强还原剂NaBH4的工艺流程如下:
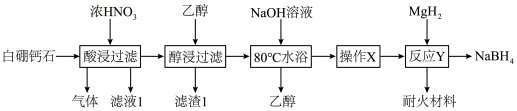
| A.“滤渣1”的主要成分是SiO2 |
| B.“气体”的主要成分是NO2 |
| C.“操作X”涉及到蒸发浓缩、降温结晶 |
D.“反应Y”的化学方程式是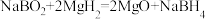 |
您最近一年使用:0次
2024-03-15更新
|
991次组卷
|
6卷引用:湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题
湖南省衡阳市衡阳县第一中学2023-2024学年高三下学期4月月考化学试题湖南省常德市汉寿县第一中学2023-2024学年高三下学期4月月考化学试题河北省唐山市2023-2024学年高三一模化学试题河北省唐山市2024届高三一模化学试题河北省石家庄市第二中学2023-2024学年高三下学期质检二模拟化学试题(已下线)压轴题03?物质的制备、检验、分离与提纯(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
解题方法
2 . 钴(Co)合金广泛应用于机械制造等领域。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为_____ 。
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。
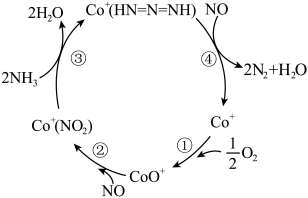
①在反应②中NO作_____ (填“氧化剂”或“还原剂”),与反应④中NO的作用_____ (填“是”或“不是”)一样的。
②写出步骤③对应的离子方程式:_____ 。
③整个历程中氧化剂与还原剂的物质的量之比为_____ 。
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:_____ 。
(1)Co2+和Fe3+与KSCN溶液发生的反应相似。向CoCl2溶液中加入KSCN溶液,生成某种带有两个单位负电荷的蓝色离子,其化学式为
(2)推测Co+催化剂表面促进NH3还原NOx的反应历程如图所示。

①在反应②中NO作
②写出步骤③对应的离子方程式:
③整个历程中氧化剂与还原剂的物质的量之比为
(3)现将35.7gCoCO3在空气中加热,可得24.1g钴的氧化物和另一种氧化物。试写出CoCO3在空气中受热时发生反应的化学方程式:
您最近一年使用:0次
名校
3 . 食品级304不锈钢是一种重要的生产原材料,其中含铬18%。工业上将尖晶石类矿石(主要成分为 )综合利用,冶炼制造Cr和
)综合利用,冶炼制造Cr和 的流程如下(假设矿石中的杂质不参与反应):
的流程如下(假设矿石中的杂质不参与反应):________ 价。
②烧渣主要成分为一种含铁元素的红色粉末和 ,反应的化学方程式为
,反应的化学方程式为________ 。
③上述流程Ⅰ~Ⅵ中涉及金属元素发生还原反应的步骤共有________ 步。(填1~6数字)
④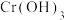 和
和 都是两性氢氧化物,请根据化学的类推思想写出
都是两性氢氧化物,请根据化学的类推思想写出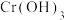 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:________ 。
(2)①流程Ⅵ会同时生成 、KCl等产品,则每生成
、KCl等产品,则每生成 ,理论上消耗KClO的质量为
,理论上消耗KClO的质量为________ g。(结果保留1位小数)
② 极易降价到铁的稳定价态+3价,是一种绿色环保多功能型水处理剂,它可用于杀菌消毒及净水的原因是
极易降价到铁的稳定价态+3价,是一种绿色环保多功能型水处理剂,它可用于杀菌消毒及净水的原因是________ 。
③若流程Ⅴ硝酸无剩余,流程Ⅵ的KClO调整为铁粉,则可在搅拌作用下生成磁性材料,工艺中 与加入铁粉的物质的量之比最好为
与加入铁粉的物质的量之比最好为________ 。
 )综合利用,冶炼制造Cr和
)综合利用,冶炼制造Cr和 的流程如下(假设矿石中的杂质不参与反应):
的流程如下(假设矿石中的杂质不参与反应):
②烧渣主要成分为一种含铁元素的红色粉末和
 ,反应的化学方程式为
,反应的化学方程式为③上述流程Ⅰ~Ⅵ中涉及金属元素发生还原反应的步骤共有
④
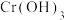 和
和 都是两性氢氧化物,请根据化学的类推思想写出
都是两性氢氧化物,请根据化学的类推思想写出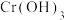 与NaOH溶液反应的离子方程式:
与NaOH溶液反应的离子方程式:(2)①流程Ⅵ会同时生成
 、KCl等产品,则每生成
、KCl等产品,则每生成 ,理论上消耗KClO的质量为
,理论上消耗KClO的质量为②
 极易降价到铁的稳定价态+3价,是一种绿色环保多功能型水处理剂,它可用于杀菌消毒及净水的原因是
极易降价到铁的稳定价态+3价,是一种绿色环保多功能型水处理剂,它可用于杀菌消毒及净水的原因是③若流程Ⅴ硝酸无剩余,流程Ⅵ的KClO调整为铁粉,则可在搅拌作用下生成磁性材料,工艺中
 与加入铁粉的物质的量之比最好为
与加入铁粉的物质的量之比最好为
您最近一年使用:0次
2024-03-08更新
|
142次组卷
|
2卷引用:湖南省邵阳市第二中学2023-2024学年高一下学期第一次月考化学试题
名校
解题方法
4 . 中药自然铜具有散瘀止痛、续筋接骨之功效,其炮制方法始见于南北朝《雷公炮炙论》:取净自然铜(含FeS2的矿石)置于敞口耐火容器中,大火煅制红透,立即取出投入米醋淬火,反复煅淬数次至褐色,干燥后碾碎装存。下列说法正确的是
| A.古代煅制自然铜应在通风环境中进行 |
B.煅制过程中1 mol FeS2被完全氧化,转移电子的数目约为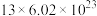 |
C.自然铜淬火过程中发生反应的离子方程式为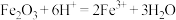 |
| D.含自然铜成分的中成药大七厘散(处方药),其包装上有“OTC”标识 |
您最近一年使用:0次
2024-03-05更新
|
989次组卷
|
5卷引用:湖南省长沙市一中2024届高三下学期模拟试卷(二)化学试题
湖南省长沙市一中2024届高三下学期模拟试卷(二)化学试题2024届辽宁省名校联盟(东北三省联考)高三下学期模拟预测化学试题(已下线)选择题6-10(已下线)化学(辽宁卷01)-2024年高考押题预测卷2024届山东省泰安肥城市高考仿真模拟(二)化学试题
名校
5 .  作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
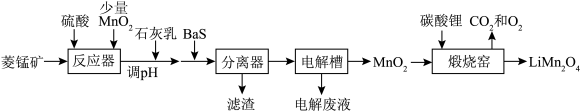
已知常温下部分物质的 如表。
如表。
回答下列问题:
(1)基态Mn原子的价电子轨道表示式为______ 。
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是______ ;若测得溶液中 浓度为0.1
浓度为0.1 ,
,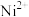 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、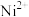 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于______ 。(已知:离子浓度小于等于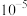
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)
(3)加入少量BaS溶液除去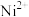 ,生成的沉淀有
,生成的沉淀有______ (填化学式)。
(4)具有强氧化性的过一硫酸( )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为______ (已知: 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。
(5)煅烧窑中,生成 反应的化学方程式是
反应的化学方程式是______ 。
(6) 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。
由此可以确定,在上述温度范围内,锰元素的平均价态的变化情况是______ 。
 作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为
作为电极材料,具有价格低,电位高、环境友好、安全性能高等优点,受到广泛关注。由菱锰矿(主要成分为 ,含有少量Fe、Ni、Al等元素)制备
,含有少量Fe、Ni、Al等元素)制备 的流程如图。
的流程如图。
已知常温下部分物质的
 如表。
如表。物质 |
|
|
|
|
|
|
|
|
|
|
|
(1)基态Mn原子的价电子轨道表示式为
(2)常温下,若溶矿反应完成后,反应器中溶液pH=5,可沉淀完全的金属离子是
 浓度为0.1
浓度为0.1 ,
,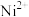 浓度为0.01
浓度为0.01 ,为防止
,为防止 、
、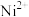 发生沉淀,反应器中溶液用石灰乳调节的pH应小于
发生沉淀,反应器中溶液用石灰乳调节的pH应小于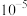
 ,即可认为该离子沉淀完全)
,即可认为该离子沉淀完全)(3)加入少量BaS溶液除去
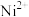 ,生成的沉淀有
,生成的沉淀有(4)具有强氧化性的过一硫酸(
 )可代替电解槽反应将
)可代替电解槽反应将 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱)。
的电离第一步完全,第二步微弱)。(5)煅烧窑中,生成
 反应的化学方程式是
反应的化学方程式是(6)
 中锰元素的平均价态为+3.5。在不同温度下,合成的
中锰元素的平均价态为+3.5。在不同温度下,合成的 中
中 、
、 和
和 的含量与温度的关系见下表。
的含量与温度的关系见下表。T/℃ |
|
|
|
700 | 5.56 | 44.58 | 49.86 |
750 | 2.56 | 44.87 | 52.57 |
800 | 5.50 | 44.17 | 50.33 |
850 | 6.22 | 44.40 | 49.38 |
您最近一年使用:0次
2024-02-25更新
|
844次组卷
|
3卷引用:湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题
湖南省长沙市长郡中学2023-2024学年高三模拟考试(一)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题
6 . 发蓝工艺是一种材料保护技术,钢铁零件的发蓝处理实质是使钢铁表面通过氧化反应,生成有一定厚度、均匀、致密、附着力强、耐腐蚀性能好的深蓝色氧化膜。钢铁零件经历如图转化进行发蓝处理,已知 的还原产物为
的还原产物为 。下列说法正确的是
。下列说法正确的是
 的还原产物为
的还原产物为 。下列说法正确的是
。下列说法正确的是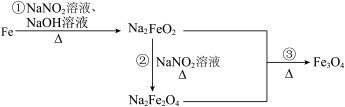
A.钢铁零件发蓝处理所得的深蓝色氧化膜是 |
| B.反应①中氧化剂和还原剂的物质的量之比为3∶1 |
C.反应②的离子方程式为 |
| D.反应③属于氧化还原反应 |
您最近一年使用:0次
名校
7 .  催化加氢制甲醇,并进一步生产低碳烯烃,可一定程度上减少我国对原油进口的依赖,对促进国家能源安全具有重大现实意义。
催化加氢制甲醇,并进一步生产低碳烯烃,可一定程度上减少我国对原油进口的依赖,对促进国家能源安全具有重大现实意义。 催化加氢制甲醇的反应历程如图所示,
催化加氢制甲醇的反应历程如图所示, 首先在“
首先在“ ”表面解离成2个
”表面解离成2个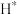 ,随后参与到
,随后参与到 的转化过程。下列说法正确的是
的转化过程。下列说法正确的是
 催化加氢制甲醇,并进一步生产低碳烯烃,可一定程度上减少我国对原油进口的依赖,对促进国家能源安全具有重大现实意义。
催化加氢制甲醇,并进一步生产低碳烯烃,可一定程度上减少我国对原油进口的依赖,对促进国家能源安全具有重大现实意义。 催化加氢制甲醇的反应历程如图所示,
催化加氢制甲醇的反应历程如图所示, 首先在“
首先在“ ”表面解离成2个
”表面解离成2个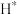 ,随后参与到
,随后参与到 的转化过程。下列说法正确的是
的转化过程。下列说法正确的是
A.“ ”能改变总反应的焓变 ”能改变总反应的焓变 |
B. 是反应历程的中间产物之一 是反应历程的中间产物之一 |
| C.反应历程中存在非极性键的断裂和形成 |
D.理论上反应历程消耗的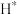 与生成的甲醇的物质的量之比为 与生成的甲醇的物质的量之比为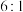 |
您最近一年使用:0次
2024-02-15更新
|
368次组卷
|
2卷引用:湖南省雅礼中学2024届高三下学期热身训练(三模)化学试题
名校
8 . 某兴趣小组用铬铁矿( ,含
,含 等杂质)为主要原料制备重铬酸钾
等杂质)为主要原料制备重铬酸钾 晶体,流程如下:
晶体,流程如下:

已知: 中
中 元素为
元素为 价;
价; 与
与 高温生成可溶于水的
高温生成可溶于水的 ;
; 酸性条件下能转化为
酸性条件下能转化为 。
。
回答下列问题:
(1)“焙烧”时,除生成 和
和 外,还生成一种无色无味的气体,该反应的化学方程式为
外,还生成一种无色无味的气体,该反应的化学方程式为___________ 。
(2)实验室进行“操作1”用到的玻璃仪器有:烧杯、___________ 。
(3)“晶体X”的化学式为___________ 。
(4)交警查酒驾所用检测仪器的工作原理为:
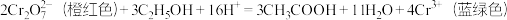
该反应中,还原剂为___________ ;反应消耗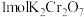 时,转移电子的物质的量为
时,转移电子的物质的量为___________  。
。
(5)“结晶”时,为得到杂质较少的 粗产品,请结合下图从下列选项中选出合理的操作并排序
粗产品,请结合下图从下列选项中选出合理的操作并排序___________ (填字母)。
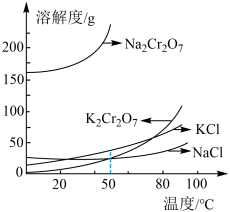
a. 蒸发溶剂 b.
蒸发溶剂 b. 蒸发溶剂 c.过滤 d.冷却至室温
蒸发溶剂 c.过滤 d.冷却至室温
e.蒸发至溶液出现晶膜,停止加热
 ,含
,含 等杂质)为主要原料制备重铬酸钾
等杂质)为主要原料制备重铬酸钾 晶体,流程如下:
晶体,流程如下:
已知:
 中
中 元素为
元素为 价;
价; 与
与 高温生成可溶于水的
高温生成可溶于水的 ;
; 酸性条件下能转化为
酸性条件下能转化为 。
。回答下列问题:
(1)“焙烧”时,除生成
 和
和 外,还生成一种无色无味的气体,该反应的化学方程式为
外,还生成一种无色无味的气体,该反应的化学方程式为(2)实验室进行“操作1”用到的玻璃仪器有:烧杯、
(3)“晶体X”的化学式为
(4)交警查酒驾所用检测仪器的工作原理为:
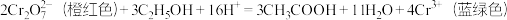
该反应中,还原剂为
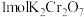 时,转移电子的物质的量为
时,转移电子的物质的量为 。
。(5)“结晶”时,为得到杂质较少的
 粗产品,请结合下图从下列选项中选出合理的操作并排序
粗产品,请结合下图从下列选项中选出合理的操作并排序
a.
 蒸发溶剂 b.
蒸发溶剂 b. 蒸发溶剂 c.过滤 d.冷却至室温
蒸发溶剂 c.过滤 d.冷却至室温e.蒸发至溶液出现晶膜,停止加热
您最近一年使用:0次
2024-02-02更新
|
165次组卷
|
2卷引用:湖南省衡阳市第八中学2023-2024学年高一下学期开学考试化学试题
9 . 根据所学知识,进行作答
(1)2023年第19届杭州亚运会场馆实现 覆盖,制作
覆盖,制作 芯片的材料为
芯片的材料为 (氮化镓),镓原子结构示意图为
(氮化镓),镓原子结构示意图为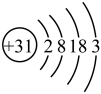 ,镓元素在元素周期表中的位置
,镓元素在元素周期表中的位置___________ 。
(2)2023年10月26日神舟十七号飞船成功对接太空站,为使宇航员有良好的生存环境,飞船中装有盛 颗粒的供氧装置。
颗粒的供氧装置。
① 中的氧元素的化合价为
中的氧元素的化合价为___________ 价。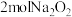 与水完全反应时,生成的氧气在标准状况下体积为
与水完全反应时,生成的氧气在标准状况下体积为___________ L。
②如用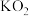 (超氧化钾)代替
(超氧化钾)代替 ,也能达到同样的目的。写出
,也能达到同样的目的。写出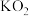 与
与 反应的化学方程式
反应的化学方程式___________ 。
(3)2023年12月18日甘肃省发生地震灾害,受灾废墟需喷洒大量84消毒液的稀溶液进行消毒。84消毒液可由 与
与 溶液反应制得,其主要成分为
溶液反应制得,其主要成分为 。
。
①资料(3)涉及的物质中,属于碱的是___________ (填化学式,下同);属于盐的是___________ 。
②“84消毒液”与稀盐酸混合使用可增强其漂白效果,原因是___________ (用离子方程式表示),但“84消毒液”却不能与“洁厕灵”(浓盐酸)混合使用,原因是___________ (用离子方程式表示)。
(1)2023年第19届杭州亚运会场馆实现
 覆盖,制作
覆盖,制作 芯片的材料为
芯片的材料为 (氮化镓),镓原子结构示意图为
(氮化镓),镓原子结构示意图为 ,镓元素在元素周期表中的位置
,镓元素在元素周期表中的位置(2)2023年10月26日神舟十七号飞船成功对接太空站,为使宇航员有良好的生存环境,飞船中装有盛
 颗粒的供氧装置。
颗粒的供氧装置。①
 中的氧元素的化合价为
中的氧元素的化合价为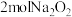 与水完全反应时,生成的氧气在标准状况下体积为
与水完全反应时,生成的氧气在标准状况下体积为②如用
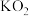 (超氧化钾)代替
(超氧化钾)代替 ,也能达到同样的目的。写出
,也能达到同样的目的。写出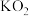 与
与 反应的化学方程式
反应的化学方程式(3)2023年12月18日甘肃省发生地震灾害,受灾废墟需喷洒大量84消毒液的稀溶液进行消毒。84消毒液可由
 与
与 溶液反应制得,其主要成分为
溶液反应制得,其主要成分为 。
。①资料(3)涉及的物质中,属于碱的是
②“84消毒液”与稀盐酸混合使用可增强其漂白效果,原因是
您最近一年使用:0次
名校
解题方法
10 . 以含钼( )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下: 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有 、
、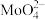 、
、___________ 。欲提高单位时间内钼的浸取率,可以采取的措施有___________ (任写一点)。
(3)除杂。向浸取后的滤液中通入过量 ,过滤。通入过量
,过滤。通入过量 的目的
的目的___________ 。
(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的 小于6,使
小于6,使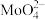 转化为
转化为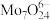 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为___________ 。
(5)应用。将 制成
制成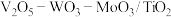 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度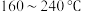 之间,
之间, 转化率不高的原因是
转化率不高的原因是___________ 。
 )废催化剂(含
)废催化剂(含 ,以及
,以及 、
、 、
、 等)为原料制备
等)为原料制备 ,其过程表示如下:
,其过程表示如下: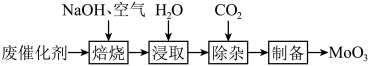
 固体置于焙烧炉中,通入足量空气加热至
固体置于焙烧炉中,通入足量空气加热至 充分反应。焙烧过程中
充分反应。焙烧过程中 转化为
转化为 的化学方程式为
的化学方程式为(2)浸取。将焙烧所得固体加水浸泡,然后过滤、洗涤。过滤后所得滤液中存在的阴离子有
 、
、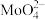 、
、(3)除杂。向浸取后的滤液中通入过量
 ,过滤。通入过量
,过滤。通入过量 的目的
的目的(4)制备。向上述(3)所得滤液中加入硝酸调节溶液的
 小于6,使
小于6,使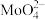 转化为
转化为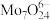 ,然后加入
,然后加入 充分反应,析出
充分反应,析出 ,灼烧后可得到
,灼烧后可得到 。灼烧
。灼烧 得到
得到 的化学方程式为
的化学方程式为(5)应用。将
 制成
制成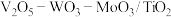 催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得
催化剂,用于氨催化还原氮氧化物,一定压强下,将氨氮比为1.0的混合气体按一定流速通入装有上述催化剂的反应装置,测得 的转化率随温度的变化关系如图所示。在温度
的转化率随温度的变化关系如图所示。在温度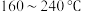 之间,
之间, 转化率不高的原因是
转化率不高的原因是
您最近一年使用:0次
2024-01-28更新
|
895次组卷
|
4卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题
湖南省株洲市第一中学2021-2022学年高三上学期期末测试化学试题2024届江苏省连云港市高三第一次调研考试(一模)化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)江苏省泰州中学2023-2024学年高二下学期5月期中考试化学试题




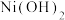
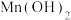

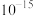

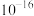
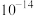
 /%
/% /%
/% /%
/%

