名校
解题方法
1 . 亚硝酸钙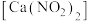 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应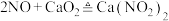 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质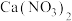 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: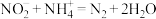 ;“还原
;“还原 ”时加入
”时加入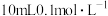 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
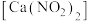 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应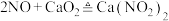 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。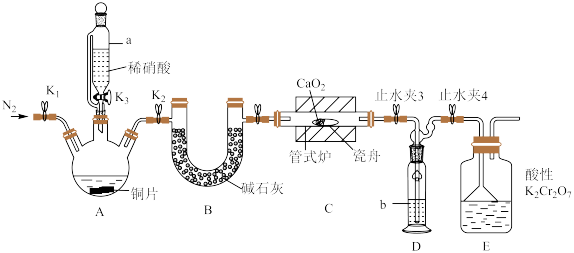
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质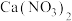 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: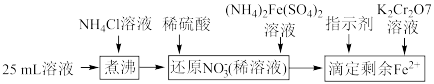
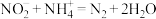 ;“还原
;“还原 ”时加入
”时加入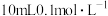 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近一年使用:0次
2024-05-10更新
|
398次组卷
|
8卷引用: 湖南省北师联盟2024届高三下学期模拟考试三模化学试题
名校
2 . Ⅰ.由FeCl3·6H2O制备无水FeCl3,将FeCl3·6H2O与液体SOCl2混合并加热,制得无水FeCl3。已知SOCl2沸点为77℃,反应方程式为 ,装置如下图所示(夹持和加热装置略)。
,装置如下图所示(夹持和加热装置略)。___________ 。NaOH溶液的作用是___________ 。
(2)由下列结晶水合物制备无水盐,适宜使用上述方法的是___________ (填标号)。
a. b.
b.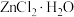 c.
c.
Ⅱ.世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
ⅲ.将一定量的混合气体通入锥形瓶中吸收;
ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
ⅴ.用 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(
硫代硫酸钠标准溶液滴定锥形瓶中的溶液( ),指示剂显示终点时共用去10.00mL硫代硫酸钠溶液。
),指示剂显示终点时共用去10.00mL硫代硫酸钠溶液。
(3)在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为___________ 。
②ⅴ中加入的指示剂通常为淀粉溶液,滴定至终点的现象是___________ 。
③测得混合气中ClO2的质量为___________ g(保留四位有效数字)。
(4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是___________ (填标号)。
a.明矾 b.碘化钾 c.硫酸亚铁 d.盐酸
 ,装置如下图所示(夹持和加热装置略)。
,装置如下图所示(夹持和加热装置略)。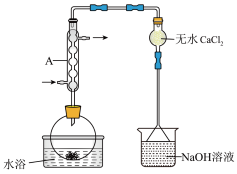
(2)由下列结晶水合物制备无水盐,适宜使用上述方法的是
a.
 b.
b.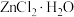 c.
c.
Ⅱ.世界环保联盟要求ClO2逐渐取代Cl2作为自来水消毒剂。
实验室用NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料,通过以下过程制备ClO2:
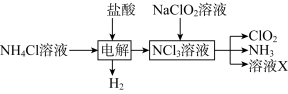
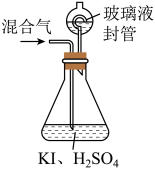
ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
ⅲ.将一定量的混合气体通入锥形瓶中吸收;
ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
ⅴ.用
 硫代硫酸钠标准溶液滴定锥形瓶中的溶液(
硫代硫酸钠标准溶液滴定锥形瓶中的溶液( ),指示剂显示终点时共用去10.00mL硫代硫酸钠溶液。
),指示剂显示终点时共用去10.00mL硫代硫酸钠溶液。(3)在此过程中:
①锥形瓶内ClO2与碘化钾反应的离子方程式为
②ⅴ中加入的指示剂通常为淀粉溶液,滴定至终点的现象是
③测得混合气中ClO2的质量为
(4)用ClO2处理过的饮用水会含有一定量的亚氯酸盐。若要除去超标的亚氯酸盐,下列物质最适宜的是
a.明矾 b.碘化钾 c.硫酸亚铁 d.盐酸
您最近一年使用:0次
3 . 氧钒(Ⅳ)碱式碳酸铵晶体{化学式为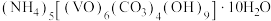 ,
,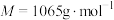 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:

 溶液
溶液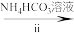 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体
已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为_____ ,第二步电离方程式为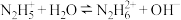 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:_____ 。
(2)步骤ii可通过如图装置完成。 的优点为
的优点为_____ ,检查其气密性的操作为_____ 。
②实验开始时,先打开_____ (填“K1”或“K2”)。
③盛装NH4HCO3溶液的仪器名称为_____ 。
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg
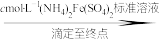 再重复实验两次。
再重复实验两次。
已知: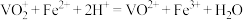 。
。
①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:_____ 。
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为_____  。
。
③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果_____ (填“偏大”“偏小”或“无影响”)。
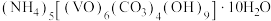 ,
,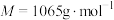 }是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
}是一种难溶于水的化合物,它是制备热敏材料VO2的原料。实验室以V2O5为原料,通过还原、转化、沉淀等步骤合成该晶体的流程如下:
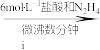
 溶液
溶液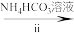 氧钒(Ⅳ)碱式碳酸铵晶体
氧钒(Ⅳ)碱式碳酸铵晶体已知:+4价钒在弱酸性条件下具有还原性。
回答下列问题:
(1)N2H4为二元弱碱,其在水中的电离过程与NH3类似,其第一步电离方程式为
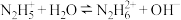 ;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:
;N2H4与液氧接触能自燃,产物对环境无污染,写出发生反应的化学方程式:(2)步骤ii可通过如图装置完成。
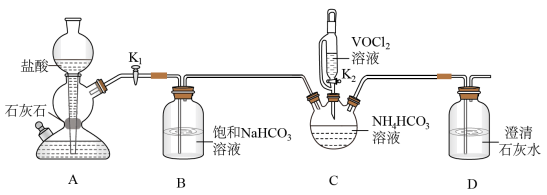
 的优点为
的优点为②实验开始时,先打开
③盛装NH4HCO3溶液的仪器名称为
(3)测定氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度。
实验步骤:粗产品wg
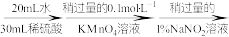
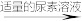
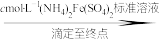 再重复实验两次。
再重复实验两次。已知:
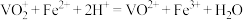 。
。①滴入NaNO2溶液的目的是除去KMnO4,写出其反应的离子方程式:
②若平均消耗cmol/L(NH4)2Fe(SO4)2标准溶液的体积为amL,则氧钒(Ⅳ)碱式碳酸铵晶体粗产品的纯度为
 。
。③若其他操作均正确,但NaNO2的加入量不足,会引起测定结果
您最近一年使用:0次
2024-05-08更新
|
273次组卷
|
3卷引用:湖南省衡阳市祁东县2024届高三第三次联考(三模)化学试题
名校
4 . 工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、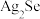 等)回收Se。
等)回收Se。 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。
②Se难溶于水,沸点684.9℃,易与 反应。
反应。
③反应的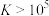 ,代表可完全转化。室温下
,代表可完全转化。室温下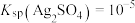 ,
,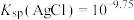 。
。
下列说法正确的是
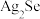 等)回收Se。
等)回收Se。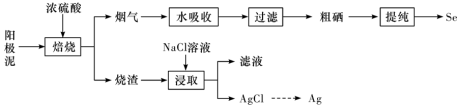
 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。②Se难溶于水,沸点684.9℃,易与
 反应。
反应。③反应的
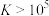 ,代表可完全转化。室温下
,代表可完全转化。室温下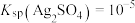 ,
,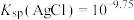 。
。下列说法正确的是
A.理论上,发生反应的 和 和 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.在真空中可进行粗硒提纯,可降低体系中硒的沸点 |
C.“滤液”为 溶液 溶液 |
D.加入NaCl溶液浸取时发生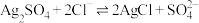 ,该反应过程不可完全转化 ,该反应过程不可完全转化 |
您最近一年使用:0次
2024-05-07更新
|
239次组卷
|
3卷引用:湖南省长沙市长郡中学2024届高三下学期一模化学试题
湖南省长沙市长郡中学2024届高三下学期一模化学试题专题8 水溶液中的离子反应与平衡-沉淀溶解平衡(已下线)暑假作业19 化学工艺流程题-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)
解题方法
5 . 一种从含银废催化剂[其主要成分为银和铼( ),还含有
),还含有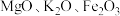 和
和 ]中回收银和铼的工艺流程如图所示。下列说法错误的是
]中回收银和铼的工艺流程如图所示。下列说法错误的是
 ),还含有
),还含有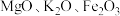 和
和 ]中回收银和铼的工艺流程如图所示。下列说法错误的是
]中回收银和铼的工艺流程如图所示。下列说法错误的是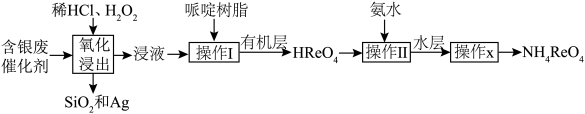
A.“氧化浸出”过程中铼被氧化,该反应中氧化剂与还原剂物质的量之比为 |
B.实验室中完成“操作 ”和“操作 ”和“操作 ”所需要的玻璃仪器主要有烧杯和分液漏斗 ”所需要的玻璃仪器主要有烧杯和分液漏斗 |
| C.“操作x”为结晶过程,该过程不可选用蒸发结晶,应选用降温结晶 |
D.“操作 ”过程中为加快反应速率,可在高温条件下进行 ”过程中为加快反应速率,可在高温条件下进行 |
您最近一年使用:0次
2024-05-06更新
|
382次组卷
|
5卷引用:湖南省衡阳县四中2024届高三下学期高考考前冲刺卷(四)化学试题
湖南省衡阳县四中2024届高三下学期高考考前冲刺卷(四)化学试题贵州省部分学校2024年高三下学期高考信息考试化学试题(已下线)暑假作业04 突破氧化还原反应及陌生方程式书写综合应用-【暑假分层作业】2024年高二化学暑假培优练(2025届一轮复习通用)(已下线)专题04 氧化还原反应-备战2025年高考化学真题题源解密(新高考通用)(已下线)专题09 无机物的反应与转化 微型工艺流程-备战2025年高考化学真题题源解密(新高考通用)
6 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示置换反应的是___________ (填字母)。
①下列应用或事实与胶体的性质有关系的是___________ 。
A.在 溶液中滴加
溶液中滴加 溶液出现红褐色沉淀
溶液出现红褐色沉淀
B.在河流入海处易形成三角洲
C.用石膏或盐卤点制豆腐
②提纯明胶的水溶液和 溶液装置是下列中的
溶液装置是下列中的___________ (填序号)。___________ (填化学式),若该反应生成标准状况下的气体为8.96L,则该反应中转移电子的数目为___________ 。
(4)中国古代著作中有“银针验毒”的记录,其原理为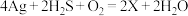 ,则X的化学式是
,则X的化学式是___________ ,其中 在该反应中
在该反应中___________ (填标号)。
A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
(1)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示置换反应的是

①下列应用或事实与胶体的性质有关系的是
A.在
 溶液中滴加
溶液中滴加 溶液出现红褐色沉淀
溶液出现红褐色沉淀B.在河流入海处易形成三角洲
C.用石膏或盐卤点制豆腐
②提纯明胶的水溶液和
 溶液装置是下列中的
溶液装置是下列中的A. B.
B.  C.
C.
(4)中国古代著作中有“银针验毒”的记录,其原理为
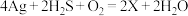 ,则X的化学式是
,则X的化学式是 在该反应中
在该反应中A.作氧化剂 B.作还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂又不是还原剂
您最近一年使用:0次
名校
7 . 对燃油尾气污染物进行脱硝处理有助于减少空气污染,可使用氨将氮氧化物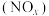 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为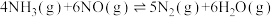 。下列说法正确的是
。下列说法正确的是
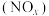 转化为无害气体,发生的反应为
转化为无害气体,发生的反应为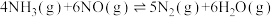 。下列说法正确的是
。下列说法正确的是A.标准状况下,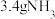 的体积约为 的体积约为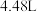 |
B. 可用作食品的保护气,原因是 可用作食品的保护气,原因是 的化学性质不活泼 的化学性质不活泼 |
C.该反应中, 与足量的 与足量的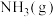 反应,理论上可得到 反应,理论上可得到 |
D.该反应中,每断裂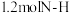 键,同时转移电子的物质的量为 键,同时转移电子的物质的量为 |
您最近一年使用:0次
名校
8 . SO2、NOx为常见的空气污染物,会引起酸雨、光化学烟雾等污染问题。研究者以多种方法进行“脱硫”“脱硝”。
(1)利用工业废碱渣(主要成分为Na2CO3)来吸收含SO2的烟气,同时得到Na2SO3粗品。其流程如图所示:___________ ;
②SO2被Na2CO3溶液吸收时,会释放出一种无色无味气体,该反应的离子方程式为___________ 。
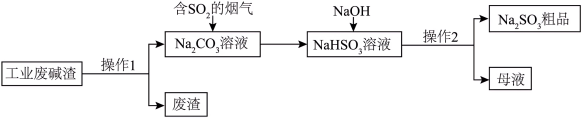
(2)利用含有SO2的烟气制备NaClO2。其流程如图所示:___________ 。
②反应b中的氧化剂和还原剂的物质的量之比为___________ 。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”。控制溶液的pH=5.5,一定时间内,温度对SO2、NO脱除率的影响如图所示: 、NO
、NO 。
。
①NO在吸收过程中,反应的离子方程式是___________ 。
②50℃时,吸收液中烟气转化生成的Cl‒和NO 的物质的量之比为
的物质的量之比为___________ 。
③烟气中NOx含量的测定:将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO ,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为___________ mg·L‒1。
(1)利用工业废碱渣(主要成分为Na2CO3)来吸收含SO2的烟气,同时得到Na2SO3粗品。其流程如图所示:
②SO2被Na2CO3溶液吸收时,会释放出一种无色无味气体,该反应的离子方程式为
(2)利用含有SO2的烟气制备NaClO2。其流程如图所示:
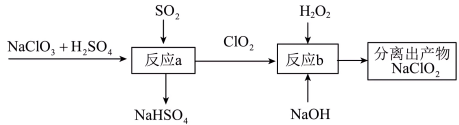
②反应b中的氧化剂和还原剂的物质的量之比为
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”“脱硝”。控制溶液的pH=5.5,一定时间内,温度对SO2、NO脱除率的影响如图所示:
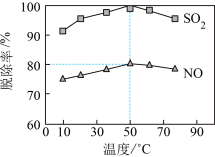
 、NO
、NO 。
。①NO在吸收过程中,反应的离子方程式是
②50℃时,吸收液中烟气转化生成的Cl‒和NO
 的物质的量之比为
的物质的量之比为③烟气中NOx含量的测定:将VL气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO
 ,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
,加水稀释至100mL。量取25mL该溶液,加入V1mLc1mol·L‒1FeSO4溶液(过量),充分反应后,用c2mol·L‒1K2Cr2O7溶液和剩余的Fe2+恰好反应(该反应的还原产物为Cr3+),消耗V2mL。气样中NOx折合成NO的含量为
您最近一年使用:0次
2024-04-27更新
|
439次组卷
|
6卷引用:湖南省邵阳市邵东市223-2024学年高一下学期期末考试化学试题
湖南省邵阳市邵东市223-2024学年高一下学期期末考试化学试题北师大附属实验中学2023-2024学年度第二学期期中试卷北京师范大学附属实验中学2023-2024学年高一下学期期中考试化学试题(已下线)期末押题卷02-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(辽宁专用)(已下线)专题01 化工生产中的重要非金属元素-【暑假自学课】2024年新高二化学暑假提升精品讲义(人教版2019)山东省泰安市泰山国际学校2023-2024学年高二下学期期末考试化学试卷
9 . 硝酸镍、硝酸钠在陶瓷、玻璃工业应用广泛。以废弃镍板(含有少量的氧化铝杂质)生产硝酸镍、硝酸钠工艺流程如下:
(1)工业生产普通玻璃的主要原料有石英砂、__________ 、__________ 。
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是__________ ;若温度太高,可能导致的后果是__________ 。
(3)假如Ni与浓硝酸反应产生的混合气体中 ,该反应的离子方程式为
,该反应的离子方程式为__________ 。
(4)向“浸取液”中加入 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为_______ 。__________ 。
(6)向“转化器”中加入稀硝酸的目的是__________ 。
(7)已知:①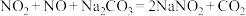 ;
;
②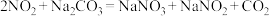 。
。
若将一定体积的 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为__________ 。

(1)工业生产普通玻璃的主要原料有石英砂、
(2)“反应器”中需控制反应温度50~60℃,若温度太低,可能导致的后果是
(3)假如Ni与浓硝酸反应产生的混合气体中
 ,该反应的离子方程式为
,该反应的离子方程式为(4)向“浸取液”中加入
 调节pH至5~6,能除去浸取液中的
调节pH至5~6,能除去浸取液中的 ,相应原理为
,相应原理为__________+
 +
+ __________
__________ +
+ _________+
_________+
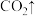 。
。
(6)向“转化器”中加入稀硝酸的目的是
(7)已知:①
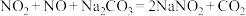 ;
;②
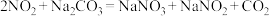 。
。若将一定体积的
 、NO混合气体,通入
、NO混合气体,通入 溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
溶液中恰好被完全吸收,则反应中被氧化的氮原子与被还原的氮原子的质量之比为
您最近一年使用:0次
10 . 下列类比或推理结果正确的是
A.已知 和浓硫酸可发生归中反应,则 和浓硫酸可发生归中反应,则 和硝酸也可发生归中反应 和硝酸也可发生归中反应 |
B.已知加热时Cu与 反应生成 反应生成 ,则加热时Cu与S反应生成 ,则加热时Cu与S反应生成 |
C.已知C、Si形成的氧化物晶体类型不同,可推知等物质的量的 和 和 中σ键数目不相同 中σ键数目不相同 |
D.已知氧化性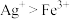 ,根据溶液中 ,根据溶液中 和 和 易发生氧化还原反应,推断溶液中 易发生氧化还原反应,推断溶液中 和 和 也易发生氧化还原反应 也易发生氧化还原反应 |
您最近一年使用:0次



