1 . 铊(Tl)本身是一种剧毒物质,为毒性最大的金属元素之一,但是铊在工业中的用途非常广泛,主要存在于一些矿物和工业废水中,也可以从含铊的合金中提取.从某铅锌厂的富铊灰(主要成分为 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示:
①在氯化物-硫酸水溶液中,铊元素以 形式存在;
形式存在;
(2)萃取过程的反应原理为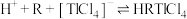 .
.
请回答下列问题:
(1)基态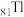 原子核外电子的运动状态有
原子核外电子的运动状态有________ 种.
(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有________________ (写出两条).
(3)写出“浸取I”中 发生反应的化学方程式:
发生反应的化学方程式:________________ ,“滤渣”的主要成分是________ (填化学式).
(4)请从化学平衡的角度解释“反萃取”过程中加入 溶液的原因:
溶液的原因:________________ .
(5)写出“还原氯化沉淀”中反应的离子方程式:________________ .
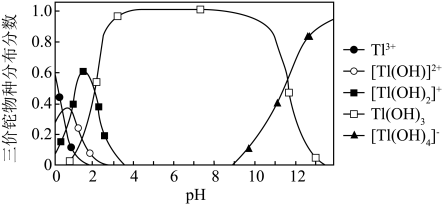
(6)通过沉淀法也可以去除工业废水中的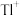 和
和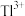 .
.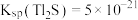 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中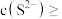
________  (假设污水中铊全部以
(假设污水中铊全部以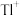 形式存在).
形式存在).
②向含铊废水中加入溴水,使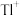 充分氧化成
充分氧化成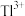 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是________________ .
 、
、 、
、 、
、 、
、 )中回收铊的工艺流程如图所示:
)中回收铊的工艺流程如图所示: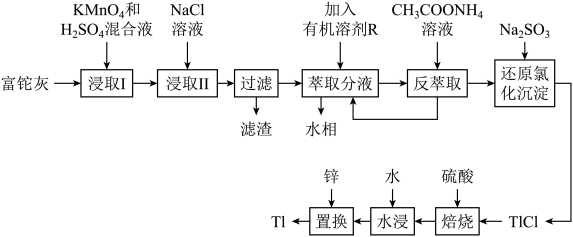
①在氯化物-硫酸水溶液中,铊元素以
 形式存在;
形式存在;(2)萃取过程的反应原理为
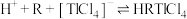 .
.请回答下列问题:
(1)基态
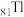 原子核外电子的运动状态有
原子核外电子的运动状态有(2)“浸取I”过程中为提高铊的浸取速率,可采取的措施有
(3)写出“浸取I”中
 发生反应的化学方程式:
发生反应的化学方程式:(4)请从化学平衡的角度解释“反萃取”过程中加入
 溶液的原因:
溶液的原因:(5)写出“还原氯化沉淀”中反应的离子方程式:
(6)通过沉淀法也可以去除工业废水中的
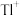 和
和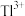 .
.
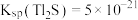 ,某地区规定工业污水中铊的污染物排放限值为
,某地区规定工业污水中铊的污染物排放限值为 ,若铊的含量符合国家排放限值,则处理后的废水中
,若铊的含量符合国家排放限值,则处理后的废水中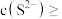
 (假设污水中铊全部以
(假设污水中铊全部以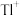 形式存在).
形式存在).②向含铊废水中加入溴水,使
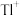 充分氧化成
充分氧化成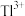 ,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
,调节溶液pH,沉淀去除铊元素.若pH过大,铊元素去除率下降的原因是
您最近一年使用:0次
2 . 叠氮化钠( )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以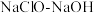 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(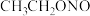 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
 )常用于汽车安全气囊的气源,工业上以
)常用于汽车安全气囊的气源,工业上以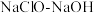 混合液和尿素
混合液和尿素 为原料,先制备水合肼(
为原料,先制备水合肼( ,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(
,具有强还原性),水合肼再与NaOH、亚硝酸乙酯(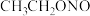 ,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
,沸点为17℃)反应合成叠氮化钠,该反应为放热反应,其主要流程如图所示,下列说法错误的是
A.“反应器1”是将尿素溶液加入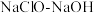 混合液中充分反应 混合液中充分反应 |
B.“余液”的主要成分可能是 、NaCl 、NaCl |
C.若“反应器2”中生成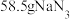 ,则转移电子的物质的量为3mol ,则转移电子的物质的量为3mol |
| D.实际工业生产中,“反应器2”应做冷却处理 |
您最近一年使用:0次
3 . 工业上处理含铬( )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:
Ⅰ. 还原法:含铬酸性废水
还原法:含铬酸性废水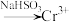 (含
(含 等)
等)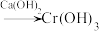 沉淀(含
沉淀(含 等沉淀)
等沉淀)
Ⅱ.电解法:含铬酸性废水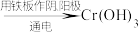 沉淀[含
沉淀[含 等沉淀]
等沉淀]
下列说法错误的是
 )酸性废水有多种方法,其中两种方法如下:
)酸性废水有多种方法,其中两种方法如下:Ⅰ.
 还原法:含铬酸性废水
还原法:含铬酸性废水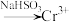 (含
(含 等)
等)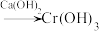 沉淀(含
沉淀(含 等沉淀)
等沉淀)Ⅱ.电解法:含铬酸性废水
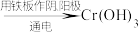 沉淀[含
沉淀[含 等沉淀]
等沉淀]下列说法错误的是
A. 和 和 中的S原子都采用 中的S原子都采用 杂化 杂化 |
B.Ⅰ和Ⅱ中,等量的 发生还原反应时消耗的 发生还原反应时消耗的 的量不同 的量不同 |
C.Ⅰ中参加反应的 |
D.Ⅱ中处理含 的废水转移6mol电子 的废水转移6mol电子 |
您最近一年使用:0次
4 . [Cu(NH3)4]SO4•H2O是铜的重要配合物,其制备原料之一CuSO4可用废铜屑制备,其实验方案如下:
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
方案1:先灼烧废铜屑,再溶于稀硫酸,经系列操作得到CuSO4•5H2O;
方案2:加热废铜屑和98.3%硫酸的混合物;
方案3:在废铜屑和稀硫酸的混合液中滴加双氧水;
方案4:在废铜屑和稀硫酸的混合液中通入热空气。
下列叙述错误的是
| A.方案1使用的玻璃仪器有烧杯、分液漏斗、玻璃棒和酒精灯 |
| B.方案2中参与反应的硫酸利用率为50%,且产生大气污染物 |
| C.方案3的离子方程式为Cu+H2O2+2H+=Cu2++2H2O |
D.方案4的化学方程式为2Cu+H2SO4+O2 2CuSO4+2H2O 2CuSO4+2H2O |
您最近一年使用:0次
名校
5 .  可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以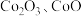 的形式存在,还含有
的形式存在,还含有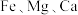 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: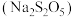 常用作食品抗氧化剂。
常用作食品抗氧化剂。
②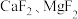 难溶于水。
难溶于水。
③部分金属阳离子形成氢氧化物沉淀的 如表所示:
如表所示:
回答下列问题:
(1)“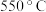 焙烧”的目的是
焙烧”的目的是__________________ 。
(2)“浸取”的过程中, 的主要作用是
的主要作用是__________________ (用离子方程式表示)。若用盐酸代替 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因__________________ 。
(3)“滤液1”中加入 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为_________ 。
(4)“滤渣2”的主要成分为_________ (填化学式)。
(5)已知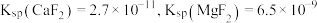 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中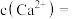
_________ (保留3位有效数字)。
(6)钴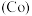 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的_________ 极(填“a”或“b”)。
②电解过程中Ⅱ室溶液 变小,则离子交换膜2为
变小,则离子交换膜2为_________ (填“阴”或“阳”)离子交换膜。
 可用于玻璃和陶瓷的着色剂。由含钴可矿(
可用于玻璃和陶瓷的着色剂。由含钴可矿( 元素主要以
元素主要以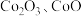 的形式存在,还含有
的形式存在,还含有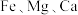 元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示:
元素,碳及有机物等)制取氯化钴晶体的一种工艺流程如图所示: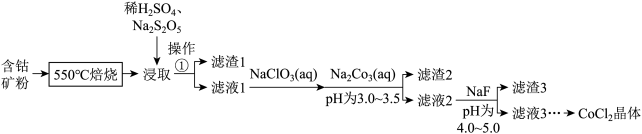
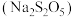 常用作食品抗氧化剂。
常用作食品抗氧化剂。②
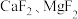 难溶于水。
难溶于水。③部分金属阳离子形成氢氧化物沉淀的
 如表所示:
如表所示:
|
|
|
|
| |
开始沉淀 | 0.3 | 2.7 | 7.2 | 7.6 | 9.6 |
完全沉淀 | 1.1 | 3.2 | 9.2 | 9.6 | 11.1 |
(1)“
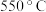 焙烧”的目的是
焙烧”的目的是(2)“浸取”的过程中,
 的主要作用是
的主要作用是 和
和 的混合液也能达到目的,从环保角度分析不采用盐酸的原因
的混合液也能达到目的,从环保角度分析不采用盐酸的原因(3)“滤液1”中加入
 溶液,反应过程中氧化剂与还原剂的物质的量之比为
溶液,反应过程中氧化剂与还原剂的物质的量之比为(4)“滤渣2”的主要成分为
(5)已知
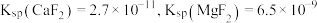 ,当
,当 恰好沉淀完全时(浓度为
恰好沉淀完全时(浓度为 ),溶液中
),溶液中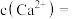
(6)钴
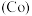 的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含
的合金材料广泛应用于航空航天、机械制造等领域。用乙醇燃料电池作为电源电解含 的水溶液制备金属钴的装置如图2、3所示。
的水溶液制备金属钴的装置如图2、3所示。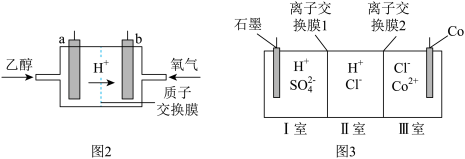
 电极应连接乙醇燃料电池的
电极应连接乙醇燃料电池的②电解过程中Ⅱ室溶液
 变小,则离子交换膜2为
变小,则离子交换膜2为
您最近一年使用:0次
名校
解题方法
6 . 某科研团队以溴苯与catB—Br的偶联联反应构建C-B键,反应机理如图,下列说法正确的是

| A.过程中Ni的化合价未发生改变 |
| B.L-Ni-Br为中间产物 |
| C.catB·为催化剂 |
D.理论上产生1mol  消耗Zn与溴苯的物质的量之比为1∶1 消耗Zn与溴苯的物质的量之比为1∶1 |
您最近一年使用:0次
名校
解题方法
7 . 铬广泛应用于冶金、化工、铸铁、耐火及高精端科技等领域。工业上以碳素铬铁(铁铬合金)为原料,利用电解法制取金属铬的工艺流程如图所示: 。
。
回答下列问题:
(1)“溶解”前,粉碎碳素铬铁的目的是___________ 。
(2)“溶解”步骤中,需加热到105℃,写出铬与浓硫酸反应的化学方程式:___________ ;碳素铬铁过量时会产生 ,阳极液(
,阳极液( )进入到“溶解”步骤中,与
)进入到“溶解”步骤中,与 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(3)若铬铵矾晶体为二十四水结晶水合物,属于复盐,其中铬的化合价为+3价,则铬铵矾晶体的化学式为___________ 。
(4)若以惰性电极进行“电解”,Cr3+在阳极放电的电极反应式为___________ ,当外电路有0.6mol电子转移,则在阴极上生成铬的质量为___________ g。
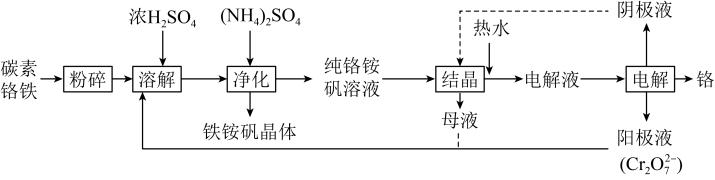
(5)Cr单质的晶胞结构如图所示。已知晶体密度为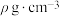 ,
, 为阿伏加德罗常数的值,则Cr原子的半径为
为阿伏加德罗常数的值,则Cr原子的半径为___________ nm(用含有 、
、 的代数式表示)。
的代数式表示)。
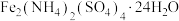 。
。回答下列问题:
(1)“溶解”前,粉碎碳素铬铁的目的是
(2)“溶解”步骤中,需加热到105℃,写出铬与浓硫酸反应的化学方程式:
 ,阳极液(
,阳极液(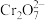 )进入到“溶解”步骤中,与
)进入到“溶解”步骤中,与 发生反应的离子方程式为
发生反应的离子方程式为(3)若铬铵矾晶体为二十四水结晶水合物,属于复盐,其中铬的化合价为+3价,则铬铵矾晶体的化学式为
(4)若以惰性电极进行“电解”,Cr3+在阳极放电的电极反应式为
(5)Cr单质的晶胞结构如图所示。已知晶体密度为
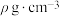 ,
, 为阿伏加德罗常数的值,则Cr原子的半径为
为阿伏加德罗常数的值,则Cr原子的半径为 、
、 的代数式表示)。
的代数式表示)。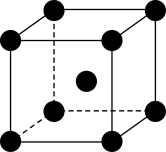
您最近一年使用:0次
名校
8 . 工业上以精炼铜的阳极泥为原料(主要成分为Se、CuSe、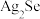 等)回收Se。
等)回收Se。 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。
②Se难溶于水,沸点684.9℃,易与 反应。
反应。
③反应的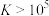 ,代表可完全转化。室温下
,代表可完全转化。室温下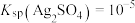 ,
,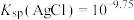 。
。
下列说法正确的是
 等)回收Se。
等)回收Se。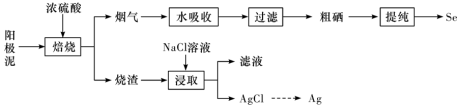
 和
和 ,被水吸收时发生反应。
,被水吸收时发生反应。②Se难溶于水,沸点684.9℃,易与
 反应。
反应。③反应的
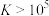 ,代表可完全转化。室温下
,代表可完全转化。室温下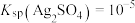 ,
,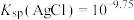 。
。下列说法正确的是
A.理论上,发生反应的 和 和 的物质的量之比为1∶2 的物质的量之比为1∶2 |
| B.在真空中可进行粗硒提纯,可降低体系中硒的沸点 |
C.“滤液”为 溶液 溶液 |
D.加入NaCl溶液浸取时发生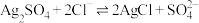 ,该反应过程不可完全转化 ,该反应过程不可完全转化 |
您最近一年使用:0次
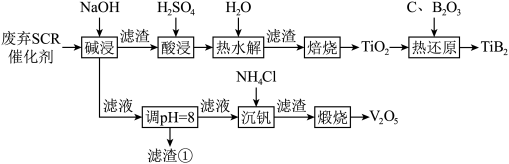
9 . 二硼化钛(TiB2)是一种高熔点、高硬度、电阻小的导电陶瓷材料,在工业领域具有广泛的应用。利用废弃SCR催化剂(主要含TiO2、V2O5、Al2O3、SiO2等),制备TiB2并回收钒的工艺流程如图所示:
②B2O3高温下蒸气压大、易挥发;
③溶液酸性较强时,五价钒粒子主要以VO 的形式存在。
的形式存在。
回答下列问题:
(1)“酸浸”中生成TiO2+的离子方程式为_____ 。
(2)“滤渣①”的主要成分为_____ (填化学式)。
(3)“热水解”工艺中,经处理可循环利用的物质是_____ (填化学式)。
(4)“热还原”时生成一种可燃性气体,每制备1molTiB2,转移电子的物质的量为_____ mol。过程中B2O3的实际用量超过了理论用量,主要原因是_____ 。
(5)“沉钒”时,溶液pH过低或过高均不利于生成NH4VO3沉淀,原因是_____ 。
(6)含钛X晶体是一种高温超导母体,其晶胞结构如图甲所示(α=β=γ=90°),Ti原子与As原子构成的八面体如图乙所示,阿伏伽德罗常数的值为NA。回答下列问题:_____ 。
②X晶体的密度为_____ g·cm-3。
②B2O3高温下蒸气压大、易挥发;
③溶液酸性较强时,五价钒粒子主要以VO
 的形式存在。
的形式存在。回答下列问题:
(1)“酸浸”中生成TiO2+的离子方程式为
(2)“滤渣①”的主要成分为
(3)“热水解”工艺中,经处理可循环利用的物质是
(4)“热还原”时生成一种可燃性气体,每制备1molTiB2,转移电子的物质的量为
(5)“沉钒”时,溶液pH过低或过高均不利于生成NH4VO3沉淀,原因是
(6)含钛X晶体是一种高温超导母体,其晶胞结构如图甲所示(α=β=γ=90°),Ti原子与As原子构成的八面体如图乙所示,阿伏伽德罗常数的值为NA。回答下列问题:

②X晶体的密度为
您最近一年使用:0次
名校
10 . 以赤泥(含有大量 等的氧化物)为原料制备钪的工艺流程如下。
等的氧化物)为原料制备钪的工艺流程如下。
 等的氧化物)为原料制备钪的工艺流程如下。
等的氧化物)为原料制备钪的工艺流程如下。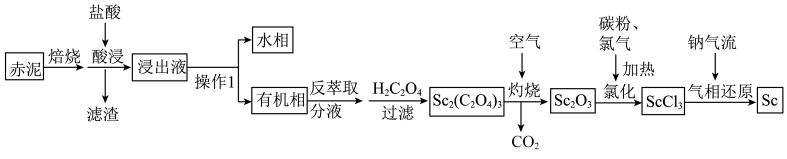
A. 位于元素周期表的第四周期ⅧB族 位于元素周期表的第四周期ⅧB族 |
| B.操作1使用的主要玻璃仪器为漏斗、烧杯 |
C.灼烧时生成 ,消耗 ,消耗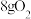 |
D.盐酸溶解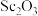 时生成难溶的 时生成难溶的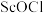 的离子反应为 的离子反应为 |
您最近一年使用:0次
2024-05-13更新
|
194次组卷
|
2卷引用:湖南省长沙市一中2024届高三下学期高考适应性演练(三)化学试题






