名校
解题方法
1 . 氯化六氨合钴{ }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: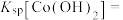
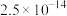 、
、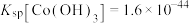 、
、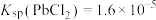 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,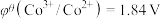 、
、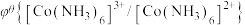
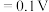 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是___________ (填仪器名称)。___________ ;控制反应温度在55℃的原因为___________ 。
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度___________ (填“大于”“小于”或“等于”)在浓盐酸中的。
(4)与步骤三中过滤相比,步骤四中抽滤的优点为___________ 。
(5)制备产品的总反应方程式为___________ ;步骤二中双氧水可用PbO2或KMnO4代替,其中更适合选用___________ (填化学式)代替双氧水,原因为___________ 。
(6)本实验所得产品的产率为___________ (列出计算式)。
 }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: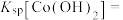
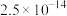 、
、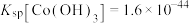 、
、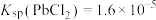 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,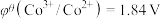 、
、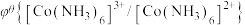
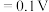 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度
(4)与步骤三中过滤相比,步骤四中抽滤的优点为
(5)制备产品的总反应方程式为
(6)本实验所得产品的产率为
您最近一年使用:0次
2024-04-19更新
|
230次组卷
|
5卷引用:四川省成都市锦江区嘉祥外国语高级中学2023-2024学年高三下学期第二次诊断性考试化学试题
解题方法
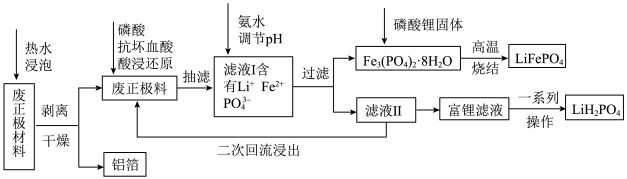
2 . 废旧磷酸铁锂电池回收工艺存在价值低、污染大等问题,某科研组创新性地提出还原酸浸-沉淀-固相再生法,具体工艺流程如下:___________ (填化学式,写一种)。
(2)“酸浸还原”过程中需控制反应温度为70℃,其加热方式为___________ (填“水浴”、“油浴”或“沙浴”)加热。抗坏血酸为有机弱酸,其转化如图a所示。加入抗坏血酸的目的是___________ ,每1mol抗坏血酸参与反应时转移___________ mole-。
(3)在通入氩气的气氛下,向滤液Ⅰ中加入氨水,当调节pH=6.5时,沉淀样品经___________ 实验来分析晶体结构,与Fe3(PO4)2·8H2O的标准卡片吻合。若pH过高,则晶体不纯,可能的原因是___________ 。
(4)“富锂滤液”经蒸发浓缩、冷却结晶、过滤、洗涤、干燥即得到LiH2PO4,在该实验操作过程中不会利用到的仪器有___________ (填字母)。
A.蒸发皿 B.容量瓶 C.玻璃棒 D.直形冷凝管 E.烧杯
(5)已知在该过程中,金属铁元素的浸出率为98.1%、沉淀率为98.2%,则铁元素的总回收率为___________ %(保留三位有效数字)。
(6)某科研团队以Li2SO4和LiOH溶液分别作为阳极室和阴极室的电解液(电极均为惰性电极),将废旧磷酸铁锂粉末悬浮在阳极室中进行悬浮电解,如图b所示:则阴极室的电极反应方程式为:___________ 。
(2)“酸浸还原”过程中需控制反应温度为70℃,其加热方式为
(3)在通入氩气的气氛下,向滤液Ⅰ中加入氨水,当调节pH=6.5时,沉淀样品经
(4)“富锂滤液”经蒸发浓缩、冷却结晶、过滤、洗涤、干燥即得到LiH2PO4,在该实验操作过程中不会利用到的仪器有
A.蒸发皿 B.容量瓶 C.玻璃棒 D.直形冷凝管 E.烧杯
(5)已知在该过程中,金属铁元素的浸出率为98.1%、沉淀率为98.2%,则铁元素的总回收率为
(6)某科研团队以Li2SO4和LiOH溶液分别作为阳极室和阴极室的电解液(电极均为惰性电极),将废旧磷酸铁锂粉末悬浮在阳极室中进行悬浮电解,如图b所示:则阴极室的电极反应方程式为:

您最近一年使用:0次
2024-04-16更新
|
358次组卷
|
3卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
解题方法
3 . 偏磷酸钡Ba(PO3)2具有耐高温、透光性良好等性能,是制备磷酸盐光学玻璃的基础物质。利用湿法磷酸(主要成分为H3PO4,含有少量Mg2+、Fe3+、 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示: 时:①
时:①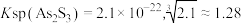 ;
;
②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为___________ 。
(2)“滤渣2”的主要成分有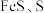 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为___________ ; 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为___________  [当
[当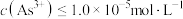 时认为沉淀完全]。
时认为沉淀完全]。
(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为___________ (填化学式)。
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是___________ 。
(5)“结晶”后得到 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为___________ ;比较 键角:
键角: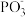
_________  (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是___________ 。
 、
、 等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
等杂质)制备偏磷酸钡的一种工艺的主要流程如图所示:
 时:①
时:①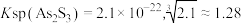 ;
;②将NH3通入H3PO4溶液中,当pH=3.8~4.5时生成NH4H2PO4,pH=8.0~8.2时生成(NH4)2HPO4。
回答下列问题:
(1)“滤渣1”中含硫化合物的化学式为
(2)“滤渣2”的主要成分有
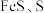 及
及 ,其中生成
,其中生成 的离子方程式为
的离子方程式为 下,当
下,当 沉淀完全时,
沉淀完全时, 至少为
至少为 [当
[当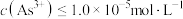 时认为沉淀完全]。
时认为沉淀完全]。(3)“氨化”的目的之一是通入NH3调节溶液的pH,当溶液pH为4.3时H3PO4转化为
(4)“脱镁”的目的是生成MgF2沉淀除去Mg2+。若将流程中“氨化”与“脱镁”交换,Mg2+沉淀不完全,原因是
(5)“结晶”后得到
 晶体,“煅烧”时生成
晶体,“煅烧”时生成 和
和 等物质,其反应的化学方程式为
等物质,其反应的化学方程式为 键角:
键角: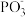
 (选填“
(选填“ ”“
”“ ”或“
”或“ ”),其原因是
”),其原因是
您最近一年使用:0次
2024-04-15更新
|
294次组卷
|
3卷引用:2024届四川省雅安市天全中学高三下学期模拟预测化学试题
名校
解题方法
4 . 足量的铜与一定量的浓硝酸充分反应,得到4.48L(标准状况) 与NO的混合气体,这些气体与一定体积的
与NO的混合气体,这些气体与一定体积的 混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入
混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入 溶液,
溶液, 恰好沉淀完全。下列说法正确的是
恰好沉淀完全。下列说法正确的是
 与NO的混合气体,这些气体与一定体积的
与NO的混合气体,这些气体与一定体积的 混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入
混合后通入水中,恰好被完全吸收生成硝酸。向所得硝酸铜溶液中加入 溶液,
溶液, 恰好沉淀完全。下列说法正确的是
恰好沉淀完全。下列说法正确的是| A.此反应过程中转移了0.5mol的电子 |
| B.消耗氧气的体积为1.12L(标准状况) |
C.参加反应的 是0.6mol 是0.6mol |
D.混合气体中含 (标准状况) (标准状况) |
您最近一年使用:0次
2024-04-15更新
|
268次组卷
|
3卷引用:四川省内江六中2023-2024学年高一下期第一次月考化学试卷
解题方法
5 . 以废旧电池[主要含MnO2、MnOOH、Zn、Zn(OH)2、Fe、KOH、、石墨棒]为原料,制备锰锌铁氧体[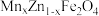 ]的流程如下:
]的流程如下: 在煮沸时易分解。
在煮沸时易分解。
(1)将电池“粉碎”前应先放电,其目的是______________ 。
(2)“酸浸”过程中含锰物质被溶液中的 ,还原为
,还原为 ,其中
,其中 参与反应的离子方程式为
参与反应的离子方程式为______________ 。
(3)“氧化”时加入 将
将 氧化,取氧化后的溶液加入
氧化,取氧化后的溶液加入 ,调节溶液
,调节溶液 为1~2,可制得黄钾铁矾[
为1~2,可制得黄钾铁矾[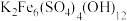 ]沉淀。
]沉淀。
①复杂的含氧酸盐可以表示为氧化物的形式,如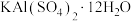 可表示为
可表示为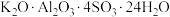 ,则
,则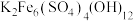 以氧化物的形式可表示为
以氧化物的形式可表示为______________ 。
②写出加入Na2CO3生成黄钾铁矾反应的离子方程式:______________ 。
③检验“氧化”后的溶液中是否还存在Fe2+,可使用的试剂是_______________ (填化学式)。
(4)“共沉淀”前,需测定溶液中锰元素含量。操作步骤:
a.准确量取1.00mL“氧化”后的溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液,振荡;
b.将溶液加热至 ,加入
,加入 充分反应(
充分反应( 被氧化为
被氧化为 )后,再将溶液煮沸;
)后,再将溶液煮沸;
c.冷却后,用 的
的 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液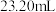 。
。
①步骤b中,煮沸的目的是_______________ 。
②“氧化”后的溶液中 的物质的量浓度为
的物质的量浓度为_________  。
。
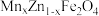 ]的流程如下:
]的流程如下: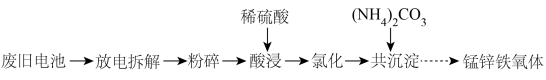
 在煮沸时易分解。
在煮沸时易分解。(1)将电池“粉碎”前应先放电,其目的是
(2)“酸浸”过程中含锰物质被溶液中的
 ,还原为
,还原为 ,其中
,其中 参与反应的离子方程式为
参与反应的离子方程式为(3)“氧化”时加入
 将
将 氧化,取氧化后的溶液加入
氧化,取氧化后的溶液加入 ,调节溶液
,调节溶液 为1~2,可制得黄钾铁矾[
为1~2,可制得黄钾铁矾[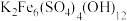 ]沉淀。
]沉淀。①复杂的含氧酸盐可以表示为氧化物的形式,如
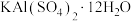 可表示为
可表示为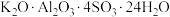 ,则
,则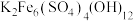 以氧化物的形式可表示为
以氧化物的形式可表示为②写出加入Na2CO3生成黄钾铁矾反应的离子方程式:
③检验“氧化”后的溶液中是否还存在Fe2+,可使用的试剂是
(4)“共沉淀”前,需测定溶液中锰元素含量。操作步骤:
a.准确量取1.00mL“氧化”后的溶液于锥形瓶中,加入少量硫酸、磷酸和硝酸银溶液,振荡;
b.将溶液加热至
 ,加入
,加入 充分反应(
充分反应( 被氧化为
被氧化为 )后,再将溶液煮沸;
)后,再将溶液煮沸;c.冷却后,用
 的
的 标准溶液滴定至终点,平行滴定3次,平均消耗
标准溶液滴定至终点,平行滴定3次,平均消耗 溶液
溶液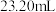 。
。①步骤b中,煮沸的目的是
②“氧化”后的溶液中
 的物质的量浓度为
的物质的量浓度为 。
。
您最近一年使用:0次
2024-04-11更新
|
127次组卷
|
3卷引用:四川省雅安市2023-2024学年高三下学期4月月考理综试题-高中化学
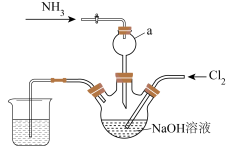
6 . 肼是一种火箭燃料。某小组在实验室用NaClO溶液和NH3反应制备肼(N2H4),并进行相关性质探究实验。相关物质的性质如下:
I.实验室制备N2H4_____________ 。
(2)仪器a的作用是____________ 。
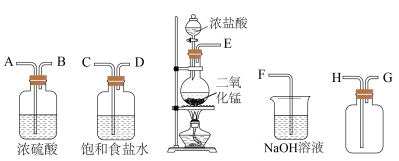
(3)实验室用下列装置制备并收集干净的Cl2,装置的连接顺序是E→__________ →F(用字母表示)。___________ 。
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(5)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知: )。
)。
①滴定到达终点的现象是___________ 。
②重复上述滴定实验2~3次,测得消耗碘标准溶液体积的平均值为20.00mL,产品中水合肼的质量分数为__________ 。
Ⅲ.探究肼的化学性质
(6)取三颈烧瓶中溶液,加入适量稀硫酸,振荡,置于冰水浴中冷却,容器底部有无色晶体析出。过滤后用__________ 洗涤,检验洗涤是否完成的操作为____________ 。
物质 | 性状 | 熔点/℃ | 沸点/℃ | 性质 |
N2H4 | 无色液体 | 1.4 | 113 | 与水混溶,有强还原性 |
N2H6SO4 | 无色晶体 | 254 | - | 不溶于75%的乙醇溶液 |
(2)仪器a的作用是
(3)实验室用下列装置制备并收集干净的Cl2,装置的连接顺序是E→
Ⅱ.测定产品中水合肼(N2H4·H2O)的含量
(5)称取产品6.0g,加入适量NaHCO3固体(调节溶液的pH在6.5左右),加水配成250mL溶液,移取25.00mL置于锥形瓶中,并滴加2~3滴淀粉溶液,用0.3000mol/L的碘标准溶液滴定(已知:
 )。
)。①滴定到达终点的现象是
②重复上述滴定实验2~3次,测得消耗碘标准溶液体积的平均值为20.00mL,产品中水合肼的质量分数为
Ⅲ.探究肼的化学性质
(6)取三颈烧瓶中溶液,加入适量稀硫酸,振荡,置于冰水浴中冷却,容器底部有无色晶体析出。过滤后用
您最近一年使用:0次
2024-04-11更新
|
209次组卷
|
5卷引用:四川省雅安市2023-2024学年高三下学期4月月考理综试题-高中化学
名校
解题方法
7 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:___________ 。
(2)高温焙烧时发生的反应方程式为 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子___________ mol。
(3)操作a使用的玻璃仪器除了烧杯、漏斗、还有___________ 。
(4)向滤液A中通入 的目的是
的目的是___________ 。
(5)向溶液B中通入 时反应的离子方程式为
时反应的离子方程式为___________ 。
(6)工业上用生物法处理 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂): 、
、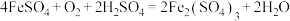 ,由图甲和图乙判断使用硫杆菌的最佳条件为
,由图甲和图乙判断使用硫杆菌的最佳条件为___________ ,若反应温度过高,反应速率下降,其原因是___________ 。
 ,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示:
,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示: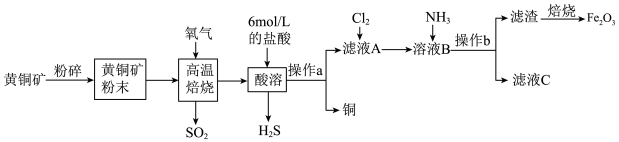
(2)高温焙烧时发生的反应方程式为
 ,1mol
,1mol  参加反应时,反应中转移电子
参加反应时,反应中转移电子(3)操作a使用的玻璃仪器除了烧杯、漏斗、还有
(4)向滤液A中通入
 的目的是
的目的是(5)向溶液B中通入
 时反应的离子方程式为
时反应的离子方程式为(6)工业上用生物法处理
 的原理为(硫杆菌作催化剂):
的原理为(硫杆菌作催化剂): 、
、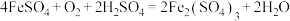 ,由图甲和图乙判断使用硫杆菌的最佳条件为
,由图甲和图乙判断使用硫杆菌的最佳条件为
您最近一年使用:0次
2024-04-07更新
|
157次组卷
|
2卷引用:四川省南充市仪陇县2023-2024学年高一下学期5月月考化学试题
名校
解题方法
8 . 我国学者提出O2氧化HBr生成Br2的反应历程如图所示。下列有关该历程的说法不正确的是
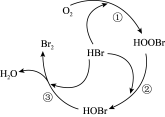
A.O2氧化HBr生成Br2的总反应为 |
| B.中间体HOOBr和HOBr中Br的化合价相同 |
| C.步骤③中,每生成1molBr2转移2mol电子 |
| D.增大HBr的浓度,总反应速率加快 |
您最近一年使用:0次
2024-04-06更新
|
171次组卷
|
2卷引用:专题7 化学反应速率与化学平衡-化学反应速率及影响因素
解题方法
9 . 某实验小组为探究 与
与 的反应,设计如下实验:将
的反应,设计如下实验:将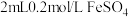 溶液和
溶液和
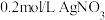 溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。
溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。
回答下列问题:
(1)甲同学根据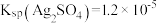 ,推测试管底部的灰色沉淀中有
,推测试管底部的灰色沉淀中有 ,写出生成
,写出生成 的离子方程式
的离子方程式___________ 。
(2)乙同学依据“上层清液呈黄色”,推测上层清液中含有 。
。
①将 氧化成
氧化成 的物质可能是:
的物质可能是: 、
、 或
或__________ (填化学式)。
②实验证明, 氧化
氧化 是主因,通过计算作出分析
是主因,通过计算作出分析_________ ,写出该反应的离子方程式____________ 。
(已知:以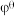 表示标准态(
表示标准态( )时的电极电势,当
)时的电极电势,当 ,反应可以自发进行;
,反应可以自发进行;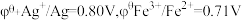 )
)
③乙同学又通过设计如图所示的原电池装置进行探究,当观察到__________ 现象时,证明 氧化了
氧化了 。
。
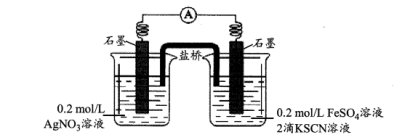
(3)丙同学为了定量研究试管底部灰色固体( 和
和 )的组成,设计了如下操作流程。
)的组成,设计了如下操作流程。
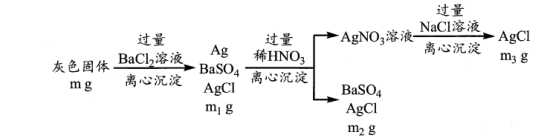
①离心沉淀相比于传统沉淀的优点是____________________ 。
②计算 的质量分数
的质量分数____________________ 。(用流程中的字母表示,列出一个计算式即可)
 与
与 的反应,设计如下实验:将
的反应,设计如下实验:将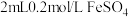 溶液和
溶液和
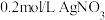 溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。
溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。回答下列问题:
(1)甲同学根据
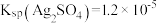 ,推测试管底部的灰色沉淀中有
,推测试管底部的灰色沉淀中有 ,写出生成
,写出生成 的离子方程式
的离子方程式(2)乙同学依据“上层清液呈黄色”,推测上层清液中含有
 。
。①将
 氧化成
氧化成 的物质可能是:
的物质可能是: 、
、 或
或②实验证明,
 氧化
氧化 是主因,通过计算作出分析
是主因,通过计算作出分析(已知:以
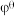 表示标准态(
表示标准态( )时的电极电势,当
)时的电极电势,当 ,反应可以自发进行;
,反应可以自发进行;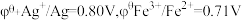 )
)③乙同学又通过设计如图所示的原电池装置进行探究,当观察到
 氧化了
氧化了 。
。
(3)丙同学为了定量研究试管底部灰色固体(
 和
和 )的组成,设计了如下操作流程。
)的组成,设计了如下操作流程。
①离心沉淀相比于传统沉淀的优点是
②计算
 的质量分数
的质量分数
您最近一年使用:0次
名校
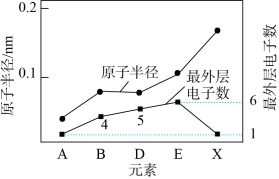
10 . 元素是组成我们生活的世界中一切物质的“原材料”。有A、B、D、E、X、Y、Z七种短周期元素。X与Y处于同一周期,Y的最高价氧化物对应的水化物与强酸、强碱均能反应。Z的单质常温下为气态,可用于制漂白粉。其余元素的信息如图所示:_______ 。(用离子符号表示)
(2)用电子式表示化合物XZ的形成过程_______ 。
(3)X的最高价氧化物对应水化物与Y的最高价氧化物对应水化物反应的离子反应方程式_______ 。
(4)实验室制备DA₃的化学反应方程式_______ 。
(5)物质M由A、B元素组成,写出符合下列条件的M的结构简式_______ 。
a.一定条件下,气态M对 的相对密度为57; b.一氯代物只有一种结构
的相对密度为57; b.一氯代物只有一种结构
(6)硒(Se)与元素E在同一主族,是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的废渣中提取而得。
①Se在元素周期表中位置表示为_______ 。
②废渣中的硒主要以Se和 的形式存在,工业提取硒的流程如下:
的形式存在,工业提取硒的流程如下: 与浓
与浓 反应的化学方程式
反应的化学方程式_______ 。物质A是_______ (填化学式)。
(2)用电子式表示化合物XZ的形成过程
(3)X的最高价氧化物对应水化物与Y的最高价氧化物对应水化物反应的离子反应方程式
(4)实验室制备DA₃的化学反应方程式
(5)物质M由A、B元素组成,写出符合下列条件的M的结构简式
a.一定条件下,气态M对
 的相对密度为57; b.一氯代物只有一种结构
的相对密度为57; b.一氯代物只有一种结构(6)硒(Se)与元素E在同一主族,是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的废渣中提取而得。
①Se在元素周期表中位置表示为
②废渣中的硒主要以Se和
 的形式存在,工业提取硒的流程如下:
的形式存在,工业提取硒的流程如下: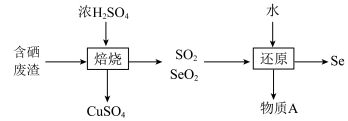
 与浓
与浓 反应的化学方程式
反应的化学方程式
您最近一年使用:0次
2024-04-02更新
|
124次组卷
|
2卷引用:四川省成都市树德中学2023-2024学年高一下学期3月月考化学试题



