1 . Ⅰ.“价类”二维图是学习元素及其化合物的重要工具.如图所示是铁及其化合物的“价类”二维图。__________ 、__________ ;Z在空气中转化为W的化学方程式为__________ 。
(2)含重铬酸根离子 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
______ (填“>”或“<”) 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为__________ g。
Ⅱ.硫酸亚铁晶体 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加__________ 后,溶液变为红色,证实了怀疑。
(4)步骤②反应的离子方程式为__________ ,下列物质中可以用来代替该步骤中的 是
是__________ (填序号)。
① 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠
(5)服用维生素C可使食物中的 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的__________ 性。假设实验中的损耗忽略不计,则该补血剂含铁元素的质量分数为__________ 。

(2)含重铬酸根离子
 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为Ⅱ.硫酸亚铁晶体
 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加
(4)步骤②反应的离子方程式为
 是
是①
 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠(5)服用维生素C可使食物中的
 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的
您最近一年使用:0次
2024-01-24更新
|
146次组卷
|
2卷引用:四川省内江市2023-2024学年高一上学期期末检测题化学试题
名校
2 . 根据所学知识,回答下列问题:
(1)下表是对一些物质进行分类
其中 Na2O2中O____ 价,它____ 碱性氧化物(填“是”或“不是”)
(2)过氧化钠水溶液中加入几滴紫色石蕊试液,现象:___________ ,写出过氧化钠与水反应的离子方程式:___________ 。
(3)实验室氯气不能排放在空气中,可用氢氧化钠溶液处理,其原因是:__________ 。氯气通入到⑥的溶液中的离子方程式:___________ 。
(4)如何要检验某溶液中是否含有钾元素,可以用操作方法:___________ 。
(5)实验室通过反应KMnO4+HCl(浓)—MnCl2+KCl+Cl2↑+H2O(未配平)制备氯气,反应中氯化氢表现出的性质是_____ 。(填写字母)
a.还原性 b.酸性 c.氧化性
请配平该反应,并用双线桥标电子转移的方向和数目:___________ 。
(1)下表是对一些物质进行分类
| 物质类别 | 酸 | 碱 | 盐 | 氧化物 | 单质 |
| 化学式 | ①H2SO4 ②HCl | ③NaOH ④Ba(OH)2 | ⑤NaHCO3 ⑥NaI | ⑦CO2 ⑧Na2O2 | ⑨O2 ⑩Cl2 |
(2)过氧化钠水溶液中加入几滴紫色石蕊试液,现象:
(3)实验室氯气不能排放在空气中,可用氢氧化钠溶液处理,其原因是:
(4)如何要检验某溶液中是否含有钾元素,可以用操作方法:
(5)实验室通过反应KMnO4+HCl(浓)—MnCl2+KCl+Cl2↑+H2O(未配平)制备氯气,反应中氯化氢表现出的性质是
a.还原性 b.酸性 c.氧化性
请配平该反应,并用双线桥标电子转移的方向和数目:
您最近一年使用:0次
3 . 很多化学反应条件不同,产物不同,如 与KOH反应,常温下生成KClO,加热生成
与KOH反应,常温下生成KClO,加热生成 。实验室利用下图装置制备
。实验室利用下图装置制备 ,然后进一步探究其性质。
,然后进一步探究其性质。
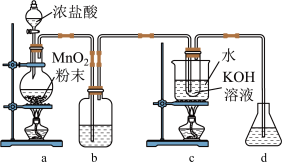
回答下列问题:
(1)装置a可用于实验室制 ,反应的化学方程式是
,反应的化学方程式是_____ 。
(2)装置b的作用是_____ ,可选用_____ 溶液。
(3)c中采用的加热方式是_____ ,反应的离子方程式为_____ ,该反应中氧化剂和还原剂的物质的量之比为_____ 。
(4)若d装置中溶液是NaOH溶液,其作用是_____ 。
(5)取c中溶液,滴加浓盐酸并加热,可产生黄绿色气体,结合上述 的制备实验,可说明在碱性条件下氧化性:
的制备实验,可说明在碱性条件下氧化性:
_____  (填“>”“<”或“=”,下同),酸性条件下氧化性:
(填“>”“<”或“=”,下同),酸性条件下氧化性:
_____  。
。
 与KOH反应,常温下生成KClO,加热生成
与KOH反应,常温下生成KClO,加热生成 。实验室利用下图装置制备
。实验室利用下图装置制备 ,然后进一步探究其性质。
,然后进一步探究其性质。
回答下列问题:
(1)装置a可用于实验室制
 ,反应的化学方程式是
,反应的化学方程式是(2)装置b的作用是
(3)c中采用的加热方式是
(4)若d装置中溶液是NaOH溶液,其作用是
(5)取c中溶液,滴加浓盐酸并加热,可产生黄绿色气体,结合上述
 的制备实验,可说明在碱性条件下氧化性:
的制备实验,可说明在碱性条件下氧化性:
 (填“>”“<”或“=”,下同),酸性条件下氧化性:
(填“>”“<”或“=”,下同),酸性条件下氧化性:
 。
。
您最近一年使用:0次
2024-01-21更新
|
110次组卷
|
3卷引用:四川省南充市阆中东风中学校2023-2024学年高一上学期第二次段考化学试题
名校
4 . 锂电池是目前应用广泛的新型电池,一种回收钴酸锂废旧电池(主要成分为LiCoO2,同时含有少量Fe、Al、C单质)的流程如下图所示。
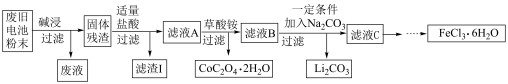
已知:Fe3+能与C2O 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的___________ (填“是”或“不是”)氧化还原反应,CoC2O4·2H2O中C的化合价为___________ ,滤渣I的主要成份为___________ 。
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是___________ 。
写出该过程发生的化学反应方程式___________ 。
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式___________ 。
(4)请设计实验方案检验滤液C中的Cl-。___________
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:_________
___________ClO- +___________Fe3++___________=___________FeO +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。

已知:Fe3+能与C2O
 结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+
结合成[Fe(C2O4)3]3-,[Fe(C2O4)3]3-在强酸性环境下重新转化为Fe3+请回答下列问题:
(1)由滤液A制取CoC2O4·2H2O的过程发生的
(2)用过量的NaOH溶液进行“碱浸”,“碱浸”的目的是
写出该过程发生的化学反应方程式
(3)加入适量盐酸,LiCoO2溶解后生成的Co3+能将Fe2+氧化为Fe3+,请写出该反应的离子方程式
(4)请设计实验方案检验滤液C中的Cl-。
(5)高铁酸钠(Na2FeO4 ,其中铁为+6价)是一种高效多功能水处理剂。工业上用次氯酸钠和氯化铁为原料来制取高铁酸钠,该反应的离子方程式为:
___________ClO- +___________Fe3++___________=___________FeO
 +___________Cl- +___________H2O,请配平该方程式。
+___________Cl- +___________H2O,请配平该方程式。
您最近一年使用:0次
2024-01-16更新
|
268次组卷
|
3卷引用:四川省泸州市泸县第五中学2023-2024学年高一下学期开学化学试题
名校
5 . 化学与我们的生活、生产、环境等息息相关。回答下列问题:
(1)肼(N2H4)常用作火箭推进剂。32g肼分子中含有的电子总数为___________ NA(NA为阿伏伽德罗常数的值),其所含氮原子数与标准状况下___________ LN2中所含的氮原子数相等。
(2)在相同温度和压强下,体积相同的两个容器中分别盛有N2和O2。下列说法不正确的是___________(填序号)。
(3)下列叙述错误的是___________ (填序号)
① 摩尔是国际单位制中七个基本物理量之一;
② 1mol任何物质都含有约6.02×1023个原子;
③ 1L2mol/L的氯化镁溶液中含氯离子为2NA
④ HCl的摩尔质量等于1molHCl分子的质量;
⑤ 1molCO2中含有1mol碳和2mol氧。
(4)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。
已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O
① 反应中,标准状况下,每生成2.24LNO气体,转移电子的物质的量为___________ mol,氧化剂与还原剂的物质的量之比为___________ ,在反应中HI除作还原剂还起到___________ 的作用。
② 用双线桥表示电子转移的方向和数目_______ 。
(5)amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为___________ 。
(1)肼(N2H4)常用作火箭推进剂。32g肼分子中含有的电子总数为
(2)在相同温度和压强下,体积相同的两个容器中分别盛有N2和O2。下列说法不正确的是___________(填序号)。
| A.N2和O2的密度之比为7∶8 | B.两容器内的气体具有相同的分子数 |
| C.两容器内的气体具有相同的原子数 | D.两容器内的气体具有相同的质子数 |
(3)下列叙述错误的是
① 摩尔是国际单位制中七个基本物理量之一;
② 1mol任何物质都含有约6.02×1023个原子;
③ 1L2mol/L的氯化镁溶液中含氯离子为2NA
④ HCl的摩尔质量等于1molHCl分子的质量;
⑤ 1molCO2中含有1mol碳和2mol氧。
(4)NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。
已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O
① 反应中,标准状况下,每生成2.24LNO气体,转移电子的物质的量为
② 用双线桥表示电子转移的方向和数目
(5)amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为
您最近一年使用:0次
名校
解题方法
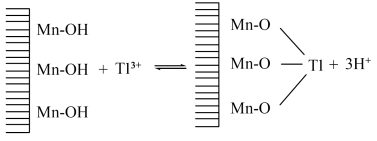
6 . 铊是一种有毒有害的重金属元素,对人体有较大的危害。湿法炼锌工业废水中的主要阳离子有 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水: 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液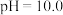 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示:
②萃取的反应原理为H++CH3CONR2+TlCl
 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4
请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为___________ 。
(2)“滤渣”的主要成分是___________ (填化学式),通常在“分步沉淀”时加入絮凝剂,其目的是___________ 。
(3)请从化学平衡的角度解释“反萃取”过程中加入 的原理和目的
的原理和目的___________ 。
(4)“分步沉淀”时,沉淀第二种离子时调节溶液 的范围为
的范围为___________ ,当其恰好完全沉淀,则溶液中先沉淀的离子浓度为___________ 。
(5)废水中 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为___________ (填“阳离子”或“阴离子”)交换树脂,若使吸附剂再生,且回收 ,可将离子交换树脂浸入
,可将离子交换树脂浸入___________ 溶液。
a. b.
b. c.
c.
 ,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水:
,需要处理回收金属元素达标后排放,可以采用以下不同方法处理废水: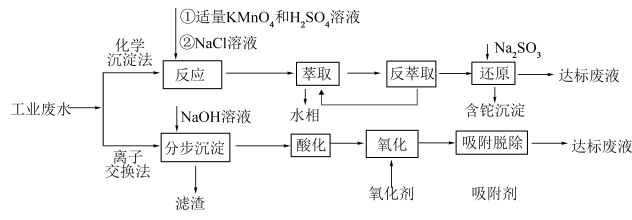
 氧化性强于
氧化性强于 ,
, 为两性氧化物,溶液
为两性氧化物,溶液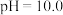 时开始溶解,常温下相关离子开始沉淀和沉淀完全时的
时开始溶解,常温下相关离子开始沉淀和沉淀完全时的 如表所示:
如表所示: | 离子 |  |  |  |
开始沉淀的 | 2.7 | 6.4 | 1.4 |
沉淀完全的 | 3.7 | 8.0 | 2.8 |

 [CH3CONR2H]TlCl4
[CH3CONR2H]TlCl4请回答下列问题:
(1)“反应”步骤中总反应的离子方程式为
(2)“滤渣”的主要成分是
(3)请从化学平衡的角度解释“反萃取”过程中加入
 的原理和目的
的原理和目的(4)“分步沉淀”时,沉淀第二种离子时调节溶液
 的范围为
的范围为(5)废水中
 吸附过程如图所示,该树脂为
吸附过程如图所示,该树脂为 ,可将离子交换树脂浸入
,可将离子交换树脂浸入a.
 b.
b. c.
c.
您最近一年使用:0次
2024-01-13更新
|
864次组卷
|
4卷引用:T27-工业流程题
(已下线)T27-工业流程题山东省济宁市2023-2024学年高三上学期1月期末化学试题(已下线)题型16 无机化工流程综合分析-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)2024届陕西省西安中学高三下学期三模理综试题-高中化学
名校
解题方法
7 . 锂辉石的主要成分有Li2O、Al2O3、SiO2,还含有少量Fe3O4、MgO等杂质,利用锂辉石制取Li2CO3的工艺流程如下:
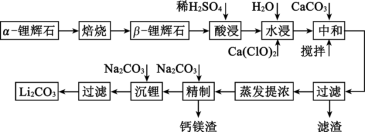
已知:ⅰ.α- 锂辉石是致密坚硬的固体,β- 锂辉石具有疏松多孔结构;
ⅱ.CaCO3的溶度积常数为1×10−9,MgCO3的溶度积常数为1×10−6。
回答下列问题:
(1)焙烧的目的是_______ 。
(2)为提高酸浸速率,可采取的措施是_______ (填一种即可)。
(3)水浸时加入少量Ca(ClO)2溶液,其目的是_______ ,发生反应的离子方程式为_______ ,该方案中不选择H2O2做氧化剂的原因是_______ 。
(4)中和过程中加入CaCO3,一方面是为了除去多余硫酸,另一方面是为了_______ 。
(5)精制过程是为了除去钙镁离子,钙镁渣中含CaCO3、Mg2(OH)2CO3和MgCO3,写出生成Mg2(OH)2CO3的离子方程式:_______ 。
(6)精制过程中,当钙离子刚好沉淀完全时[c(Ca2+)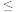 1×10−5 mol·L−1],溶液的pH为9,则CO
1×10−5 mol·L−1],溶液的pH为9,则CO 的一级水解常数约为
的一级水解常数约为_______ (忽略CO 的二级水解及其他离子的水解)。
的二级水解及其他离子的水解)。

已知:ⅰ.α- 锂辉石是致密坚硬的固体,β- 锂辉石具有疏松多孔结构;
ⅱ.CaCO3的溶度积常数为1×10−9,MgCO3的溶度积常数为1×10−6。
回答下列问题:
(1)焙烧的目的是
(2)为提高酸浸速率,可采取的措施是
(3)水浸时加入少量Ca(ClO)2溶液,其目的是
(4)中和过程中加入CaCO3,一方面是为了除去多余硫酸,另一方面是为了
(5)精制过程是为了除去钙镁离子,钙镁渣中含CaCO3、Mg2(OH)2CO3和MgCO3,写出生成Mg2(OH)2CO3的离子方程式:
(6)精制过程中,当钙离子刚好沉淀完全时[c(Ca2+)
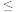 1×10−5 mol·L−1],溶液的pH为9,则CO
1×10−5 mol·L−1],溶液的pH为9,则CO 的一级水解常数约为
的一级水解常数约为 的二级水解及其他离子的水解)。
的二级水解及其他离子的水解)。
您最近一年使用:0次
2024-01-12更新
|
271次组卷
|
2卷引用:2024届四川省双流棠湖中学高三上学期第一次联考理科综合能力测试试题
名校
解题方法
8 . 工业上生产漂白剂亚氯酸钠 的同时可获得高氯酸
的同时可获得高氯酸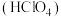 ,其流程如下:
,其流程如下:

已知: 浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。
浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。
(1)反应器I中发生的反应为: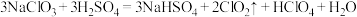 。用“双线桥”标出电子转移的方向和数目
。用“双线桥”标出电子转移的方向和数目___________ ;若生成标况下3.36L的 气体,则转移电子的物质的量为
气体,则转移电子的物质的量为___________ 。
(2)反应器I中反应后溶液冷却的目的是___________ ,可用蒸馏法分离出高氯酸的理由为___________ 。
(3)生产过程中需向反应器I中鼓入一定量空气,鼓入空气的作用是___________ 。
(4)利用反应器Ⅱ吸收 ,发生反应的化学方程式为
,发生反应的化学方程式为___________ ;该反应为放热反应,温度较低时吸收效果好。在不改变吸收液浓度和体积的条件下,欲使反应在0~5℃下进行,实验中可采取的措施有___________ (答出两点)。
 的同时可获得高氯酸
的同时可获得高氯酸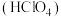 ,其流程如下:
,其流程如下:
已知:
 浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。
浓度过高时易发生分解爆炸,一般用稀有气体或空气稀释至含量10%以下。(1)反应器I中发生的反应为:
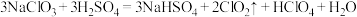 。用“双线桥”标出电子转移的方向和数目
。用“双线桥”标出电子转移的方向和数目 气体,则转移电子的物质的量为
气体,则转移电子的物质的量为(2)反应器I中反应后溶液冷却的目的是
(3)生产过程中需向反应器I中鼓入一定量空气,鼓入空气的作用是
(4)利用反应器Ⅱ吸收
 ,发生反应的化学方程式为
,发生反应的化学方程式为
您最近一年使用:0次
2024-01-10更新
|
109次组卷
|
2卷引用:四川省泸州市泸县第五中学2023-2024学年高一上学期1月期末化学试题
解题方法
9 . 下列对化学实验及现象的解释合理的是
| 选项 | 化学实验及现象 | 解释 |
| A | 久置的 遇盐酸有气泡产生 遇盐酸有气泡产生 |  已完全转化为 已完全转化为 |
| B |  与 与 光照下反应产生的气体使湿润的蓝色石蕊试纸变红 光照下反应产生的气体使湿润的蓝色石蕊试纸变红 | 气态氯代甲烷溶于水显酸性 |
| C | 向 溶液中加入少量氯水和 溶液中加入少量氯水和 ,振荡、静置,下层溶液为紫红色 ,振荡、静置,下层溶液为紫红色 | 还原性: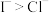 |
| D | 向  溶液中,加入少量 溶液中,加入少量 固体,溶液颜色加深 固体,溶液颜色加深 |  水解程度增大 水解程度增大 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
10 . 金属钛在航天、医疗等领域有着广泛的应用。工业上用钛铁矿(主要成分为钛酸亚铁FeTiO3,含有 、CaO、
、CaO、 等杂质)为原料制备金属钛的工艺流程如下:
等杂质)为原料制备金属钛的工艺流程如下:
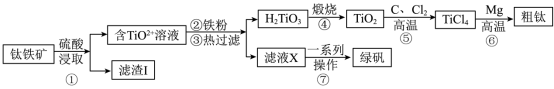
(1)钛的性质与铝相似,比铁活泼,但金属钛具有较强的抗腐蚀性,原因可能是_______ 。
(2)写出步骤①中FeTiO3与硫酸发生反应的化学方程式________ 。
(3)“滤渣I”的主要成分为______ 。
(4)步骤②中加入铁粉的目的_______ 。
(5)转化⑤反应中每消耗1molC,反应共转移2mol电子。该反应的化学方程式为______ 。
(6)转化⑥有副产品 生成,为节约原料,实现物质的循环利用,对副产物
生成,为节约原料,实现物质的循环利用,对副产物 的最佳利用方式是
的最佳利用方式是________ 。
(7)煅烧所得 可以采用如下实验测定其纯度:称取
可以采用如下实验测定其纯度:称取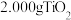 样品,加酸溶解,向所得溶液中加入足量铝粉,充分反应后过滤,将滤液稀释定容至250mL,取25.00mL于锥形瓶中,加入指示剂,用
样品,加酸溶解,向所得溶液中加入足量铝粉,充分反应后过滤,将滤液稀释定容至250mL,取25.00mL于锥形瓶中,加入指示剂,用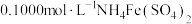 标准溶液滴定,恰好完全反应时,消耗
标准溶液滴定,恰好完全反应时,消耗 标准溶液的体积为23.00mL。实验过程中发生的反应如下:
标准溶液的体积为23.00mL。实验过程中发生的反应如下: ,
,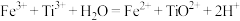 ,计算煅烧所得
,计算煅烧所得 的纯度为
的纯度为_______ 。
 、CaO、
、CaO、 等杂质)为原料制备金属钛的工艺流程如下:
等杂质)为原料制备金属钛的工艺流程如下:
(1)钛的性质与铝相似,比铁活泼,但金属钛具有较强的抗腐蚀性,原因可能是
(2)写出步骤①中FeTiO3与硫酸发生反应的化学方程式
(3)“滤渣I”的主要成分为
(4)步骤②中加入铁粉的目的
(5)转化⑤反应中每消耗1molC,反应共转移2mol电子。该反应的化学方程式为
(6)转化⑥有副产品
 生成,为节约原料,实现物质的循环利用,对副产物
生成,为节约原料,实现物质的循环利用,对副产物 的最佳利用方式是
的最佳利用方式是(7)煅烧所得
 可以采用如下实验测定其纯度:称取
可以采用如下实验测定其纯度:称取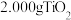 样品,加酸溶解,向所得溶液中加入足量铝粉,充分反应后过滤,将滤液稀释定容至250mL,取25.00mL于锥形瓶中,加入指示剂,用
样品,加酸溶解,向所得溶液中加入足量铝粉,充分反应后过滤,将滤液稀释定容至250mL,取25.00mL于锥形瓶中,加入指示剂,用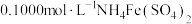 标准溶液滴定,恰好完全反应时,消耗
标准溶液滴定,恰好完全反应时,消耗 标准溶液的体积为23.00mL。实验过程中发生的反应如下:
标准溶液的体积为23.00mL。实验过程中发生的反应如下: ,
,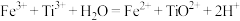 ,计算煅烧所得
,计算煅烧所得 的纯度为
的纯度为
您最近一年使用:0次



