解题方法
1 . 硝酸镉晶体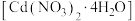 常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含
常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含 (难溶于水),含少量
(难溶于水),含少量 、
、 、
、 、
、 ]为原料制备硝酸镉晶体,制作流程如图所示。
]为原料制备硝酸镉晶体,制作流程如图所示。
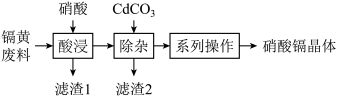
已知:①温度较高时,硝酸镉易分解;
②25℃,部分氢氧化物的 如下表所示:
如下表所示:
回答下列问题:
(1)“酸浸”时, 、
、 与一定浓度稀硝酸反应,均生成单质硫和
与一定浓度稀硝酸反应,均生成单质硫和 ,
, 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为___________ ,该反应中参加反应的硝酸中,被还原的硝酸与未被还原的硝酸的物质的量之比为___________ 。“酸浸”所得溶液中,含有的阳离子有 、
、 、
、___________ 。
(2)当溶液中离子浓度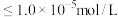 时,认为该离子已完全除去。若“除杂”所得滤液中
时,认为该离子已完全除去。若“除杂”所得滤液中 ,则
,则___________ (填“能”或“不能”)调节溶液 ,以达到除去硝酸镉溶液中的
,以达到除去硝酸镉溶液中的 的目的,原因是
的目的,原因是___________ 。
(3)硝酸镉与硝酸锌的溶解度随温度的变化关系如图。

“系列操作”依次为:
步骤i:将除杂所得滤液加热浓缩至溶液表面生成薄膜为止;
步骤ii:……
步骤iii:……
步骤iv:在低温烘干,制得硝酸镉晶体成品。
①“步骤i”加热浓缩滤液,用到的仪器有蒸发皿、铁架台(带铁圈)、玻璃棒、石棉网,还需要用到的仪器有___________ (填标号)。
a. b.
b.  c.
c. d.
d.
②“步骤ii”、“步骤iii”分别为___________ ,___________ 。
③“步骤iv”中,采用低温烘干的原因是___________ 。
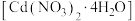 常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含
常用于瓷器上色。某学习小组在实验室以镉黄废料[主要含 (难溶于水),含少量
(难溶于水),含少量 、
、 、
、 、
、 ]为原料制备硝酸镉晶体,制作流程如图所示。
]为原料制备硝酸镉晶体,制作流程如图所示。
已知:①温度较高时,硝酸镉易分解;
②25℃,部分氢氧化物的
 如下表所示:
如下表所示: |  |  |  | |
 |  | 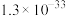 | 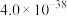 | 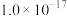 |
(1)“酸浸”时,
 、
、 与一定浓度稀硝酸反应,均生成单质硫和
与一定浓度稀硝酸反应,均生成单质硫和 ,
, 与稀硝酸反应的离子方程式为
与稀硝酸反应的离子方程式为 、
、 、
、(2)当溶液中离子浓度
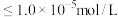 时,认为该离子已完全除去。若“除杂”所得滤液中
时,认为该离子已完全除去。若“除杂”所得滤液中 ,则
,则 ,以达到除去硝酸镉溶液中的
,以达到除去硝酸镉溶液中的 的目的,原因是
的目的,原因是(3)硝酸镉与硝酸锌的溶解度随温度的变化关系如图。

“系列操作”依次为:
步骤i:将除杂所得滤液加热浓缩至溶液表面生成薄膜为止;
步骤ii:……
步骤iii:……
步骤iv:在低温烘干,制得硝酸镉晶体成品。
①“步骤i”加热浓缩滤液,用到的仪器有蒸发皿、铁架台(带铁圈)、玻璃棒、石棉网,还需要用到的仪器有
a.
 b.
b.  c.
c. d.
d.
②“步骤ii”、“步骤iii”分别为
③“步骤iv”中,采用低温烘干的原因是
您最近一年使用:0次
2 . 已知离子反应: (已配平),下列说法错误的是
(已配平),下列说法错误的是
A. 是 是 | B. 是还原产物 是还原产物 |
C.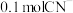 反应,转移的电子数目为 反应,转移的电子数目为 | D.该反应中 体现氧化性 体现氧化性 |
您最近一年使用:0次
名校
解题方法
3 . 葡萄糖酸钙是一种可促进骨骼生长的营养物质。葡萄糖酸钙可通过如下实验流程制得:
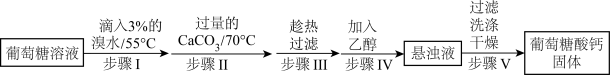
已知:a.反应原理: 。
。
b.相关物质的溶解性如下表:
c.相关物质的酸性:氢溴酸>葡萄糖酸>碳酸。
回答下列问题:
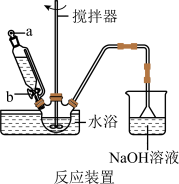
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是___________ ,恒压滴液漏斗使用时需要打开的活塞或玻璃塞是___________ (填“a”“b”或“a和b”)。烧杯中 溶液水浴的作用是
溶液水浴的作用是___________ 。
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
(3)步骤Ⅱ中加入过量的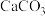 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为___________ 。加入过量的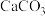 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是___________ 。
(4)洗涤操作中最合适的洗涤剂是___________ (填序号),理由是___________ 。
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:___________ (填序号,操作步骤不可重复使用)。
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出
④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液

已知:a.反应原理:
 。
。b.相关物质的溶解性如下表:
| 物质的名称 | 葡萄糖酸钙 | 葡萄糖酸 | 溴化钙 |
| 在水中的溶解性 | 可溶于冷水,易溶于热水 | 可溶 | 极易溶 |
| 在乙醇中的溶解性 | 微溶 | 微溶 | 可溶 |
回答下列问题:
(1)步骤I中溴水氧化葡萄糖时采用了如图所示反应装置,你认为缺少的仪器是
 溶液水浴的作用是
溶液水浴的作用是
(2)制备葡萄糖酸钙的过程中,葡萄糖的氧化也可用其他试剂,下列物质中最适合的是___________(填序号)。
A.新制 悬浊液 悬浊液 | B.酸性 溶液 溶液 |
C. /葡萄糖氧化酶 /葡萄糖氧化酶 | D. 溶液 溶液 |
(3)步骤Ⅱ中加入过量的
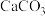 ,生成葡萄糖酸钙的化学方程式为
,生成葡萄糖酸钙的化学方程式为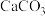 除了能提高葡萄糖酸的转化率,还有的作用是
除了能提高葡萄糖酸的转化率,还有的作用是(4)洗涤操作中最合适的洗涤剂是
A.冷水 B.热水 C.乙醇
(5)利用重结晶法可除去葡萄糖酸钙粗品中的杂质,提高产品的质量,选出葡萄糖酸钙重结晶过程中合理的操作并排序:
①蒸发浓缩至溶液表面出现晶膜
②待晶体充分析出后,减压过滤
③将滤液冷却至室温,加入
 95%的乙醇溶液并搅拌,促进晶体析出
95%的乙醇溶液并搅拌,促进晶体析出④趁热减压过滤,除去不溶物
⑤在50℃下用恒温干燥箱烘干,称重
⑥取烧杯加入
 蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
蒸馏水,加热至微沸,加入葡萄糖酸钙粗品,得到葡萄糖酸钙饱和溶液
您最近一年使用:0次
解题方法
4 . 氮及其化合物在生产、生活中广泛应用。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是__________ (写化学式)。写出一个能够生成B的化学方程式__________ 。
(2)实验室中,检验溶液中是否含有 的操作方法是
的操作方法是__________ 。
(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式__________ 。
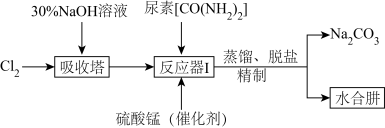
Ⅱ.下图为实验室模拟尿素法制备水合肼( )的流程图:
)的流程图:
已知:① 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。
②一定条件下,碱性NaClO溶液与尿素溶液反应生成 。
。
回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为__________ 。
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为__________ 。
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是__________ 。
Ⅰ.氮元素化合价-物质类别关系图如图所示。

(1)图中A可以是
(2)实验室中,检验溶液中是否含有
 的操作方法是
的操作方法是(3)水体中硝酸盐含量过高对环境不利,通过电催化法可以将水体中的硝酸盐进行合理转化。写出在中性介质中硝酸盐转化为氮气的阴极电极反应式
Ⅱ.下图为实验室模拟尿素法制备水合肼(
 )的流程图:
)的流程图:
已知:①
 易溶于水,具有强还原性,易被氧化成
易溶于水,具有强还原性,易被氧化成 。
。②一定条件下,碱性NaClO溶液与尿素溶液反应生成
 。
。回答下列问题:
(4)“吸收塔”内发生反应的离子方程式为
(5)写出“反应器Ⅰ”中生成水合肼反应的化学方程式为
(6)“反应器Ⅰ”要控制NaClO溶液的用量,其主要目的是
您最近一年使用:0次
解题方法
5 . 硫酸盐还原菌( )会腐蚀许多金属及合金。模拟
)会腐蚀许多金属及合金。模拟 诱导腐蚀碳素钢发生厌氧电化学腐蚀实验,实验后发现碳素钢表面覆盖物成分是硫化物(主要含
诱导腐蚀碳素钢发生厌氧电化学腐蚀实验,实验后发现碳素钢表面覆盖物成分是硫化物(主要含 ),腐蚀机理如图所示。下列说法正确的是
),腐蚀机理如图所示。下列说法正确的是
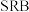 )会腐蚀许多金属及合金。模拟
)会腐蚀许多金属及合金。模拟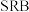 诱导腐蚀碳素钢发生厌氧电化学腐蚀实验,实验后发现碳素钢表面覆盖物成分是硫化物(主要含
诱导腐蚀碳素钢发生厌氧电化学腐蚀实验,实验后发现碳素钢表面覆盖物成分是硫化物(主要含 ),腐蚀机理如图所示。下列说法正确的是
),腐蚀机理如图所示。下列说法正确的是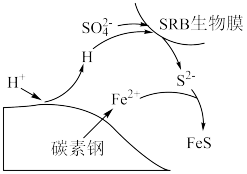
A.碳素钢厌氧腐蚀过程中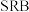 做还原剂 做还原剂 |
B.温度越高,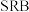 诱导碳素钢厌氧腐蚀速率越快 诱导碳素钢厌氧腐蚀速率越快 |
C.碳作负极,电极反应为: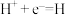 |
D.该实验生成 的总反应: 的总反应: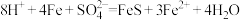 |
您最近一年使用:0次
2024-03-26更新
|
484次组卷
|
4卷引用:2024届四川省大数据学考联盟高三第一次质量检测理科综合试题-高中化学
2024届四川省大数据学考联盟高三第一次质量检测理科综合试题-高中化学(已下线)通关练09 重温“两池”原理及应用-【查漏补缺】2024年高考化学复习冲刺过关(新高考专用)(已下线)压轴题04?化学反应机理、历程、能垒图分析(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)(已下线)第05讲 氧化还原反应方程式的配平、书写及计算(练习)-【上好课】2025年高考化学一轮复习讲练测(新教材新高考)
解题方法
6 . 银是一种用途广泛的金属,由硫化银锰精矿(含 、
、 、
、 等)制备粗银粉的流程如下图。
等)制备粗银粉的流程如下图。
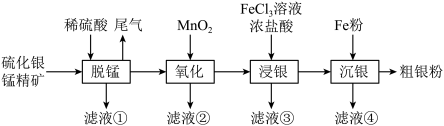
已知:i. 不与稀硫酸、
不与稀硫酸、 反应;
反应;
ii. 不与稀硫酸反应;
不与稀硫酸反应;
iii.常温下, 。
。
回答下列问题:
(1)“滤液①”中含有的金属阳离子是______ (填离子符号),“尾气”的主要成分是_____ (填化学式)。
(2)“氧化”时, 被氧化成
被氧化成 和
和 ,该反应的离子方程式是
,该反应的离子方程式是_______________ 。
(3)“浸银”时, 先与
先与 溶液反应生成
溶液反应生成 、
、 ,
, 再与
再与 生成多种配合物而溶解。
生成多种配合物而溶解。
①生成 的化学方程式是
的化学方程式是______________ 。
②当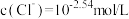 时,溶液中
时,溶液中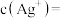
_________  。
。
③加入浓盐酸( 、
、 )的作用是
)的作用是______________ 。
(4)向“滤液④”中通入 反应后,将滤液返回
反应后,将滤液返回__________ (填写流程图中方框内的步骤名称)循环利用。
(5)制得的粗银粉中,银的纯度较低,可能的原因是____________________ 。
 、
、 、
、 等)制备粗银粉的流程如下图。
等)制备粗银粉的流程如下图。
已知:i.
 不与稀硫酸、
不与稀硫酸、 反应;
反应;ii.
 不与稀硫酸反应;
不与稀硫酸反应;iii.常温下,
 。
。回答下列问题:
(1)“滤液①”中含有的金属阳离子是
(2)“氧化”时,
 被氧化成
被氧化成 和
和 ,该反应的离子方程式是
,该反应的离子方程式是(3)“浸银”时,
 先与
先与 溶液反应生成
溶液反应生成 、
、 ,
, 再与
再与 生成多种配合物而溶解。
生成多种配合物而溶解。①生成
 的化学方程式是
的化学方程式是②当
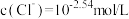 时,溶液中
时,溶液中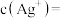
 。
。③加入浓盐酸(
 、
、 )的作用是
)的作用是(4)向“滤液④”中通入
 反应后,将滤液返回
反应后,将滤液返回(5)制得的粗银粉中,银的纯度较低,可能的原因是
您最近一年使用:0次
名校
解题方法
7 . 废旧电池镍钴锰酸锂三元正极材料的主要成分为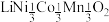 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为_______ ;实际生产中还有少量的Li2CO3生成,原因是_______ 。
(2)“酸洗”的目的是_______ ;若“洗液”中c(Li+)=2.0mol•L-1,加入Na2CO3固体后,为使沉淀Li2CO3中Li元素含量不小于Li元素总量的95%,则1.0L“洗液”中至少需要加入Na2CO3的物质的量为______ mol[忽略溶液体积变化,Ksp(Li2CO3)=2.2×10-3]。
(3)“沉锰”过程中pH对金属沉淀率的影响如图所示。_______ 。
②pH=0.5时,有少量钴、镍析出,可能的原因是_______ ;应选择的最佳pH为_______ 。
(4)“反萃取”的目的是将有机层中Co2+、Ni2+转移到水层。
①试剂X为_______ (填试剂名称)。
②为使Co2+、Ni2+尽可能多地转移到水层,应采取的实验操作有_______ 。
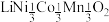 ,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。
,通过高温氢化和湿法冶金的方法回收其中的镍、钴、锰、锂,其工艺流程如图所示。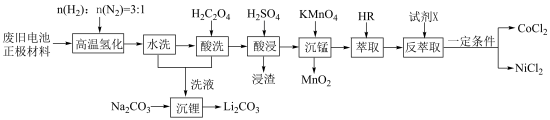
②M2+(Co2+或Ni2+)的萃取原理:2HR(有机相)+M2+(水相)⇌MR2(有机相)+2H+(水相)。
回答下列问题:
(1)“高温氢化”时固体产物为Co、Ni、MnO和LiOH,该反应的化学方程式为
(2)“酸洗”的目的是
(3)“沉锰”过程中pH对金属沉淀率的影响如图所示。
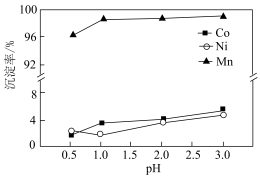
②pH=0.5时,有少量钴、镍析出,可能的原因是
(4)“反萃取”的目的是将有机层中Co2+、Ni2+转移到水层。
①试剂X为
②为使Co2+、Ni2+尽可能多地转移到水层,应采取的实验操作有
您最近一年使用:0次
2024-03-22更新
|
853次组卷
|
3卷引用:2024届四川省成都市第七中学高三下学期5月模拟考试理科综合试题-高中化学
名校
解题方法
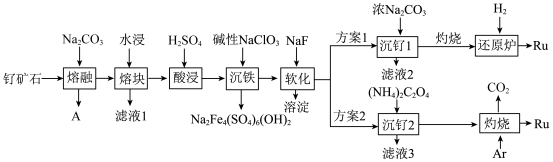
8 . 一种以钌矿石[主要含Ru(CO3)2还含少量的Al2O3、FeO、MgO、SiO2和CaO等]为原料制备钌(Ru)的流程如图,回答下列问题: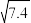 ≈2.7,
≈2.7, ≈3.9
≈3.9
②离子浓度等于或低于1×10-5mol•L-1时,则认为该离子已被完全除去。
(1)气体A的成分为______ ,滤液1中溶质为______ 。
(2)“沉铁”的离子方程式为______ 。
(3)“软化”时,溶液中钙离子和镁离子的浓度分别为0.01mol•L-1和0.02mol•L-1,常温下取2.0L该滤液,使其中Ca2+、Mg2+沉淀完全,则至少需要加入NaF的物质的量为______ 。
(4)“灼烧”时Ar的作用是______ 。
(5)产生相同量的钌,方案1中消耗H2与方案2中产生CO2的物质的量比值为______ ;从安全角度分析,方案2优于方案1,其理由是______ 。
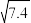 ≈2.7,
≈2.7, ≈3.9
≈3.9②离子浓度等于或低于1×10-5mol•L-1时,则认为该离子已被完全除去。
(1)气体A的成分为
(2)“沉铁”的离子方程式为
(3)“软化”时,溶液中钙离子和镁离子的浓度分别为0.01mol•L-1和0.02mol•L-1,常温下取2.0L该滤液,使其中Ca2+、Mg2+沉淀完全,则至少需要加入NaF的物质的量为
(4)“灼烧”时Ar的作用是
(5)产生相同量的钌,方案1中消耗H2与方案2中产生CO2的物质的量比值为
您最近一年使用:0次
2024-03-21更新
|
443次组卷
|
3卷引用:2024届四川省绵阳市涪城区南山中学高三下学期模拟预测理综试题-高中化学
名校
解题方法
9 . 一种用3-氯丙烯(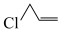 )电解合成环氧氯丙烷(
)电解合成环氧氯丙烷( )的装置如图所示。该装置无需使用隔膜,且绿色高效,图中X为Cl或Br,工作时X-和OH-同时且等量放电。下列说法正确的是
)的装置如图所示。该装置无需使用隔膜,且绿色高效,图中X为Cl或Br,工作时X-和OH-同时且等量放电。下列说法正确的是

| A.每转移1mole-,生成1mol环氧氯丙烷 | B.电解一段时间后,装置中OH-的物质的量不变 |
| C.若X为Br,则可电解制备环氧溴丙烷 | D.该装置工作时需不断补充X- |
您最近一年使用:0次
2024-03-16更新
|
675次组卷
|
3卷引用:2024届四川省成都石室中学高三下学期5月高考适应性考试(一)理科综合试卷-高中化学
名校
10 .  是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用
是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用 和
和 制备
制备 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 易水解,熔点为-78℃,沸点为60℃。
易水解,熔点为-78℃,沸点为60℃。
Ⅰ.制备
(1)操作步骤的先后顺序为___________ 。
①组装仪器并检验装置气密性,加入药品
②加热装置C使其中的硫磺熔化
③通入 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
④打开 、
、 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸
⑥向装置A中滴加浓盐酸,加热装置C至135℃左右
(2)仪器b的名称为___________ ,装置B中盛放的试剂为___________ (填试剂名称)。
(3)为使装置C受热均匀,可采取的加热方式为___________ ,装置D的作用为___________ 。
Ⅱ.制备
打开止水夹 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
(4)生成 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为___________ 。
Ⅲ.测定的纯度
称取5.00g 样品,加入NaOH溶液加热,使氮元素完全转化为 ,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00
,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00 盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为
盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为 。
。
(5)制得 的纯度为
的纯度为___________ 。下列实验操作导致 测定结果偏低的是
测定结果偏低的是___________ 。
A.盛放待测液的锥形瓶洗涤后未干燥直接使用
B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定前仰视滴定管读数,滴定后俯视读数
 是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用
是重要的硫-氮二元化合物室温下为橙黄色固体,178~187℃熔化并分解。实验室利用 和
和 制备
制备 的装置如图所示(加热及夹持装置略)。已知
的装置如图所示(加热及夹持装置略)。已知 易水解,熔点为-78℃,沸点为60℃。
易水解,熔点为-78℃,沸点为60℃。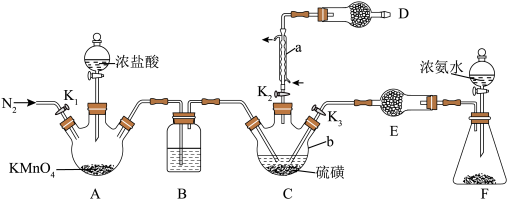
Ⅰ.制备

(1)操作步骤的先后顺序为
①组装仪器并检验装置气密性,加入药品
②加热装置C使其中的硫磺熔化
③通入
 ,通冷凝水,一段时间后,关闭
,通冷凝水,一段时间后,关闭
④打开
 、
、 ,关闭
,关闭
⑤充分反应后停止滴加浓盐酸
⑥向装置A中滴加浓盐酸,加热装置C至135℃左右
(2)仪器b的名称为
(3)为使装置C受热均匀,可采取的加热方式为
Ⅱ.制备

打开止水夹
 ,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。
,向装置F中滴入浓氨水,待装置C中充分反应后停止滴加浓氨水,冷却后停止通冷凝水。(4)生成
 的同时还生成一种常见固体单质和一种盐,反应的化学方程式为
的同时还生成一种常见固体单质和一种盐,反应的化学方程式为Ⅲ.测定的纯度
称取5.00g 样品,加入NaOH溶液加热,使氮元素完全转化为
 ,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00
,用足量硼酸溶液吸收。将吸收液配成100mL溶液,用移液管移取20.00mL,以甲基红-亚甲蓝为指示剂用1.00 盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为
盐酸进行滴定,重复3次实验,平均消耗20.00mL盐酸。已知滴定反应为 。
。(5)制得
 的纯度为
的纯度为 测定结果偏低的是
测定结果偏低的是A.盛放待测液的锥形瓶洗涤后未干燥直接使用
B.移液管用蒸馏水洗涤后未用吸收液润洗
C.滴定前滴定管尖嘴处有气泡,滴定后无气泡
D.滴定前仰视滴定管读数,滴定后俯视读数
您最近一年使用:0次
2024-03-14更新
|
941次组卷
|
5卷引用:T26-实验综合题



