解题方法
1 .  可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯
可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯 的工艺流程如图所示。
的工艺流程如图所示。 存在;
存在;
②常温下,部分物质溶度积如下:
回答下列问题:
(1)常温下,为提高酸浸效率,通常采用的措施是___________ (举2例)。
(2)加入碳酸钙调pH=4的目的是___________ ,此时 (0.10mol/L)是否会沉淀
(0.10mol/L)是否会沉淀___________ (通过计算说明)。
(3)“沉渣3”的主要成分是___________ (填化学式)。“滤液4”中除含 、
、 、
、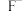 、
、 外,还含有较多的
外,还含有较多的___________ (填离子符号)。
(4)向“酸溶”后的溶液中加入NaOH和NaClO,发生反应的化学方程式是___________ 。
(5)工艺流程中使用 去除
去除 。研究表明,也可在加热条件下使用
。研究表明,也可在加热条件下使用 去除
去除 ,生成等物质的量的
,生成等物质的量的 、S混合沉淀以及
、S混合沉淀以及 ,该反应的离子方程式是
,该反应的离子方程式是___________ 。
 可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯
可用于制备镉镍碱性电池。镍废料中含有Ni、Cu、Fe、Ca、Mg等的化合物及难溶性杂质,以镍废料为原料制备高纯 的工艺流程如图所示。
的工艺流程如图所示。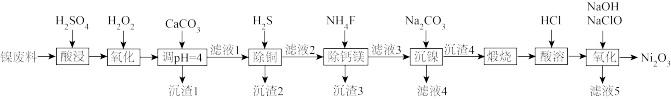
 存在;
存在;②常温下,部分物质溶度积如下:
 |  |  |  | |
 |  |  | 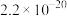 | 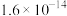 |
(1)常温下,为提高酸浸效率,通常采用的措施是
(2)加入碳酸钙调pH=4的目的是
 (0.10mol/L)是否会沉淀
(0.10mol/L)是否会沉淀(3)“沉渣3”的主要成分是
 、
、 、
、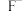 、
、 外,还含有较多的
外,还含有较多的(4)向“酸溶”后的溶液中加入NaOH和NaClO,发生反应的化学方程式是
(5)工艺流程中使用
 去除
去除 。研究表明,也可在加热条件下使用
。研究表明,也可在加热条件下使用 去除
去除 ,生成等物质的量的
,生成等物质的量的 、S混合沉淀以及
、S混合沉淀以及 ,该反应的离子方程式是
,该反应的离子方程式是
您最近一年使用:0次
2 . 乙二胺四乙酸铁钠(化学式可用 表示,摩尔质量为
表示,摩尔质量为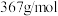 )可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
)可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
Ⅰ. 晶体制备
晶体制备
②快速搅拌条件下,向其中滴加氨水至过量,过滤并洗涤沉淀3次;
③将上述滤渣转移到三颈瓶中,保持80℃加热,边搅拌边逐滴滴加乙二胺四乙酸( )和碳酸钠溶液,调节
)和碳酸钠溶液,调节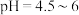 ,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积
,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积 ,冷却结晶得到土黄色高纯的
,冷却结晶得到土黄色高纯的 晶体。
晶体。
(1)步骤①盐酸过量的目的:一是作反应物,二是_______ 。
(2)写出上述颜色变为深棕色所发生离子反应方程式_______ 。
(3)滴加氨水时,滴加速率不宜过快且快速搅拌,其原因是_______ 。
(4)冷却水应从_______ (填“a”或“b”)口通入,仪器m的名称为_______ ;步骤③中宜采取的加热方式为_______ ;分离产品采取“趁热减压过滤”,趁热的目的是_______ 。
Ⅱ.纯度分析
准确称取20.00g产物放入 烧杯,加入
烧杯,加入 无氧蒸馏水和
无氧蒸馏水和 硫酸(
硫酸( ),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用
),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用 容量瓶定容。快速移取
容量瓶定容。快速移取 溶液至
溶液至 锥形瓶中,加入
锥形瓶中,加入
 混酸以掩蔽生成的
混酸以掩蔽生成的 的黄色,用
的黄色,用
 (
( )标准溶液平行滴定3次,平均消耗标准液
)标准溶液平行滴定3次,平均消耗标准液 。
。
(5) 标液应盛装在
标液应盛装在_______ (填“无色透明”或“棕色透明”)滴定管,滴定终点的现象为_______ 。
(6)上述 的纯度为
的纯度为_______ (保留4位有效数字)。
 表示,摩尔质量为
表示,摩尔质量为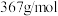 )可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
)可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:Ⅰ.
 晶体制备
晶体制备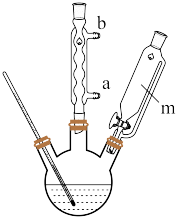
②快速搅拌条件下,向其中滴加氨水至过量,过滤并洗涤沉淀3次;
③将上述滤渣转移到三颈瓶中,保持80℃加热,边搅拌边逐滴滴加乙二胺四乙酸(
 )和碳酸钠溶液,调节
)和碳酸钠溶液,调节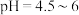 ,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积
,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积 ,冷却结晶得到土黄色高纯的
,冷却结晶得到土黄色高纯的 晶体。
晶体。(1)步骤①盐酸过量的目的:一是作反应物,二是
(2)写出上述颜色变为深棕色所发生离子反应方程式
(3)滴加氨水时,滴加速率不宜过快且快速搅拌,其原因是
(4)冷却水应从
Ⅱ.纯度分析
准确称取20.00g产物放入
 烧杯,加入
烧杯,加入 无氧蒸馏水和
无氧蒸馏水和 硫酸(
硫酸( ),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用
),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用 容量瓶定容。快速移取
容量瓶定容。快速移取 溶液至
溶液至 锥形瓶中,加入
锥形瓶中,加入
 混酸以掩蔽生成的
混酸以掩蔽生成的 的黄色,用
的黄色,用
 (
( )标准溶液平行滴定3次,平均消耗标准液
)标准溶液平行滴定3次,平均消耗标准液 。
。(5)
 标液应盛装在
标液应盛装在(6)上述
 的纯度为
的纯度为
您最近一年使用:0次
3 . 以铝土矿(主要成分为 、
、 和
和 )为原料制备冶金级氧化铝流程如图所示。
)为原料制备冶金级氧化铝流程如图所示。___________ ,铝土矿中部分铁元素以针铁矿(FeOOH)形式存在,写出针铁矿在焙烧过程发生的化学反应方程式___________ 。
(2)“滤渣”的主要成分是___________ 。
(3)实验发现,焙烧温度为325℃时,铝和铁的提取率最高。焙烧温度进一步升高,提取率下降,原因是___________ 。(提取率:某组分浸出后在溶液中的质量与样品中的质量百分比)
(4)将“滤液”进行蒸发浓缩,冷却结晶,析出水合硫酸铝[ ],实验测得,蒸发浓缩液密度与析出晶体中的含水量的关系如图所示。
],实验测得,蒸发浓缩液密度与析出晶体中的含水量的关系如图所示。___________ (选填“多”或“少”)的水合硫酸铝晶体。
②当蒸发浓缩液密度为 ,测得析出晶体中的含水量为34.26%,折合成水合硫酸铝的结晶水系数
,测得析出晶体中的含水量为34.26%,折合成水合硫酸铝的结晶水系数
___________ (结果取整数)。
(5)还原焙烧过程加入碳,除氧化铝外,还生成 、
、 两种气体,该化学反应方程式为
两种气体,该化学反应方程式为___________ 。
(6)还原焙烧得到的粗氧化铝采用低温碱浸,过滤,对滤液进行系列操作得到氢氧化铝固体,在1200℃下进行煅烧分解得冶金级氧化铝。低温碱浸目的是___________ 。
 、
、 和
和 )为原料制备冶金级氧化铝流程如图所示。
)为原料制备冶金级氧化铝流程如图所示。
(2)“滤渣”的主要成分是
(3)实验发现,焙烧温度为325℃时,铝和铁的提取率最高。焙烧温度进一步升高,提取率下降,原因是
(4)将“滤液”进行蒸发浓缩,冷却结晶,析出水合硫酸铝[
 ],实验测得,蒸发浓缩液密度与析出晶体中的含水量的关系如图所示。
],实验测得,蒸发浓缩液密度与析出晶体中的含水量的关系如图所示。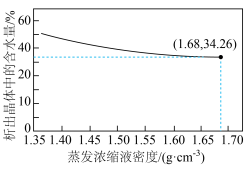
②当蒸发浓缩液密度为
 ,测得析出晶体中的含水量为34.26%,折合成水合硫酸铝的结晶水系数
,测得析出晶体中的含水量为34.26%,折合成水合硫酸铝的结晶水系数
(5)还原焙烧过程加入碳,除氧化铝外,还生成
 、
、 两种气体,该化学反应方程式为
两种气体,该化学反应方程式为(6)还原焙烧得到的粗氧化铝采用低温碱浸,过滤,对滤液进行系列操作得到氢氧化铝固体,在1200℃下进行煅烧分解得冶金级氧化铝。低温碱浸目的是
您最近一年使用:0次
名校
解题方法
4 . 综合题
 .铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
.铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
(1)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮(NO )且无污染,写出该反应的离子方程式:
)且无污染,写出该反应的离子方程式:___________ 。
(2)土壤中的铁元素含量的测定:
乙二胺四乙酸又叫 ,是化学中一种良好的配合剂,形成的配合物又叫螯合物。
,是化学中一种良好的配合剂,形成的配合物又叫螯合物。 在配位滴定中用到,一般是测定金属离子的含量。已知:
在配位滴定中用到,一般是测定金属离子的含量。已知: 配离子结构如图,M为Fe3+。
配离子结构如图,M为Fe3+。 中氮原子杂化方式
中氮原子杂化方式___________ ,该配合物中Fe3+配位数是___________ 。
②土壤中的铁元素含量测定步骤:
第一步:取ag土壤试样溶解,加入足量H2O2,将溶液充分加热。
第二步:将上述液体配成100mL溶液,取25.00mL,,滴入两滴二甲酚橙作指示剂,用bmol·L-1EDTA(简写成H2Y2-)标准溶液滴定,反应的离子方程式为Fe3++H2Y2-=FeY-+2H+。达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50mL。该土壤中的铁元素质量分数为___________ (用含a、b的代数式表示)。
③第一步加入足量H2O2的目的是:___________ 。
④若在滴定操作中一些不当操作可能会引起误差,下列操作会使土壤中的铁元素质量分数测定结果偏高的是:___________ 。
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点,读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛放EDTA(简写成H2Y2-)标准溶液的滴定管用蒸馏水洗净后未用标准液润洗
 .铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。___________ 。
(4)若该晶胞的边长为d nm,则该合金的密度为___________  。(列出计算式即可,设阿伏加德罗常数的值为NA)
。(列出计算式即可,设阿伏加德罗常数的值为NA)
(5)若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含镁 48g的该储氢合金可储存标准状况下H2的体积约为___________ L。
 .铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
.铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:(1)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮(NO
 )且无污染,写出该反应的离子方程式:
)且无污染,写出该反应的离子方程式:(2)土壤中的铁元素含量的测定:
乙二胺四乙酸又叫
 ,是化学中一种良好的配合剂,形成的配合物又叫螯合物。
,是化学中一种良好的配合剂,形成的配合物又叫螯合物。 在配位滴定中用到,一般是测定金属离子的含量。已知:
在配位滴定中用到,一般是测定金属离子的含量。已知: 配离子结构如图,M为Fe3+。
配离子结构如图,M为Fe3+。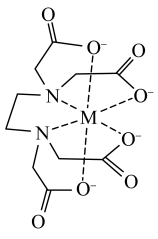
 中氮原子杂化方式
中氮原子杂化方式②土壤中的铁元素含量测定步骤:
第一步:取ag土壤试样溶解,加入足量H2O2,将溶液充分加热。
第二步:将上述液体配成100mL溶液,取25.00mL,,滴入两滴二甲酚橙作指示剂,用bmol·L-1EDTA(简写成H2Y2-)标准溶液滴定,反应的离子方程式为Fe3++H2Y2-=FeY-+2H+。达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50mL。该土壤中的铁元素质量分数为
③第一步加入足量H2O2的目的是:
④若在滴定操作中一些不当操作可能会引起误差,下列操作会使土壤中的铁元素质量分数测定结果偏高的是:
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点,读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛放EDTA(简写成H2Y2-)标准溶液的滴定管用蒸馏水洗净后未用标准液润洗
 .铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。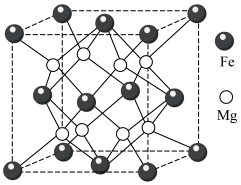
(4)若该晶胞的边长为d nm,则该合金的密度为
 。(列出计算式即可,设阿伏加德罗常数的值为NA)
。(列出计算式即可,设阿伏加德罗常数的值为NA)(5)若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含镁 48g的该储氢合金可储存标准状况下H2的体积约为
您最近一年使用:0次
解题方法
5 . 工业废弃物铬钒渣中含有价格相对较高且稀缺的钒(V)、铬(Cr)元素,铬钒渣中铬、钒均以低价含氧酸盐(不溶于水,也不溶于碱性溶液)形式存在,杂质的成分主要为 、
、 、
、 以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示:
以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示: 与
与 固体能发生反应。
固体能发生反应。
②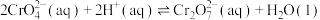 。
。
③25℃时, ,
,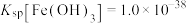 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,可以认为完全沉淀。
时,可以认为完全沉淀。
(1)“煅烧”时为加快反应速率,可采取的措施为___________ ;“煅烧”时铬元素被氧化为相应的最高价含氧酸盐,则该最高价含氧酸盐中铬元素的化合价为___________ 价。
(2)写出“煅烧”时 与
与 固体反应的化学方程式:
固体反应的化学方程式:___________ 。
(3)试分析,将“浸取”步骤与“沉淀”步骤合并对产品纯度的影响:___________ 。
(4)“还原”时,发生反应的n(氧化剂)∶n(还原剂)=___________ 。
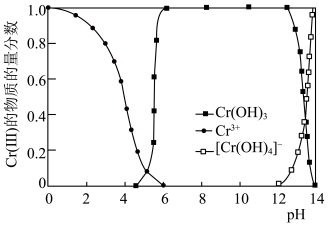
(5)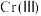 的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的
的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的 转化为
转化为 ,溶液中剩余
,溶液中剩余 的浓度小于
的浓度小于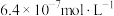 ,则调节pH的范围为
,则调节pH的范围为___________ {已知:25℃时,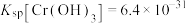 }。
}。 具有两性,溶解在NaOH溶液中得到
具有两性,溶解在NaOH溶液中得到 ,写出该反应的离子方程式:
,写出该反应的离子方程式:___________ ; 在
在 时,转化为
时,转化为 ,向含
,向含 的溶液中加入氨水可得到微溶于水的
的溶液中加入氨水可得到微溶于水的 ,
, 受热最终会分解生成钒的余化物,取234g
受热最终会分解生成钒的余化物,取234g 焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为
焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为___________ 。
 、
、 、
、 以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示:
以及磷的化合物。一种从铬钒渣中分离提取铬和钒的流程如图所示: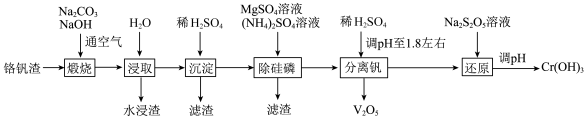
 与
与 固体能发生反应。
固体能发生反应。②
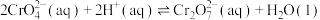 。
。③25℃时,
 ,
,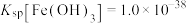 ;当溶液中离子浓度小于
;当溶液中离子浓度小于 时,可以认为完全沉淀。
时,可以认为完全沉淀。(1)“煅烧”时为加快反应速率,可采取的措施为
(2)写出“煅烧”时
 与
与 固体反应的化学方程式:
固体反应的化学方程式:(3)试分析,将“浸取”步骤与“沉淀”步骤合并对产品纯度的影响:
(4)“还原”时,发生反应的n(氧化剂)∶n(还原剂)=
(5)
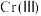 的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的
的存在形态的物质的量分数随溶液pH的分布如图。25℃时,通过调节pH使废水中的 转化为
转化为 ,溶液中剩余
,溶液中剩余 的浓度小于
的浓度小于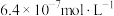 ,则调节pH的范围为
,则调节pH的范围为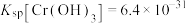 }。
}。
 具有两性,溶解在NaOH溶液中得到
具有两性,溶解在NaOH溶液中得到 ,写出该反应的离子方程式:
,写出该反应的离子方程式: 在
在 时,转化为
时,转化为 ,向含
,向含 的溶液中加入氨水可得到微溶于水的
的溶液中加入氨水可得到微溶于水的 ,
, 受热最终会分解生成钒的余化物,取234g
受热最终会分解生成钒的余化物,取234g 焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为
焙烧,焙烧过程中剩余固体的质量m随温度的变化曲线如图,则b的化学式为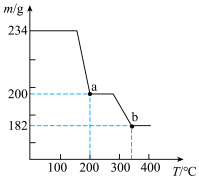
您最近一年使用:0次
名校
解题方法
6 . 下表列出了9种元素在元素周期表中的位置示意图。
(1)画出元素⑧形成的简单离子的结构示意图___________ 。
(2)用电子式表示元素④和⑥的单质在常温下反应所得产物的形成过程为___________ 。
(3)将③的最简单氢化物通入③的最高价氧化物对应水化物的溶液中,所得溶液中主要阳离子含有的化学键是___________ 。
(4)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最差的是___________ (填化学式),写出元素⑧的单质与水反应的离子反应方程式___________ 。
(5)工业上可以用Na2CO3溶液吸收Br2(g),过程中有气体生成,且产物中BrO-与BrO 的物质的量之比为2:1,请写出该过程的离子反应方程式
的物质的量之比为2:1,请写出该过程的离子反应方程式___________ 。
(6)32.64gCu与一定浓度③的最高价氧化物对应水化物反应生成NO、NO2、N2O4等气体,将生成的NO、NO2、N2O4与0.1molO2混合后,通入NaOH溶液,气体被完全吸收得到NaNO3和NaNO2的混合溶液,则混合溶液中NaNO2的物质的量为___________ mol。
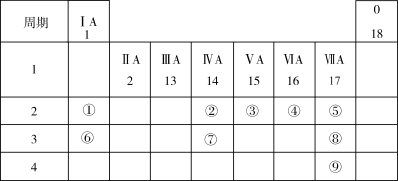
(1)画出元素⑧形成的简单离子的结构示意图
(2)用电子式表示元素④和⑥的单质在常温下反应所得产物的形成过程为
(3)将③的最简单氢化物通入③的最高价氧化物对应水化物的溶液中,所得溶液中主要阳离子含有的化学键是
(4)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最差的是
(5)工业上可以用Na2CO3溶液吸收Br2(g),过程中有气体生成,且产物中BrO-与BrO
 的物质的量之比为2:1,请写出该过程的离子反应方程式
的物质的量之比为2:1,请写出该过程的离子反应方程式(6)32.64gCu与一定浓度③的最高价氧化物对应水化物反应生成NO、NO2、N2O4等气体,将生成的NO、NO2、N2O4与0.1molO2混合后,通入NaOH溶液,气体被完全吸收得到NaNO3和NaNO2的混合溶液,则混合溶液中NaNO2的物质的量为
您最近一年使用:0次
名校
7 . 请根据硫元素的价类二维图,回答下列问题:___________ (填化学式)。
(2)宋代著名法医学家宋慈的 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法错误 的是___________(填字母)。
(3)Y转化为Z可以选择下列试剂___________ 。
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式___________ 。
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲: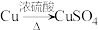 乙:
乙:
①写出甲方法反应的化学方程式:___________ 。
②甲和乙方法更合理的是___________ (填“甲”或“乙”),理由是___________ (答两点)。
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。___________ mg•L-1(结果精确到0.001)。

(2)宋代著名法医学家宋慈的
 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法| A.当银针变黑时,说明所检验的物质中可能有毒 |
| B.银针验毒时,Ag被氧化 |
| C.X在上述验毒反应中作还原剂 |
| D.上述验毒反应中氧化剂和还原剂的物质的量之比为4∶1 |
(3)Y转化为Z可以选择下列试剂
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲:
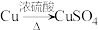 乙:
乙:
①写出甲方法反应的化学方程式:
②甲和乙方法更合理的是
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。
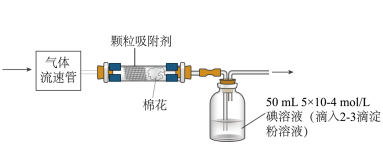
您最近一年使用:0次
2024-04-29更新
|
242次组卷
|
2卷引用:四川省南充高级中学2023-2024学年高一下学期3月月考化学试题
名校
解题方法
8 . CoSO47H2O有着广泛的应用,可以用作催化剂,用于有机合成反应中;还可以用于电镀、染色、制备颜料等工业应用。一种水钴矿中含SiO2、Co2O3、CuO、FeO、Al2O3、CaO及MgO等,以该水钴矿为原料提取出CoSO4·7H2O的工艺流程如下:
②当离子浓度小于或等于10-5molL-1时认为该离子沉淀完全。
请回答下列问题:
(1)为提高“浸出”速率,可以采取的措施是_______ 写出2条措施即可)。
(2)“浸出”步骤中,Co2O3发生反应的化学方程式为_______ 。
(3)滤渣Ⅰ的成分是_______ (填化学式)。
(4)“除铁、铝”步骤中,除铁时反应过程中氧化剂与还原剂的物质的量之比为_______ ;除铝时同时生成沉淀和气体,则发生反应的离子方程式为_______ 。
(5)“除钙、镁”步骤时,当钙离子和镁离子恰好除尽时,溶液中的氟离子浓度应不低于_______ molL-1。
(6)由“过滤Ⅱ”后的母液得到CoSO47H2O的操作是_______ ,_______ 、过滤、洗涤、干燥。
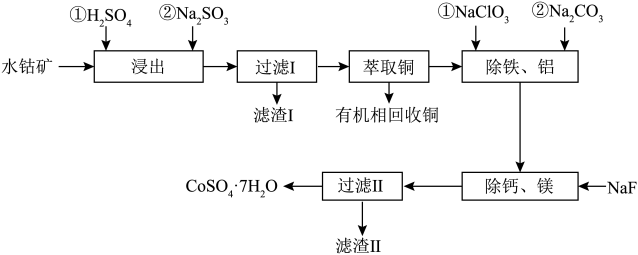
②当离子浓度小于或等于10-5molL-1时认为该离子沉淀完全。
请回答下列问题:
(1)为提高“浸出”速率,可以采取的措施是
(2)“浸出”步骤中,Co2O3发生反应的化学方程式为
(3)滤渣Ⅰ的成分是
(4)“除铁、铝”步骤中,除铁时反应过程中氧化剂与还原剂的物质的量之比为
(5)“除钙、镁”步骤时,当钙离子和镁离子恰好除尽时,溶液中的氟离子浓度应不低于
(6)由“过滤Ⅱ”后的母液得到CoSO47H2O的操作是
您最近一年使用:0次
解题方法
9 . 一个由北理工、北大、南阳理工等科学家组成的联合研究团队,首次提出并构筑出全新的2D-1D的本征异维超结构形式,该异维超结构由2DVS2和1DVS相互交叉排列,实现了多重研究突破。某科研小组以钒渣(主要成分是V2O3、Fe2O3、Al2O3、MgO、CuO和有机杂质)为主要原料制备VS、VS2的流程如下:
①含钒元素的离子在溶液中的主要存在形式与pH如下表所示。
②钒酸(H3VO4)是强酸,NH4VO3是白色粉末,微溶于冷水,可溶于热水。
请回答下列问题:
(1)写两种质子数和电子数均与 相同的离子:
相同的离子:_______ (填化学式)。
(2)废料中有机杂质在_______ (填工序名称)中被除去。
(3)“净化1”中pH=6时Fe3+、Al3+、Cu2+已完全沉淀,但在实际生产中仍然调节pH=7左右,其目的是_______ 。
(4)滤渣2的主要成分是_______ (填化学式)。
(5)洗涤NH4VO3沉淀时,与选用热水洗涤相比,流程中选用冷水洗涤的优点为_______ ;检验是否洗涤干净的方法是_______ 。
(6)试剂A可能是Al、CO、H2,若选择Al,除了生成钒单质,还会生成铝的氧化物和一种能使湿润的红色石蕊试纸变蓝的气体,其化学方程式为_______ 。若制备等质量的钒,需要还原剂Al、CO、H2的质量之比为_______ 。
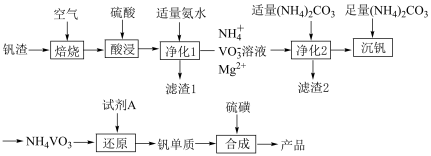
①含钒元素的离子在溶液中的主要存在形式与pH如下表所示。
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | V2O | VO |
请回答下列问题:
(1)写两种质子数和电子数均与
 相同的离子:
相同的离子:(2)废料中有机杂质在
(3)“净化1”中pH=6时Fe3+、Al3+、Cu2+已完全沉淀,但在实际生产中仍然调节pH=7左右,其目的是
(4)滤渣2的主要成分是
(5)洗涤NH4VO3沉淀时,与选用热水洗涤相比,流程中选用冷水洗涤的优点为
(6)试剂A可能是Al、CO、H2,若选择Al,除了生成钒单质,还会生成铝的氧化物和一种能使湿润的红色石蕊试纸变蓝的气体,其化学方程式为
您最近一年使用:0次
解题方法
10 . 铬酰氯( )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:
某小组设计如图装置利用 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。
(1)装浓盐酸的仪器名称是___________ ,B装置作用是___________ 。
(2)A中可能看到的现象是___________ ,利用浓硫酸的性质是___________ 。
(3)C中反应的化学方程式是___________ 。
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:___________ (填“是”或“否”),请解释原因:___________ 。
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用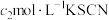 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。
该样品中氯元素质量分数为___________ 。如果滴定管没有润洗,测得结果会___________ (填“偏高”“偏低”或“无影响”)。
已知:常温下, ,
,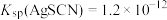 ,
,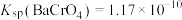 。
。
 )常作有机合成的氯化剂。它的部分性质如下表所示:
)常作有机合成的氯化剂。它的部分性质如下表所示:| 物理性质 | 化学性质 |
| 熔点:-96.5℃,沸点:117℃ | 放置在空气中会迅速挥发并水解 |
 和HCl迅速反应制备铬酰氯。
和HCl迅速反应制备铬酰氯。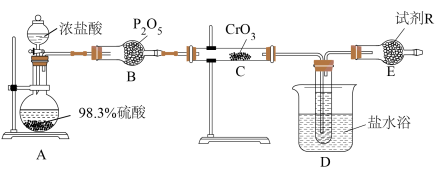
(1)装浓盐酸的仪器名称是
(2)A中可能看到的现象是
(3)C中反应的化学方程式是
(4)有人认为,E装置可以用盛装NaOH溶液的洗气瓶替代,是否合理:
(5)利用如图装置测定铬酰氯中氯元素含量(杂质不参与反应)。
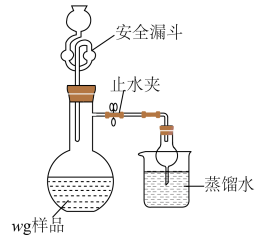
 溶液,过滤,用稀硝酸酸化滤液,再加入
溶液,过滤,用稀硝酸酸化滤液,再加入 溶液,最后用
溶液,最后用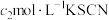 溶液滴定过量的
溶液滴定过量的 ,消耗溶液
,消耗溶液 。
。该样品中氯元素质量分数为
已知:常温下,
 ,
,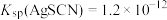 ,
,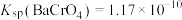 。
。
您最近一年使用:0次



