名校
1 . 氯元素的化合价与部分物质类别的对应关系如图所示,据图判断下列说法错误的是
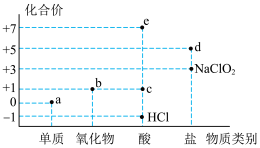
| A.c在光照条件下很容易分解 |
| B.b不是酸性氧化物,因为它没有对应的含氧酸 |
| C.图中a、b、c、d、e五种物质中均含有共价键,且c、d、e属于电解质 |
D.将a通入 溶液中,已知生成 溶液中,已知生成 、 、 和d的混合物,若 和d的混合物,若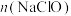 与 与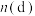 之比为 之比为 ,则氧化剂与还原剂的物质的量之比为 ,则氧化剂与还原剂的物质的量之比为 |
您最近一年使用:0次
2023-11-21更新
|
393次组卷
|
5卷引用:甘肃省兰州第一中学2023-2024学年高一上学期1月期末化学试题
解题方法
2 .  在常温下就可以与
在常温下就可以与 反应,化学方程式如下:
反应,化学方程式如下: (白色固体)
(白色固体) (未配平),设阿伏加德罗常数的值为
(未配平),设阿伏加德罗常数的值为 ,回答下列问题。
,回答下列问题。
(1)配平化学方程式,并用单线桥法表示电子转移的方向和数目:___________ 。
___________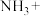 ___________
___________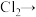 ___________
___________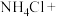 ___________
___________
(2)上述反应中的氧化产物为___________ (填化学式),氧化剂与还原剂的物质的量之比为___________ 。
(3)当生成1mol氮气时,被氧化的物质的质量为___________ ,反应中转移电子数为___________  。
。
(4)下列说法中正确的是___________(填字母)。
(5)已知:CuO能够和 在加热条件下反应生成两种单质,写出在加热条件下CuO和
在加热条件下反应生成两种单质,写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:___________ 。
 在常温下就可以与
在常温下就可以与 反应,化学方程式如下:
反应,化学方程式如下: (白色固体)
(白色固体) (未配平),设阿伏加德罗常数的值为
(未配平),设阿伏加德罗常数的值为 ,回答下列问题。
,回答下列问题。(1)配平化学方程式,并用单线桥法表示电子转移的方向和数目:
___________
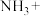 ___________
___________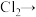 ___________
___________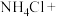 ___________
___________
(2)上述反应中的氧化产物为
(3)当生成1mol氮气时,被氧化的物质的质量为
 。
。(4)下列说法中正确的是___________(填字母)。
| A.上述反应中能观察到有白烟产生 |
| B.上述反应中生成的气体有刺激性气味 |
C. 不含金属阳离子,不属于盐类 不含金属阳离子,不属于盐类 |
| D.可用浓氨水来检验氯气管道是否泄漏 |
 在加热条件下反应生成两种单质,写出在加热条件下CuO和
在加热条件下反应生成两种单质,写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:
您最近一年使用:0次
解题方法
3 . 下列物质对水的处理过程中,涉及氧化还原反应的是
| A.用活性炭吸附水中的异味 | B.用 使废水中的 使废水中的 转化成CuS沉淀 转化成CuS沉淀 |
| C.用熟石灰中和酸性废水 | D.用漂白粉处理游泳池的水 |
您最近一年使用:0次
名校
4 . 氮化钛(TiN)是一种新型多功能金属陶瓷材料,以四氯化钛为原料,在氢气氛围下,与氨气在700℃时制得TiN的反应方程式为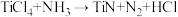 (未配平),下列说法正确的是
(未配平),下列说法正确的是
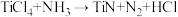 (未配平),下列说法正确的是
(未配平),下列说法正确的是| A.TiCl4作氧化剂,氯被还原 |
B.参加反应的NH3有 被氧化 被氧化 |
| C.TiN既是还原产物又是氧化产物 |
| D.反应中每转移1.2mol电子,会生成2.5mol气体 |
您最近一年使用:0次
2023-10-29更新
|
157次组卷
|
2卷引用:甘肃省兰州第一中学2023-2024学年高三上学期12月月考化学试题
解题方法
5 . 硫酸铈铵 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈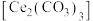 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
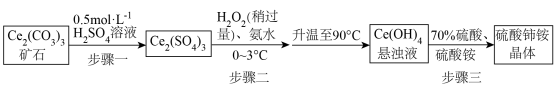
已知:①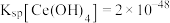 。
。
②硫酸铈铵的熔点为 ,沸点为
,沸点为 。
。
回答下列问题:
(1)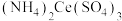 中铈元素的化合价为
中铈元素的化合价为_______ 。
(2)步骤一中,先将
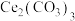 矿石粉碎,目的是
矿石粉碎,目的是_______ 。
(3)步骤二中,反应温度需要控制在
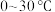 ,原因是
,原因是_______ 。反应完全后,要将混合物升温至
 ,目的是
,目的是_______ 。
(4)步骤二中,
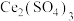 与
与
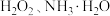 反应生成
反应生成
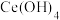 的化学方程式为
的化学方程式为_______ 。
(5)步骤三反应完全后的溶液经_______ 、_______ 、过滤,得到晶体。最后用_______ 洗涤
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。
(6)若最初称取一定量的碳酸铈矿石,其中含
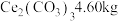 ,经该工艺流程最终获得
,经该工艺流程最终获得
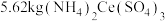 晶体,则
晶体,则
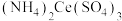 的产率为
的产率为_______ (保留三位有效数字)。
 微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈
微溶于水,不溶于乙醇,溶于无机酸,可用作分析试剂、氧化剂。某工厂用碳酸铈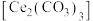 矿石制备硫酸铈铵的工艺流程如图:
矿石制备硫酸铈铵的工艺流程如图:
已知:①
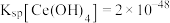 。
。②硫酸铈铵的熔点为
 ,沸点为
,沸点为 。
。回答下列问题:
(1)
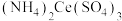 中铈元素的化合价为
中铈元素的化合价为(2)步骤一中,先将
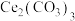 矿石粉碎,目的是
矿石粉碎,目的是(3)步骤二中,反应温度需要控制在
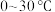 ,原因是
,原因是 ,目的是
,目的是(4)步骤二中,
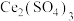 与
与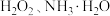 反应生成
反应生成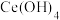 的化学方程式为
的化学方程式为(5)步骤三反应完全后的溶液经
 次后,得到高纯硫酸铈铵晶体。
次后,得到高纯硫酸铈铵晶体。(6)若最初称取一定量的碳酸铈矿石,其中含
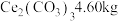 ,经该工艺流程最终获得
,经该工艺流程最终获得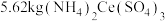 晶体,则
晶体,则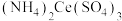 的产率为
的产率为
您最近一年使用:0次
2023-10-29更新
|
764次组卷
|
4卷引用:甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题
甘肃省平凉市静宁县2023-2024学年高三上学期11月月考化学试题广西北海市2024届高三一模考试化学试题西藏林芝市2023-2024学年高三上学期期末考试化学试题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
解题方法
6 . 某反应体系中只有五种物质:AsH3、H2O、HBrO3、H3AsO4、Br2。启动反应后,两种含溴物质的物质的量变化如图所示。下列叙述正确的是


| A.在该反应中,氧化剂是Br2,还原剂是AsH3 |
| B.氧化产物、还原产物的物质的量之比为4∶5 |
| C.1mol还原剂完全反应时转移8mol电子 |
| D.上述反应所涉及的物质含共价键和离子键 |
您最近一年使用:0次
2023-10-27更新
|
216次组卷
|
4卷引用:甘肃省白银市名校2023-2024学年高三下学期联合调研化学试题
名校
解题方法
7 . 某小组在验证反应“ ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。
向硝酸酸化的 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
(1)检测到滤液中含有 ,可以选用的试剂为
,可以选用的试剂为___________ (填化学式)溶液。 产生的原因可能有以下几种。
产生的原因可能有以下几种。
假设a:可能是铁粉表面有氧化层,能产生 。
。
假设b:空气中存在 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:___________ 。
假设c:酸性溶液中的 具有氧化性,可产生
具有氧化性,可产生 。
。
(2)某同学证明上面假设c不成立,向硝酸酸化的___________ 硝酸钠溶液中加入过量铁粉,搅拌后静置,一段时间后,上层清液未变黄色,经检验无 。
。
(3)取过滤后的黑色固体,洗涤后,___________ (填操作和现象),证明黑色固体中含有Ag。
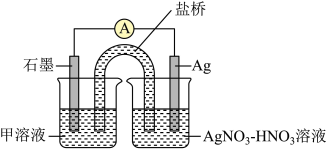
(4)某同学利用原电池证明 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为___________ 。写出石墨电极上发生的电极反应式:___________ 。电流表指针不再偏转后,向左侧烧杯中加入 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为___________ (填“正极”或“负极”),银电极的电极反应式为___________ 。
 ”,实验探究过程如下。结合探究过程回答下列问题。
”,实验探究过程如下。结合探究过程回答下列问题。向硝酸酸化的
 硝酸银溶液中(忽略
硝酸银溶液中(忽略 的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。
的水解)加入过量铁粉,搅拌后静置,一段时间后,将烧杯底部黑色固体过滤,滤液呈黄色。(1)检测到滤液中含有
 ,可以选用的试剂为
,可以选用的试剂为 产生的原因可能有以下几种。
产生的原因可能有以下几种。假设a:可能是铁粉表面有氧化层,能产生
 。
。假设b:空气中存在
 ,
, 被氧化为
被氧化为 ,写出反应的离子方程式:
,写出反应的离子方程式:假设c:酸性溶液中的
 具有氧化性,可产生
具有氧化性,可产生 。
。(2)某同学证明上面假设c不成立,向硝酸酸化的
 。
。(3)取过滤后的黑色固体,洗涤后,
(4)某同学利用原电池证明
 可以将
可以将 氧化为
氧化为 ,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除
,设计了如图所示的原电池装置。连接装置后,电流表中有电流通过,一段时间后电流表不再偏转(所用溶液均已去除 )。甲溶液中的溶质为
)。甲溶液中的溶质为 固体,发现电流表指针反向偏转,此时石墨电极为
固体,发现电流表指针反向偏转,此时石墨电极为
您最近一年使用:0次
2023-10-26更新
|
612次组卷
|
7卷引用:甘肃省部分校2024届高三上学期10月月考化学试题
名校
8 . 菱锌矿(主要成分是 ,还含有MnO、FeO、
,还含有MnO、FeO、 、
、 等杂质)是制取锌单质的重要原料。回答下列问题:
等杂质)是制取锌单质的重要原料。回答下列问题:
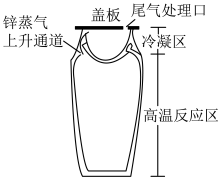
(1)古代以菱锌矿和煤炭饼为原料利用热还原法在如图所示的坩埚中制备Zn。
①该方法中,将菱锌矿敲碎与煤饼混合,此操作的主要目的是_______ 。
②图中盖板除了防止锌蒸气外逸外,另一主要作用是_______ ,尾气中含有CO,处理尾气的方法是_______ 。
(2)现代以菱锌矿为原料利用湿法冶炼锌主要分为如下五个步骤。
步骤1:用稀硫酸充分浸取菱锌矿:
步骤2:在步骤1的滤液中加入适量 除去其中的
除去其中的 ;
;
步骤3:在步骤2的滤液中加入试剂R调节溶液pH除去 ;
;
步骤4:经操作X从步骤3的滤液中获得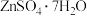 晶体:
晶体:
步骤5:将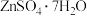 溶于水配成饱和溶液,电解该饱和溶液得到Zn。
溶于水配成饱和溶液,电解该饱和溶液得到Zn。
①步骤1中用稀硫酸浸取后,所得滤渣的主要成分是_______ (填化学式)。
②步骤2中 与
与 反应生成
反应生成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_______ 。
③为获得更多产品,步骤3中使用的试剂R应选择_______ (填字母)。
A. B.澄清石灰水 C.ZnO D.
B.澄清石灰水 C.ZnO D.
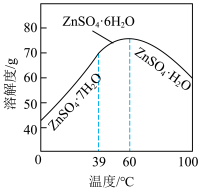
④温度与析出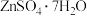 的关系如图所示,则步骤4中操作X的具体操作是
的关系如图所示,则步骤4中操作X的具体操作是_______ 、冰水洗涤、干燥。
 ,还含有MnO、FeO、
,还含有MnO、FeO、 、
、 等杂质)是制取锌单质的重要原料。回答下列问题:
等杂质)是制取锌单质的重要原料。回答下列问题:
(1)古代以菱锌矿和煤炭饼为原料利用热还原法在如图所示的坩埚中制备Zn。
①该方法中,将菱锌矿敲碎与煤饼混合,此操作的主要目的是
②图中盖板除了防止锌蒸气外逸外,另一主要作用是
(2)现代以菱锌矿为原料利用湿法冶炼锌主要分为如下五个步骤。
步骤1:用稀硫酸充分浸取菱锌矿:
步骤2:在步骤1的滤液中加入适量
 除去其中的
除去其中的 ;
;步骤3:在步骤2的滤液中加入试剂R调节溶液pH除去
 ;
;步骤4:经操作X从步骤3的滤液中获得
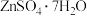 晶体:
晶体:步骤5:将
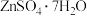 溶于水配成饱和溶液,电解该饱和溶液得到Zn。
溶于水配成饱和溶液,电解该饱和溶液得到Zn。①步骤1中用稀硫酸浸取后,所得滤渣的主要成分是
②步骤2中
 与
与 反应生成
反应生成 ,写出该反应的离子方程式:
,写出该反应的离子方程式:③为获得更多产品,步骤3中使用的试剂R应选择
A.
 B.澄清石灰水 C.ZnO D.
B.澄清石灰水 C.ZnO D.
④温度与析出
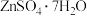 的关系如图所示,则步骤4中操作X的具体操作是
的关系如图所示,则步骤4中操作X的具体操作是
您最近一年使用:0次
2023-10-20更新
|
89次组卷
|
4卷引用:甘肃省武威市多校联考2024届高三上学期9月质量检测化学试题
名校
9 . 血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合的能力,药品美蓝是其有效的解毒剂,下列说法中正确的是
| A.NaNO2被氧化 | B.药品美蓝是还原剂 |
| C.NaNO2是还原剂 | D.药品美蓝被还原 |
您最近一年使用:0次
2023-10-11更新
|
155次组卷
|
3卷引用:甘肃省天水市第一中学2023-2024学年高一上学期10月月考化学试题
名校
解题方法
10 . 三氯氧钒(VOCl3,M=173.5g/mol)是一种重要的无机试剂,主要用作溶剂、烯烃聚合的催化剂,还可用于钒有机化合物的合成。已知三氯氧钒为黄色液体,密度为1.84g/cm3,熔点为-77℃,沸点为126℃,遇水会迅速水解生成HCl和一种氧化物。某小组同学利用如图装置以氯气、V2O5和碳粉为原料制备三氯氧钒。
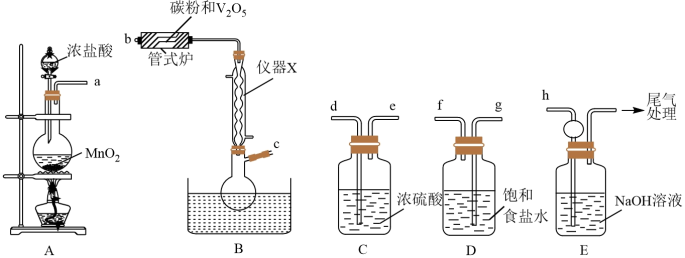
回答下列问题:
(1)仪器X的名称为___________ 。
(2)从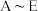 中选择必要的仪器制备VOCl3,正确的连接顺序是
中选择必要的仪器制备VOCl3,正确的连接顺序是___________ (按气流方向,用小写字母表示,装置可重复使用)。
(3)装置A中发生反应的离子方程式为___________ 。
(4)管式炉中发生反应生成CO的化学方程式为___________ 。
(5)装置D的作用为___________ 。
(6)装置E的作用为___________ 。
(7)实验过程中正确的加热顺序为___________ (填序号)。
①先点燃A处酒精灯,再加热管式炉
②先加热管式炉,再点燃A处酒精灯
(8)若管式炉中加入 和
和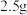 的碳粉,通入足量氯气充分反应后,在装置
的碳粉,通入足量氯气充分反应后,在装置 的烧瓶中最终收集到
的烧瓶中最终收集到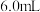 黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为___________ (保留3位有效数字)。

回答下列问题:
(1)仪器X的名称为
(2)从
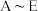 中选择必要的仪器制备VOCl3,正确的连接顺序是
中选择必要的仪器制备VOCl3,正确的连接顺序是(3)装置A中发生反应的离子方程式为
(4)管式炉中发生反应生成CO的化学方程式为
(5)装置D的作用为
(6)装置E的作用为
(7)实验过程中正确的加热顺序为
①先点燃A处酒精灯,再加热管式炉
②先加热管式炉,再点燃A处酒精灯
(8)若管式炉中加入
 和
和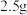 的碳粉,通入足量氯气充分反应后,在装置
的碳粉,通入足量氯气充分反应后,在装置 的烧瓶中最终收集到
的烧瓶中最终收集到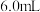 黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
黄色的三氯氧钒液体,则该实验中三氯氧钒的产率为
您最近一年使用:0次
2023-10-09更新
|
667次组卷
|
4卷引用:甘肃省张掖市民乐县第一中学2023-2024学年高三上学期第二次诊断(期中)考试化学试题



