名校
解题方法
1 . 无机非金属元素在化工生产中扮演着重要的角色,请利用相关知识回答下列问题:
(1)硅单质可作为硅半导体材料,三氯硅烷( )还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: ;ii.三氯硅烷易被氧化。
;ii.三氯硅烷易被氧化。
①硅在周期表中的位置是___________ 。
②工业上原料石英砂常用 溶液浸泡除杂,实验室检验溶液中存在
溶液浸泡除杂,实验室检验溶液中存在 的操作与现象为
的操作与现象为___________ 。
③写出制粗硅的化学方程式___________ 。
④整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成 、
、 和一种气体单质,该气体单质是
和一种气体单质,该气体单质是___________ (填名称);在制备高纯硅的过程中若混入 ,可能引起的后果是
,可能引起的后果是___________ 。
⑤用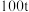 含二氧化硅
含二氧化硅 的石英矿,整个制备提纯过程硅元素损失了
的石英矿,整个制备提纯过程硅元素损失了 ,最终获得高纯硅的质量为
,最终获得高纯硅的质量为___________ t(结果精确到小数点后两位)。
(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(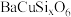 ,铜为
,铜为 价),下列说法正确的是___________。
价),下列说法正确的是___________。
(3)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是___________(填序号)。
(1)硅单质可作为硅半导体材料,三氯硅烷(
 )还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
 ;ii.三氯硅烷易被氧化。
;ii.三氯硅烷易被氧化。①硅在周期表中的位置是
②工业上原料石英砂常用
 溶液浸泡除杂,实验室检验溶液中存在
溶液浸泡除杂,实验室检验溶液中存在 的操作与现象为
的操作与现象为③写出制粗硅的化学方程式
④整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成 、
、 和一种气体单质,该气体单质是
和一种气体单质,该气体单质是 ,可能引起的后果是
,可能引起的后果是⑤用
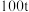 含二氧化硅
含二氧化硅 的石英矿,整个制备提纯过程硅元素损失了
的石英矿,整个制备提纯过程硅元素损失了 ,最终获得高纯硅的质量为
,最终获得高纯硅的质量为(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(
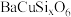 ,铜为
,铜为 价),下列说法正确的是___________。
价),下列说法正确的是___________。A. | B.可用氧化物形式表示为  |
| C.硅酸铜钡易溶于强酸和强碱 | D.唐宋时期,我国的瓷器已享誉海内外 |
| A.压电陶瓷 | B.高温结构陶瓷 | C.生物陶瓷 | D.超导陶瓷 |
您最近一年使用:0次
2023-05-03更新
|
209次组卷
|
2卷引用:甘肃省兰州第一中学2022-2023学年高一下学期4月期中考试化学试题
名校
2 .  (硫脲)是一种可用于制造药物、染料等溶于水的白色晶体。实验室可以
(硫脲)是一种可用于制造药物、染料等溶于水的白色晶体。实验室可以 (氰氨)与
(氰氨)与 溶液等为原料,在约50℃、
溶液等为原料,在约50℃、 为10~11条件下制取,发生的反应为
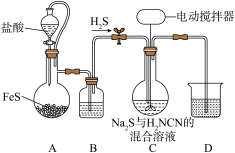
为10~11条件下制取,发生的反应为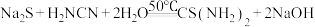 ,实验装置(夹持及加热装置已略)如图,下列说法错误的是
,实验装置(夹持及加热装置已略)如图,下列说法错误的是
 (硫脲)是一种可用于制造药物、染料等溶于水的白色晶体。实验室可以
(硫脲)是一种可用于制造药物、染料等溶于水的白色晶体。实验室可以 (氰氨)与
(氰氨)与 溶液等为原料,在约50℃、
溶液等为原料,在约50℃、 为10~11条件下制取,发生的反应为
为10~11条件下制取,发生的反应为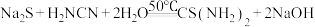 ,实验装置(夹持及加热装置已略)如图,下列说法错误的是
,实验装置(夹持及加热装置已略)如图,下列说法错误的是
A.装置A中的离子方程式为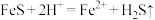 |
| B.装置B中盛放的试剂是浓硫酸 |
C.向装置C中通入 可调节 可调节 |
| D.装置D的主要作用是吸收尾气 |
您最近一年使用:0次
2023-03-26更新
|
107次组卷
|
2卷引用:甘肃省会宁县第一中学2023-2024学年高三下学期第一次月考化学试题
3 .  粉末在浓度极稀的硝酸(过量)溶液中,发生的反应为
粉末在浓度极稀的硝酸(过量)溶液中,发生的反应为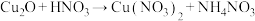
 (未配平),下列说法正确的是
(未配平),下列说法正确的是
 粉末在浓度极稀的硝酸(过量)溶液中,发生的反应为
粉末在浓度极稀的硝酸(过量)溶液中,发生的反应为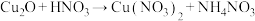
 (未配平),下列说法正确的是
(未配平),下列说法正确的是| A.该反应中参加反应的氧化剂与还原剂的物质的量之比为9:2 |
B.生成的化合物 中N元素的化合价均为+5价 中N元素的化合价均为+5价 |
C.该反应中,每转移0.16mol电子,消耗0.8mol  |
D.反应结束后,取少量上层液于试管中,往试管中加入适量的 白色固体,试管底部会有 白色固体,试管底部会有 白色固体生成 白色固体生成 |
您最近一年使用:0次
2023-03-22更新
|
398次组卷
|
3卷引用:甘肃省白银市2022-2023学年高一下学期开学考(上学期期末)联考化学试题
名校
解题方法
4 . 从废铅膏(主要成分为 、
、 、
、 和
和 ,含少量
,含少量 、
、 等元素)中获取高纯
等元素)中获取高纯 的工艺流程如图。下列说法不正确的是
的工艺流程如图。下列说法不正确的是
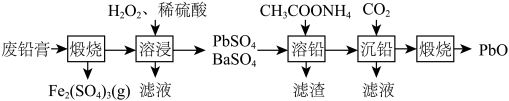
 、
、 、
、 和
和 ,含少量
,含少量 、
、 等元素)中获取高纯
等元素)中获取高纯 的工艺流程如图。下列说法不正确的是
的工艺流程如图。下列说法不正确的是
A.“煅烧”过程利用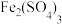 沸点低进行分离提纯 沸点低进行分离提纯 |
B.“溶浸”过程 主要用于氧化 主要用于氧化 |
C.“溶铅”过程的离子方程式为 |
D.“沉铅”过程的化学方程式为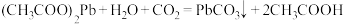 |
您最近一年使用:0次
2023-03-08更新
|
817次组卷
|
5卷引用:甘肃省会宁县第一中学2023-2024学年高三下学期第一次月考化学试题
甘肃省会宁县第一中学2023-2024学年高三下学期第一次月考化学试题福建省厦门市2023届高三毕业班3月第二次质量检测化学试题(已下线)湖北省七市(州)2023届高三3月联合统一调研测试化学试题变式题(选择题11-15)广东省深圳市福田区红岭中学2022-2023学年高三下学期第五次模拟化学试题新疆伊犁哈萨克自治州奎屯市第一高级中学2023-2024学年高三上学期9月月考化学试题
名校
5 . 已知 为无色离子。验证
为无色离子。验证 转化为
转化为 的实验操作和实验现象如下:
的实验操作和实验现象如下:
下列分析不合理 的是
 为无色离子。验证
为无色离子。验证 转化为
转化为 的实验操作和实验现象如下:
的实验操作和实验现象如下:| 实验操作 | 实验现象 |
①向 溶液中加入锌粉至 溶液中加入锌粉至 恰好转化为 恰好转化为 ②滴加  溶液 溶液 | I.溶液由黄色变成浅绿色 II.溶液无明显变化 |
A.解释现象I的反应: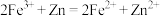 |
| B.若步骤②改为滴入少量氨水,则对应的现象是立即产生红褐色沉淀 |
C.若步骤①中 溶液与锌粉反应后还有锌粉剩余,则对应的现象是溶液由黄色变成无色 溶液与锌粉反应后还有锌粉剩余,则对应的现象是溶液由黄色变成无色 |
D.还原性: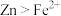 |
您最近一年使用:0次
名校
解题方法
6 . 镍是重要的战略金属资源,一种从某高镁低品位铜镍矿(主要成分为CuFeS2、FeS2、3NiO●4SiO2●H2O、3MgO●4SiO2●H2O等)中回收Cu、Ni的工艺流程如图所示:
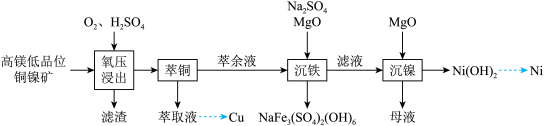
回答下列问题:
(1)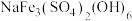 中,
中, 元素的化合价为
元素的化合价为_______ 。
(2)为提高“氧压浸出”的速率,可行的操作有_______ (任填一个)。
(3)“氧压浸出”的滤渣有S和_______ ,该环节中 发生的化学反应方程式为
发生的化学反应方程式为_______ 。
(4)“萃铜”时的反应为: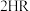 (有机相)
(有机相)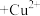 (水相)
(水相)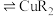 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。
(5)已知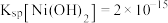 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为_______ ,“沉镍”后的母液,含有的主要溶质为_______ (填化学式)。

回答下列问题:
(1)
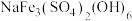 中,
中, 元素的化合价为
元素的化合价为(2)为提高“氧压浸出”的速率,可行的操作有
(3)“氧压浸出”的滤渣有S和
 发生的化学反应方程式为
发生的化学反应方程式为(4)“萃铜”时的反应为:
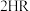 (有机相)
(有机相)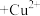 (水相)
(水相)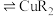 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。A.向萃取液中加入稀硫酸进行“反萃取”,可得到单质 |
B.萃余液中的阳离子为: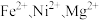 |
C.一定条件下,萃取平衡时,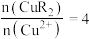 ,则 ,则 的萃取率为80% 的萃取率为80% |
D.为提高 的萃取率,可适当提高溶液 的萃取率,可适当提高溶液 |
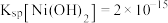 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为
您最近一年使用:0次
2023-02-09更新
|
1298次组卷
|
3卷引用:甘肃省会宁县第一中学2023-2024学年高三下学期第一次月考化学试题
名校
7 . 向仅含有 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。

提示:①不考虑 、
、 与水的反应;
与水的反应;
②不考虑气体的逸出;
③不考虑水电离出的 和
和 。
。
④产物只有 、
、 和
和 。
。
回答下列问题:
(1)
_______ ,曲线I对应的离子方程式为_______ 。
(2)b点溶液中,共含有_______ 种离子,分别为_______ (填离子符号)。
(3)
_______ ,曲线II对应的离子方程式为_______ 。
(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为_______ 。
 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
提示:①不考虑
 、
、 与水的反应;
与水的反应;②不考虑气体的逸出;
③不考虑水电离出的
 和
和 。
。④产物只有
 、
、 和
和 。
。回答下列问题:
(1)

(2)b点溶液中,共含有
(3)

(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为
您最近一年使用:0次
2023-02-08更新
|
521次组卷
|
4卷引用:甘肃省白银市2022-2023学年高一下学期开学考(上学期期末)联考化学试题
2023高三·全国·专题练习
8 . 已知Na2SO3具有强还原性,能够被Cl2氧化。某化工厂排出的废水中含0.014mol·L-1 Cl2、0.001mol·L-1 H+,废水排出的速度为10.0mL·s-1,为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的Na2SO3溶液(0.10mol·L-1)和烧碱溶液(0.10mol·L-1)。下列说法错误的是
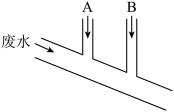

A.排出管A处发生的反应为 +Cl2+H2O= +Cl2+H2O= +2Cl-+2H+ +2Cl-+2H+ |
| B.废水排出管B处发生的反应为Cl2+2OH-=Cl-+ClO-+H2O |
| C.A处溶液的流量为1.4mL·s-1 |
| D.B处溶液的流量为2.8mL·s-1 |
您最近一年使用:0次
2023高三·全国·专题练习
9 . CO2、NO2、SO2是中学常见的非金属氧化物,下列有关三种氧化物的叙述正确的是
| A.它们均可与水反应生成酸,所以都是酸性氧化物 |
| B.它们都是无色、密度比空气大的有毒气体 |
| C.人类活动中过度排放CO2、SO2和NO2,都会引起酸雨 |
| D.它们在反应中都可做氧化剂 |
您最近一年使用:0次
名校
10 . 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石( ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:

已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是_______ (填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为_______ ,该反应中氧化剂与还原剂的质量之比为_______ 。
③每转移0.2mol电子,同时生成CO的体积为_______ (标准状况下)。
(2)在反应II中:
①氩气的作用为_______ 。
②该反应的基本反应类型为_______ 。
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
①上述反应的离子方程式为_______ 。
②金属钛的质量分数为_______ (用含m、c、V的代数式表示)。
 ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:
已知:①常温下,钛既不与常见非金属单质反应,也不与强酸反应;
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为
③每转移0.2mol电子,同时生成CO的体积为
(2)在反应II中:
①氩气的作用为
②该反应的基本反应类型为
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:①上述反应的离子方程式为
②金属钛的质量分数为
您最近一年使用:0次
2023-01-11更新
|
290次组卷
|
7卷引用:甘肃省庆阳市2022-2023学年高一上学期期末考试化学试题



