1 . 实验室利用含钴废渣[含Co(OH)3、Fe(OH)3等]制备磁性材料Co3O4。回答下列问题:
I.稀硫酸的配制。
(1)实验室里需要450mL2mol·L-1H2SO4溶液。用98%浓硫酸(密度为1.84g·cm-3)配制该溶液时,下列仪器不需要用到的是___________ (填标号)。

(2)所需的浓硫酸的体积为___________ (保留1位小数)mL。
(3)配制过程中,下列操作将导致溶液浓度偏小的是___________ (填标号)。
Ⅱ.浸取。将一定量的钴渣粉与Na2SO3溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃下通过仪器a缓慢滴加稀硫酸,充分反应,过滤。
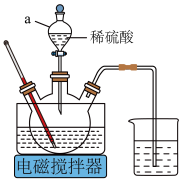
(4)仪器a的名称为___________ 。
(5)该过程中,Co(OH)3转化为Co2+的离子方程式为___________ 。
Ⅲ.沉钴。Co(Ⅱ)盐溶液可以形成Co(OH)2、CoCO3和CoC2O4等多种形式的沉淀。
已知:向0.100mol/LCoSO4溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH)2沉淀。
(6)向除杂后的CoSO4溶液中加入H2C2O4溶液或(NH4)2C2O4溶液作沉淀剂,可得到CoC2O4·2H2O。不能用同浓度的Na2C2O4溶液代替(NH4)2C2O4溶液的原因是___________ 。
Ⅳ.制备Co3O4。将所得的18.3g草酸钴晶体(CoC2O4·2H2O)高温灼烧,其热重分析图如图:
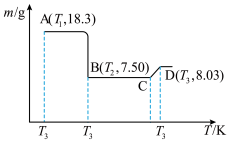
(7)写出B点对应的物质的化学式:___________ ,CD段发生反应的化学方程式为___________ 。
I.稀硫酸的配制。
(1)实验室里需要450mL2mol·L-1H2SO4溶液。用98%浓硫酸(密度为1.84g·cm-3)配制该溶液时,下列仪器不需要用到的是

(2)所需的浓硫酸的体积为
(3)配制过程中,下列操作将导致溶液浓度偏小的是___________ (填标号)。
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶未干燥处理 |
| C.定容加水时超过刻度线后,立即吸出多余的水 |
| D.将溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
Ⅱ.浸取。将一定量的钴渣粉与Na2SO3溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃下通过仪器a缓慢滴加稀硫酸,充分反应,过滤。

(4)仪器a的名称为
(5)该过程中,Co(OH)3转化为Co2+的离子方程式为
Ⅲ.沉钴。Co(Ⅱ)盐溶液可以形成Co(OH)2、CoCO3和CoC2O4等多种形式的沉淀。
已知:向0.100mol/LCoSO4溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH)2沉淀。
(6)向除杂后的CoSO4溶液中加入H2C2O4溶液或(NH4)2C2O4溶液作沉淀剂,可得到CoC2O4·2H2O。不能用同浓度的Na2C2O4溶液代替(NH4)2C2O4溶液的原因是
Ⅳ.制备Co3O4。将所得的18.3g草酸钴晶体(CoC2O4·2H2O)高温灼烧,其热重分析图如图:

(7)写出B点对应的物质的化学式:
您最近一年使用:0次
名校
解题方法
2 . 钼( )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
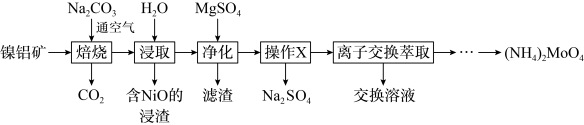
回答下列问题:
(1) 位于元素周期表第
位于元素周期表第_______ 周期第_______ 族。 中钼元素的化合价为
中钼元素的化合价为_______ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为_______ 。
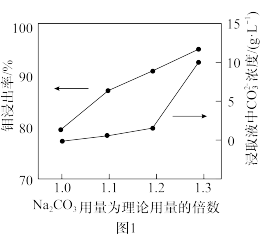
(3) 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:_______ 。
(4) 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。

(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“_______ ”步骤。
(6) 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为_______ 。
 )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
回答下列问题:
(1)
 位于元素周期表第
位于元素周期表第 中钼元素的化合价为
中钼元素的化合价为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)
 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:
(4)
 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。
| A.蒸发结晶 | B.低温结晶 | C.蒸馏 | D.萃取 |
(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“
(6)
 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为
您最近一年使用:0次
2024-01-22更新
|
1136次组卷
|
7卷引用:专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024年1月安徽普通高等学校招生考试适应性测试化学试题(已下线)T16-工业流程题(已下线)2024年1月“九省联考”安徽真题完全解读与考后提升(已下线)热点23 化学工艺流程综合题黑龙江省大庆市大庆中学2023-2024学年高三下学期开学化学试题江西省宜春市丰城市第九中学2023-2024学年高三(复读班)上学期期末考试化学试题
3 . 钴属于稀缺性金属。利用“微波辅助低共熔溶剂”浸取某废旧锂离子电池中钴酸锂粗品制备 产品,实现资源的循环利用。主要工艺流程如下:
产品,实现资源的循环利用。主要工艺流程如下: 是一种铵盐;
是一种铵盐;
② 在溶液中常以
在溶液中常以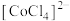 (蓝色)和
(蓝色)和 (粉红色)形式存在;
(粉红色)形式存在;
③ 时,
时, 。
。
回答下列问题:
(1) 中
中 的化合价为
的化合价为_______ 。
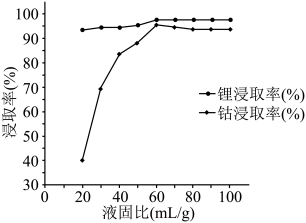
(2)下图为“微波共熔”中氯化胆碱-草酸和 粗品以不同的液固比在
粗品以不同的液固比在 下微波处理
下微波处理 后锂和钴的浸取率图,则最佳液固比为
后锂和钴的浸取率图,则最佳液固比为_______  。
。_______ 。
(4) 时,“沉钴”反应完成后,溶液
时,“沉钴”反应完成后,溶液 ,此时
,此时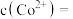
_______  。
。
(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是_______ 。
(6)“高温烧结”中需要通入空气,其作用是_______ 。
(7)锂离子电池正极材料 在多次充放电后由于可循环锂的损失,结构发生改变生成
在多次充放电后由于可循环锂的损失,结构发生改变生成 ,导致电化学性能下降。
,导致电化学性能下降。
① 晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为
晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为_______ (用离子符号表示)。
②使用 和
和 溶液可以实现
溶液可以实现 的修复,则修复过程中的化学反应方程式为
的修复,则修复过程中的化学反应方程式为_______ 。
 产品,实现资源的循环利用。主要工艺流程如下:
产品,实现资源的循环利用。主要工艺流程如下:
 是一种铵盐;
是一种铵盐;②
 在溶液中常以
在溶液中常以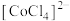 (蓝色)和
(蓝色)和 (粉红色)形式存在;
(粉红色)形式存在;③
 时,
时, 。
。回答下列问题:
(1)
 中
中 的化合价为
的化合价为(2)下图为“微波共熔”中氯化胆碱-草酸和
 粗品以不同的液固比在
粗品以不同的液固比在 下微波处理
下微波处理 后锂和钴的浸取率图,则最佳液固比为
后锂和钴的浸取率图,则最佳液固比为 。
。
(4)
 时,“沉钴”反应完成后,溶液
时,“沉钴”反应完成后,溶液 ,此时
,此时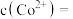
 。
。(5)“滤饼2”在高温烧结前需要洗涤、干燥,检验“滤饼2”是否洗涤干净的操作及现象是
(6)“高温烧结”中需要通入空气,其作用是
(7)锂离子电池正极材料
 在多次充放电后由于可循环锂的损失,结构发生改变生成
在多次充放电后由于可循环锂的损失,结构发生改变生成 ,导致电化学性能下降。
,导致电化学性能下降。①
 晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为
晶体(常式尖晶石型)的晶胞示意图如图所示,则顶点上的离子为②使用
 和
和 溶液可以实现
溶液可以实现 的修复,则修复过程中的化学反应方程式为
的修复,则修复过程中的化学反应方程式为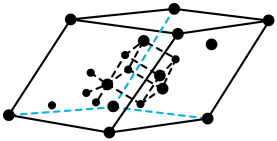
您最近一年使用:0次
2024-01-22更新
|
1119次组卷
|
5卷引用:专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)2024年1月贵州普通高等学校招生考试适应性测试化学试题(已下线)2024年1月“九省联考”贵州卷真题完全解读与考后提升(已下线)T16-工业流程题辽宁省沈阳市东北育才学校高中部2023-2024学年高三下学期第六次模拟考试化学试题
名校
4 . 写出下列反应的方程式:
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式___________ 。
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式___________ 。
(3)漂白粉在空气中生效的化学方程式___________ 。
(4)请写出次氯酸光照分解的离子方程式___________ 。
(5) 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式______ 。
(1)氢氧化亚铁沉淀在空气中迅速变为灰绿色,最终变成红褐色对应的化学方程式
(2)工业用氯化铁溶液腐蚀铜印刷电路板的离子方程式
(3)漂白粉在空气中生效的化学方程式
(4)请写出次氯酸光照分解的离子方程式
(5)
 中的少量
中的少量 ,可以利用加入酸性
,可以利用加入酸性 溶液进行检验,请写出离子方程式
溶液进行检验,请写出离子方程式
您最近一年使用:0次
解题方法
5 . 高铁酸盐(如K2FeO4)可用于净水。某化学小组同学进行以下两组实验,在制得氢氧化铁的基础上制备高铁酸盐。已知,①Fe2+对双氧水的分解有一定的催化作用;②制备高铁酸钾的反应原理为3C12+2Fe(OH)3+1OKOH=2K2FeO4+6KC1+8H2O。回答下列问题:
实验Ⅰ:取100mL饱和FeSO4溶液,滴加12%硫酸酸化的双氧水,再慢慢加入5mol/L的NaOH溶液;
(1)实验Ⅰ滴加双氧水的过程中,观察到溶液颜色变成黄色:其反应的离子方程式为_______ ,在溶液变成黄色的同时,看到不断有气泡产生,其原因是_________ 。
(2)完成实验Ⅰ后,及时对烧杯壁上附着的Fe(OH)3进行了清洗,但错把氢碘酸(HI,强酸)当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质(I2)。他们认为可能是Fe(OH)3和HI反应生成了I2,配平该反应的离子方程式:______ ,__Fe(OH)3+___H++___I-=Fe2++__I2+H2O。
实验Ⅱ:在实验I的基础上用制得的Fe(OH)3合成K2FeO4,其装置如下(夹持仪器已略去):
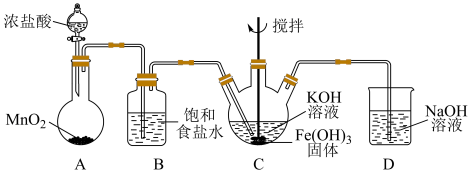
(3)上述装置中的明显错误是________ 。
(4)装置D中NaOH溶液的作用是______ 。
(5)若要制得19.8gK2FeO4,理论上需要浓盐酸的物质的量为_____ mol,但实验发现,浓盐酸的实际加入量远超过理论用量,分析出现该情况的原因:________ 。
(6)研究发现,酸性条件下,几种氧化剂的氧化性强弱关系为K2FeO4>KMnO4>Cl2,结合实验Ⅱ中信息,判断K2FeO4的氧化性强弱与_______ 有关。
实验Ⅰ:取100mL饱和FeSO4溶液,滴加12%硫酸酸化的双氧水,再慢慢加入5mol/L的NaOH溶液;
(1)实验Ⅰ滴加双氧水的过程中,观察到溶液颜色变成黄色:其反应的离子方程式为
(2)完成实验Ⅰ后,及时对烧杯壁上附着的Fe(OH)3进行了清洗,但错把氢碘酸(HI,强酸)当成盐酸加入到了烧杯中,观察到清洗液偏棕色,并通过实验检测到了碘单质(I2)。他们认为可能是Fe(OH)3和HI反应生成了I2,配平该反应的离子方程式:
实验Ⅱ:在实验I的基础上用制得的Fe(OH)3合成K2FeO4,其装置如下(夹持仪器已略去):

(3)上述装置中的明显错误是
(4)装置D中NaOH溶液的作用是
(5)若要制得19.8gK2FeO4,理论上需要浓盐酸的物质的量为
(6)研究发现,酸性条件下,几种氧化剂的氧化性强弱关系为K2FeO4>KMnO4>Cl2,结合实验Ⅱ中信息,判断K2FeO4的氧化性强弱与
您最近一年使用:0次
名校
6 . 亚氯酸钠(NaClO2)和ClO2都是重要的漂白剂。
(1)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100mL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,用1.0×10﹣4mol•L﹣1的Na2S2O3溶液滴定(已知:2S2O +I2═S4O
+I2═S4O +2I﹣)。
+2I﹣)。
①加入的指示剂是_______ ,达到滴定终点时的现象是 _______ ;
②已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中ClO2的浓度是_______ mol•L﹣1。
(2)亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:
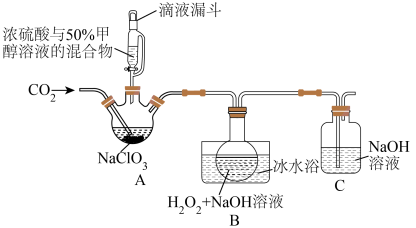
已知:
①硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
②饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(Ⅰ)装置B中生成NaClO2的化学方程式是_______ 。
(Ⅱ)从反应后的B溶液中制得NaClO2晶体的操作步骤是:
a.控制在38~60℃之间蒸发浓缩、结晶;
b._______ ;
c.用38~60℃的热水洗涤;
d.在低于60℃的真空中蒸发,干燥。
(1)自来水厂用碘量法检测水中ClO2的浓度,其实验操作如下:取100mL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,用1.0×10﹣4mol•L﹣1的Na2S2O3溶液滴定(已知:2S2O
 +I2═S4O
+I2═S4O +2I﹣)。
+2I﹣)。①加入的指示剂是
②已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中ClO2的浓度是
(2)亚氯酸钠(NaClO2)是一种应用广泛的高效氧化型漂白剂。以下是某小组模拟工业制法利用ClO2与H2O2在碱性条件下制备少量NaClO2的实验装置:

已知:
①硫酸作酸化剂时,甲醇(CH3OH)可将NaClO3还原为ClO2。
②饱和NaClO2溶液在温度低于38℃时析出晶体NaClO2•3H2O,在温度高于38℃时析出晶体NaClO2,高于60℃时分解生成NaClO3和NaCl。
回答下列问题:
(Ⅰ)装置B中生成NaClO2的化学方程式是
(Ⅱ)从反应后的B溶液中制得NaClO2晶体的操作步骤是:
a.控制在38~60℃之间蒸发浓缩、结晶;
b.
c.用38~60℃的热水洗涤;
d.在低于60℃的真空中蒸发,干燥。
您最近一年使用:0次
解题方法
7 . 在点滴板①②③三个孔穴中分别滴入3滴新制的氯水,再向②③中分别滴入3滴NaBr溶液、NaI溶液;向④⑤两个孔穴中分别滴入3滴溴水,向⑤中滴入3滴NaI溶液。下列关于该实验的说法正确的是


| A.新制氯水中水的电离程度大于纯水的 |
B.①②③可得出氧化性: |
| C.若用久置的氯水进行上述实验,实验现象与原实验现象完全相同 |
| D.上述实验中可以探究同主族元素性质的递变规律 |
您最近一年使用:0次
2023-12-24更新
|
941次组卷
|
4卷引用:专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)广东省部分名校2023-2024学年高三上学期联合质量检测化学试题山西省忻州市名校2023-2024学年高三上学期联合质量检测化学试卷(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(全国通用)
解题方法
8 . 由软锰矿(主要成分为MnO2,含有少量CaO、MgO)制备MnO2的工艺流程如下:
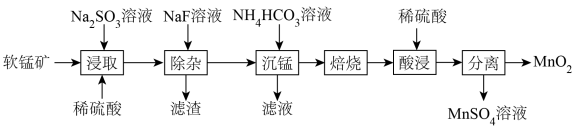
已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为_______ 。
(2)加快“浸取”速率可采取的措施为_______ (答出一种方法即可);“滤渣”的主要成分为_______ 。
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为_______ 。
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:_______ 。
(5)① 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为_______ 、_______ 。
②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是_______ 。
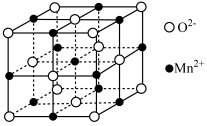
③MnO晶胞结构如图所示,平均每个晶胞中 组成的正四面体空隙有
组成的正四面体空隙有_______ 个,2个 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=_______ g·cm-3。

已知:“沉锰”所得MnCO3在空气中“焙烧”时转化为MnO2、Mn2O3、MnO的混合物。
回答下列问题:
(1)基态Mn的价电子排布式为
(2)加快“浸取”速率可采取的措施为
(3)“浸取”步骤中发生的氧化还原反应的化学方程式为
(4)可用惰性电极电解MnSO4溶液的方法制取MnO2,写出阳极的电极反应式:
(5)①
 、
、 两种离子的中心原子杂化方式分别为
两种离子的中心原子杂化方式分别为②MgO的晶体结构与MnO的晶体结构相似,但MgO熔点高于MnO的熔点,其原因是
③MnO晶胞结构如图所示,平均每个晶胞中
 组成的正四面体空隙有
组成的正四面体空隙有 之间的最近距离为acm,则MnO晶体的密度为
之间的最近距离为acm,则MnO晶体的密度为 =
=
您最近一年使用:0次
2023-12-08更新
|
293次组卷
|
2卷引用:甘肃省平凉市静宁县文萃中学2023-2024学年高三上学期第三次模拟考试化学试题
名校
9 . 某研究性学习小组探究了铜参与的某些氧化还原反应。回答下列问题:
(1)铜与浓硝酸反应的装置如图( 在碱性溶液中发生歧化反应):
在碱性溶液中发生歧化反应):
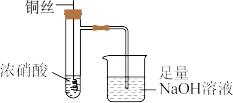
①此装置的优点有___________ 。
②用离子方程式解释NaOH溶液的作用:___________ 。
(2)探究铜与 的反应:
的反应:
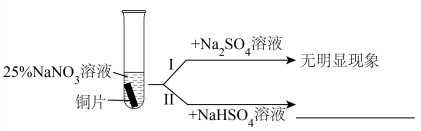
①实验Ⅱ中的现象为___________ 。
②实验Ⅰ、Ⅱ中现象不同的原因是___________ 。
(3)探究铜片与足量浓硫酸的反应(经检测所得“固体”中含有 和遇水变蓝色的物质X):
和遇水变蓝色的物质X):
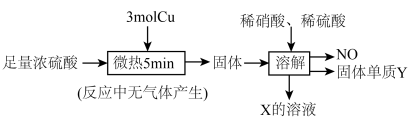
①生成NO的反应的离子方程式为___________ 。
②物质X在生产生活中的用途为___________ 。
③“固体”中 和物质X的物质的量之比为
和物质X的物质的量之比为___________ 。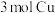 完全反应时消耗
完全反应时消耗 的物质的量为
的物质的量为___________ mol。
(1)铜与浓硝酸反应的装置如图(
 在碱性溶液中发生歧化反应):
在碱性溶液中发生歧化反应):
①此装置的优点有
②用离子方程式解释NaOH溶液的作用:
(2)探究铜与
 的反应:
的反应:
①实验Ⅱ中的现象为
②实验Ⅰ、Ⅱ中现象不同的原因是
(3)探究铜片与足量浓硫酸的反应(经检测所得“固体”中含有
 和遇水变蓝色的物质X):
和遇水变蓝色的物质X):
①生成NO的反应的离子方程式为
②物质X在生产生活中的用途为
③“固体”中
 和物质X的物质的量之比为
和物质X的物质的量之比为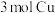 完全反应时消耗
完全反应时消耗 的物质的量为
的物质的量为
您最近一年使用:0次
名校
解题方法
10 . 化合物 (结构简式为
(结构简式为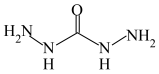 )是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为
)是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为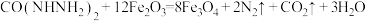 。下列说法正确的是
。下列说法正确的是
 (结构简式为
(结构简式为 )是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为
)是一种锅炉水添加剂,能除去锅炉水中的溶解氧,并可使锅炉壁钝化。钝化反应为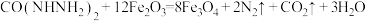 。下列说法正确的是
。下列说法正确的是| A.该反应是熵减过程 |
B. 可写成 可写成 ,属于混合物 ,属于混合物 |
| C.反应中C、N元素均被氧化 |
D.每生成 ,反应中转移 ,反应中转移 电子 电子 |
您最近一年使用:0次
2023-12-02更新
|
261次组卷
|
5卷引用:专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
(已下线)专题06 化学反应速率与平衡-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)贵州省贵阳市2023-2024学年高三上学期11月质量检测化学试题湖北省九师联盟2024届高三11月质检化学试题河南省部分名校2023-2024学年高三上学期11月期中化学试题江西省部分地区2023-2024学年高三上学期11月期中化学试题



