名校
解题方法
1 . 某化学兴趣小组设计如图实验装置(夹持装置已省略),探究 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是__________ 。
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。
①装置A中制备 的离子方程式为
的离子方程式为__________ 。
②证明 的氧化性大于
的氧化性大于 的现象是
的现象是__________ 。
③装置C的作用是__________ ,装置D中所盛试剂为__________ (填化学式)溶液。
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。
① 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
②实验完成后,打开弹簧夹,持续通入 的目的是
的目的是__________ 。
(4)淀粉 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(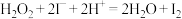 ,
, )。
)。
①滴定终点现象是__________ 。
②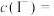
__________  。
。
 、
、 和
和 的氧化性强弱。
的氧化性强弱。
(1)玻璃管a的作用是
(2)实验Ⅰ:旋开恒压滴液漏斗的玻璃塞,打开活塞
 ,关闭活塞
,关闭活塞 ,通入
,通入 。
。①装置A中制备
 的离子方程式为
的离子方程式为②证明
 的氧化性大于
的氧化性大于 的现象是
的现象是③装置C的作用是
(3)实验Ⅱ:实验Ⅰ进行一段时间后,关闭活塞
 ,打开
,打开 ,通入
,通入 气体,验证
气体,验证 的氧化性比
的氧化性比 强。
强。①
 发生反应的化学方程式为
发生反应的化学方程式为②实验完成后,打开弹簧夹,持续通入
 的目的是
的目的是(4)淀粉
 溶液中
溶液中 的测定:取10.00mL淀粉
的测定:取10.00mL淀粉 溶液,加入足量的硫酸酸化的
溶液,加入足量的硫酸酸化的 溶液,然后加入少量的
溶液,然后加入少量的 粉末除去
粉末除去 ,然后用
,然后用 的
的 标准溶液滴定,达到滴定终点时三次测量平均消耗
标准溶液滴定,达到滴定终点时三次测量平均消耗 标准溶液的体积为25.00mL(
标准溶液的体积为25.00mL(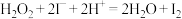 ,
, )。
)。①滴定终点现象是
②
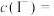
 。
。
您最近一年使用:0次
2024-04-10更新
|
199次组卷
|
3卷引用:甘肃省2024届高三普通高中三模化学试卷
名校
解题方法
2 . 硫酸铜可用于游泳池消毒,工业上一种利用含铜矿石(主要含 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示:
(1)为了提高“焙烧”的反应速率,可采取的措施为__________ (任写一种即可)。
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、 ),
), 发生反应的化学方程式为
发生反应的化学方程式为__________ 。
(3)“酸溶”后,溶液中的金属阳离子有__________ ;“滤渣a”用途为__________ (任写一点即可)。
(4)“转化”时发生反应的离子方程式为__________ ,不能将双氧水替换为硝酸的原因是__________ ,“一系列操作”包括蒸发浓缩、__________ 、过滤、干燥。
(5)硫酸铜晶体(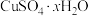 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为 ,则结晶水
,则结晶水
__________ (用字母表示)。
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为 ,晶胞参数为
,晶胞参数为 。
。
①O的配位数为__________ 。
②阿伏加德罗常数=__________ (用含 、a的字母表示)。
、a的字母表示)。
 、
、 、FeS以及少量
、FeS以及少量 等)制备硫酸铜晶体的工艺流程如图所示:
等)制备硫酸铜晶体的工艺流程如图所示: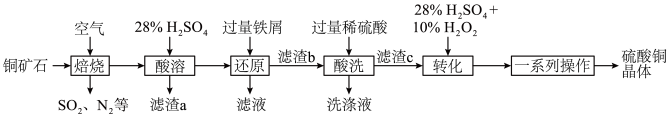
(1)为了提高“焙烧”的反应速率,可采取的措施为
(2)“焙烧”时金属元素均转化为其高价氧化物(CuO、
 ),
), 发生反应的化学方程式为
发生反应的化学方程式为(3)“酸溶”后,溶液中的金属阳离子有
(4)“转化”时发生反应的离子方程式为
(5)硫酸铜晶体(
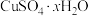 )结晶水的测定:准确称量硫酸铜晶体的质量
)结晶水的测定:准确称量硫酸铜晶体的质量 ,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为
,低温加热至晶体全部变为白色,冷却至室温后称量,反复几次,最终质量恒为 ,则结晶水
,则结晶水
(6)某Cu、O化合物的晶胞结构如图所示,该晶体的密度为
 ,晶胞参数为
,晶胞参数为 。
。①O的配位数为
②阿伏加德罗常数=
 、a的字母表示)。
、a的字母表示)。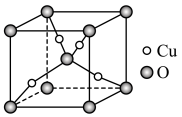
您最近一年使用:0次
2024-04-10更新
|
195次组卷
|
3卷引用:甘肃省2024届高三普通高中三模化学试卷
解题方法
3 .  在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。
(1)用丁达尔效应鉴别 胶体和
胶体和 溶液的操作是
溶液的操作是____________ (写出具体实验操作、结论)。
(2)电子工业中用 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:__________________ 。该反应的还原剂是______ 。
(3)硫化氢( )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为____________ 。该反应中氧化产物与还原产物的物质的量之比为______ 。
(4)某小组同学设计了制备无水) 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
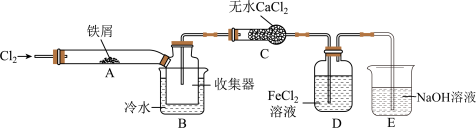
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的 ,赶尽装置中的空气;
,赶尽装置中的空气;
步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。
①装置A中发生反应的化学方程式为__________________ 。
②装置B中冷水浴的作用为____________ 。
 在现代工业生产中应用广泛,查阅资料得:无水
在现代工业生产中应用广泛,查阅资料得:无水 在空气中易潮解,加热易升华。
在空气中易潮解,加热易升华。(1)用丁达尔效应鉴别
 胶体和
胶体和 溶液的操作是
溶液的操作是(2)电子工业中用
 溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出
溶液腐蚀敷在绝缘板上的铜,从而制造印刷电路板,写出 溶液与铜反应的离子方程式:
溶液与铜反应的离子方程式:(3)硫化氢(
 )是一种有毒的气体,可用
)是一种有毒的气体,可用 溶液吸收,生成单质硫(S)沉淀。
溶液吸收,生成单质硫(S)沉淀。 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为(4)某小组同学设计了制备无水)
 的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
步骤Ⅰ.检验装置的气密性;
步骤Ⅱ.通入干燥的
 ,赶尽装置中的空气;
,赶尽装置中的空气;步骤Ⅲ.用酒精灯在铁屑下方加热至反应完成;
步骤Ⅳ.体系冷却后,停止通入
 ,并用干燥的
,并用干燥的 赶尽
赶尽 ,将收集器密封。
,将收集器密封。①装置A中发生反应的化学方程式为
②装置B中冷水浴的作用为
您最近一年使用:0次
名校
解题方法
4 . 焦亚硫酸钠( )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1) 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为__________ 。
(2)“ 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图:__________ 。
②饱和碳酸氢钠溶液的作用是__________ 。
③三颈烧瓶中生成 反应的化学方程式为
反应的化学方程式为__________ ( 为沉淀物)。
为沉淀物)。
(3)“ 制备”反应过程分四步:
制备”反应过程分四步:
步骤Ⅰ.在碳酸钠溶液中通入 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;
步骤Ⅱ.停止通 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;
步骤Ⅲ.继续通入 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;
步骤Ⅳ.当溶液中 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。
①步骤Ⅰ测量溶液的pH=4.1所用仪器是__________ 。
②写出步骤Ⅱ中反应的离子方程式:__________ 。
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:__________ 。
 )在化学工业中用途广泛。其一种制备流程如下:
)在化学工业中用途广泛。其一种制备流程如下:
(1)
 分子中,中心原子价层电子对数为
分子中,中心原子价层电子对数为(2)“
 制备”所用实验装置(夹持仪器已省略)如下图:
制备”所用实验装置(夹持仪器已省略)如下图: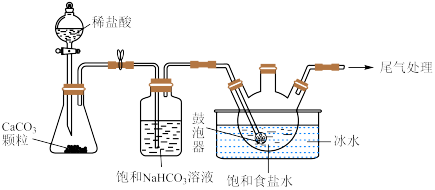
②饱和碳酸氢钠溶液的作用是
③三颈烧瓶中生成
 反应的化学方程式为
反应的化学方程式为 为沉淀物)。
为沉淀物)。(3)“
 制备”反应过程分四步:
制备”反应过程分四步:步骤Ⅰ.在碳酸钠溶液中通入
 至pH为4.1,生成
至pH为4.1,生成 溶液;
溶液;步骤Ⅱ.停止通
 ,向
,向 溶液中再加入
溶液中再加入 溶液调至pH为7~8,转化为
溶液调至pH为7~8,转化为 ;
;步骤Ⅲ.继续通入
 ,至pH达4.1,又生成
,至pH达4.1,又生成 溶液;
溶液;步骤Ⅳ.当溶液中
 含量达到过饱和浓度时析出
含量达到过饱和浓度时析出 。
。①步骤Ⅰ测量溶液的pH=4.1所用仪器是
②写出步骤Ⅱ中反应的离子方程式:
③写出Ⅰ~Ⅳ步骤中总反应的化学方程式:
您最近一年使用:0次
2024-03-30更新
|
291次组卷
|
5卷引用:甘肃省酒泉市九师联盟2023-2024学年高三下学期3月月考化学试题
名校
5 . 钒电池的安全性能优良,中国科学技术大学研制出锌离子和水分子共插层的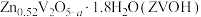 理想的水系锌离子电池材料,制备过程如下:
理想的水系锌离子电池材料,制备过程如下:
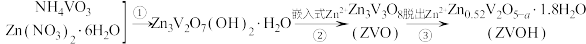
该电极放电时变化为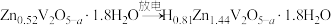 已知制备过程中V的化合价未发生改变,所涉及物质中除ZVO外均为电中性物质,过程②可视为转化成电中性材料后,再嵌入Zn2+。下列说法中正确的是
已知制备过程中V的化合价未发生改变,所涉及物质中除ZVO外均为电中性物质,过程②可视为转化成电中性材料后,再嵌入Zn2+。下列说法中正确的是
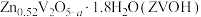 理想的水系锌离子电池材料,制备过程如下:
理想的水系锌离子电池材料,制备过程如下: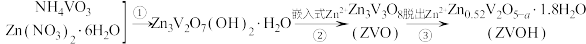
该电极放电时变化为
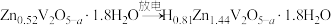 已知制备过程中V的化合价未发生改变,所涉及物质中除ZVO外均为电中性物质,过程②可视为转化成电中性材料后,再嵌入Zn2+。下列说法中正确的是
已知制备过程中V的化合价未发生改变,所涉及物质中除ZVO外均为电中性物质,过程②可视为转化成电中性材料后,再嵌入Zn2+。下列说法中正确的是| A.ZVOH作为新型电池的负极材料 |
| B.反应①属于复分解反应 |
| C.获得Zn(NO3)2·6H2O时,当溶液出现大量晶体时应停止加热,余热蒸干 |
D.ZVO中嵌入进来的Zn2+占总锌量的 |
您最近一年使用:0次
解题方法
6 . 甘肃矿产资源丰富,镍、钴、铂等金属储量全国领先,有色金属冶炼在国民经济发展有着重要作用。利用紫硫镍铁矿石提取粗镍并回收铁、铜、钴等元素的工艺流程如下:
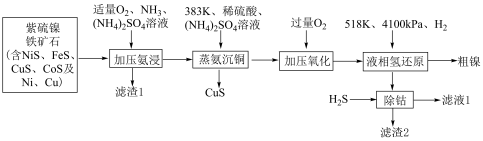
已知:①“加压氨浸”过程中镍硫化物发生反应的方程式为: ;在此过程中,钴硫化物的反应与镍硫化物相似。
;在此过程中,钴硫化物的反应与镍硫化物相似。
②以上流程中均无SO2产生。
请回答:
(1)滤渣1的主要成分为___________ 。
(2)结合下列图表选择“加压氨浸”的最佳条件___________ 。

(3)“加压氨浸”过程中“加压”的目的是___________ 、___________ ;Cu发生反应的化学方程式为___________ 。
(4)“加压氧化”的目的是氧化残留的___________ (填离子符号)。
(5)“除钴”过程中发生反应的离子方程式为___________ 。
(6)流程中可以循环利用的物质有___________ (填化学式)。

已知:①“加压氨浸”过程中镍硫化物发生反应的方程式为:
 ;在此过程中,钴硫化物的反应与镍硫化物相似。
;在此过程中,钴硫化物的反应与镍硫化物相似。②以上流程中均无SO2产生。
请回答:
(1)滤渣1的主要成分为
(2)结合下列图表选择“加压氨浸”的最佳条件

(3)“加压氨浸”过程中“加压”的目的是
(4)“加压氧化”的目的是氧化残留的
(5)“除钴”过程中发生反应的离子方程式为
(6)流程中可以循环利用的物质有
您最近一年使用:0次
解题方法
7 . 磷烷(PH3)是集成电路、太阳能电池等电子工业生产的原材料。工业上制备PH3的反应原理为: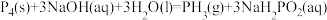 。NA表示阿伏加德罗常数,下列说法正确的是
。NA表示阿伏加德罗常数,下列说法正确的是
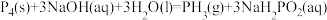 。NA表示阿伏加德罗常数,下列说法正确的是
。NA表示阿伏加德罗常数,下列说法正确的是| A.常温下pH=13的NaOH溶液中水电离出的c(OH-)=0.1mol/L |
B.0.1mol/L的NaH2PO2溶液中 的数目小于0.1NA 的数目小于0.1NA |
| C.3.1g白磷中共价键的数目为0.6NA |
D.每转移3个电子,生成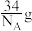 磷烷 磷烷 |
您最近一年使用:0次
解题方法
8 . 碱式碳酸铜在烟火、农药、颜料、杀菌剂等方面应用广泛。一种以辉铜矿(主要是 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
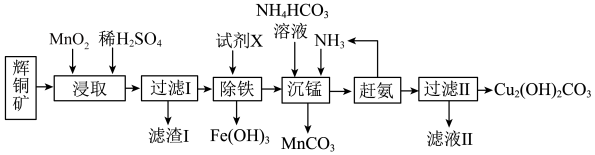
(1)Cu位于元素周期表第______ 周期第______ 族。
(2)滤渣Ⅰ经 提取后可获得一种淡黄色副产品,则浸取中
提取后可获得一种淡黄色副产品,则浸取中 发生反应的离子方程式为
发生反应的离子方程式为______ 。
(3)常温下,加入试剂X的目的是调节溶液的pH为2.9以完全除去铁元素(溶液中离子浓度小于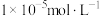 即可视为完全沉淀),则试剂X可用
即可视为完全沉淀),则试剂X可用______ (写化学式),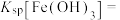
______ 。
(4)实验室检验碱式碳酸铜是否洗净的操作为______ 。
(5)已知Cu与Zn在元素周期表中相邻,其电离能数据如表:
请根据原子结构分析Cu的第二电离能比Zn的第二电离能大的原因:______ 。
 ,含有
,含有 和少量
和少量 等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
等杂质)为原料制备碱式碳酸铜的流程如图所示。回答下列问题:
(1)Cu位于元素周期表第
(2)滤渣Ⅰ经
 提取后可获得一种淡黄色副产品,则浸取中
提取后可获得一种淡黄色副产品,则浸取中 发生反应的离子方程式为
发生反应的离子方程式为(3)常温下,加入试剂X的目的是调节溶液的pH为2.9以完全除去铁元素(溶液中离子浓度小于
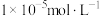 即可视为完全沉淀),则试剂X可用
即可视为完全沉淀),则试剂X可用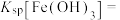
(4)实验室检验碱式碳酸铜是否洗净的操作为
(5)已知Cu与Zn在元素周期表中相邻,其电离能数据如表:
元素 | 第一电离能/( | 第二电离能/( |
Cu | 746 | 1958 |
Zn | 906.4 | 1733 |
您最近一年使用:0次
2024-03-11更新
|
193次组卷
|
2卷引用:甘肃省白银市名校2023-2024学年高三下学期联合调研化学试题
名校
9 . 二硫化碳( )是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在
)是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在 条件下发生反应可制得
条件下发生反应可制得 ,根据所给信息,回答下列问题。
,根据所给信息,回答下列问题。
反应原理:
反应装置: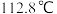 ,沸点
,沸点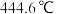 ;
; 的熔点
的熔点 ,沸点
,沸点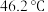 。
。
(1)装置A的名称是___________ ,加热装置A之前,需要先通入一段时间的 ,其目的是
,其目的是___________ (写出一点即可)。
(2)装置B的用途是___________ ,吸收尾气中的硫化氢可使用的试剂是___________ (填试剂名称)。
(3)反应过程中轻轻摇动装置A,使液态硫附着在装置A的内壁上,这样作的目的是___________ 。
(4)实验结束后,将制得的产品用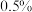 的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出
的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出 利用无水氯化钙处理后,再经过操作a可获得高纯的
利用无水氯化钙处理后,再经过操作a可获得高纯的 。利用高锰酸钾溶液洗涤是为了除去溶在
。利用高锰酸钾溶液洗涤是为了除去溶在 中的
中的___________ (写化学式),用无水氯化钙处理 的目的是
的目的是___________ ,操作a是___________ (写操作名称)。
(5)工业利用上述原理生产 时,常将副产品
时,常将副产品 利用克劳斯法转化为
利用克劳斯法转化为 ,从而实现循环利用,该方法分两步进行:
,从而实现循环利用,该方法分两步进行: 、
、___________ (写出化学方程式)。
 )是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在
)是一种重要有机溶剂,易挥发、易燃烧。利用硅酸作催化剂,甲烷和硫黄在 条件下发生反应可制得
条件下发生反应可制得 ,根据所给信息,回答下列问题。
,根据所给信息,回答下列问题。反应原理:

反应装置:

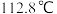 ,沸点
,沸点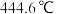 ;
; 的熔点
的熔点 ,沸点
,沸点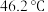 。
。(1)装置A的名称是
 ,其目的是
,其目的是(2)装置B的用途是
(3)反应过程中轻轻摇动装置A,使液态硫附着在装置A的内壁上,这样作的目的是
(4)实验结束后,将制得的产品用
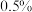 的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出
的高锰酸钾溶液洗涤三次,再加入汞不断振荡除去硫单质,分离出 利用无水氯化钙处理后,再经过操作a可获得高纯的
利用无水氯化钙处理后,再经过操作a可获得高纯的 。利用高锰酸钾溶液洗涤是为了除去溶在
。利用高锰酸钾溶液洗涤是为了除去溶在 中的
中的 的目的是
的目的是(5)工业利用上述原理生产
 时,常将副产品
时,常将副产品 利用克劳斯法转化为
利用克劳斯法转化为 ,从而实现循环利用,该方法分两步进行:
,从而实现循环利用,该方法分两步进行: 、
、
您最近一年使用:0次
2024-03-08更新
|
112次组卷
|
4卷引用:甘肃省张掖市某重点校2023-2024学年高三下学期模拟考化学试题
名校
解题方法
10 . 金属镓在工业和医学中有广泛应用。一种利用锌粉置换渣(主要成分为 、
、 、
、 、
、 、
、 、
、 )制备粗镓的工艺流程如图所示:
)制备粗镓的工艺流程如图所示:
回答下列问题。
(1)浸渣的主要成分是___________ ,“富氧浸出”中高压 的作用是
的作用是___________ 。
(2)用 代表P204,RH代表YW100,“协同萃取”过程中发生反应:
代表P204,RH代表YW100,“协同萃取”过程中发生反应: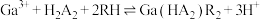 ,“协同萃取”后无机相含有的主要金属离子为
,“协同萃取”后无机相含有的主要金属离子为___________ ,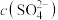 随
随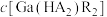 变化关系如图所示,“反萃取”加入稀硫酸的目的是
变化关系如图所示,“反萃取”加入稀硫酸的目的是___________ (用化学方程式表示)。 系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~
系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~___________ (填正整数),“碱溶造液”过程中发生反应的离子方程式为___________ 。___________ 。
(5)填隙方钴矿锑化物是一类新型热电材料,钴形成的六面体空隙中分别填充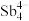 和As,该化合物的化学式为
和As,该化合物的化学式为___________ ;设阿伏加德罗常数的值为 ,已知该晶胞参数为a nm,则该晶体的密度是
,已知该晶胞参数为a nm,则该晶体的密度是___________  。
。
 、
、 、
、 、
、 、
、 、
、 )制备粗镓的工艺流程如图所示:
)制备粗镓的工艺流程如图所示:
回答下列问题。
(1)浸渣的主要成分是
 的作用是
的作用是(2)用
 代表P204,RH代表YW100,“协同萃取”过程中发生反应:
代表P204,RH代表YW100,“协同萃取”过程中发生反应: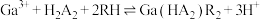 ,“协同萃取”后无机相含有的主要金属离子为
,“协同萃取”后无机相含有的主要金属离子为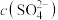 随
随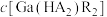 变化关系如图所示,“反萃取”加入稀硫酸的目的是
变化关系如图所示,“反萃取”加入稀硫酸的目的是
 系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~
系中电势随pH变化的图像。“中和沉镓”时所调pH合理范围为4~
(5)填隙方钴矿锑化物是一类新型热电材料,钴形成的六面体空隙中分别填充
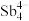 和As,该化合物的化学式为
和As,该化合物的化学式为 ,已知该晶胞参数为a nm,则该晶体的密度是
,已知该晶胞参数为a nm,则该晶体的密度是 。
。
您最近一年使用:0次
2024-03-01更新
|
498次组卷
|
4卷引用:甘肃省平凉市静宁县第一中学2023-2024学年高三下学期开学化学试题
甘肃省平凉市静宁县第一中学2023-2024学年高三下学期开学化学试题甘肃省张掖市某重点校2023-2024学年高三下学期开年摸底联考化学试题2024届河北省百师联盟高三下学期开学摸底联考化学试题(已下线)大题01 化工流程综合题(分类过关)-【大题精做】冲刺2024年高考化学大题突破+限时集训(新高考专用)

 )
)

