名校
1 . 已知 为无色离子。验证
为无色离子。验证 转化为
转化为 的实验操作和实验现象如下:
的实验操作和实验现象如下:
下列分析不合理 的是
 为无色离子。验证
为无色离子。验证 转化为
转化为 的实验操作和实验现象如下:
的实验操作和实验现象如下:| 实验操作 | 实验现象 |
①向 溶液中加入锌粉至 溶液中加入锌粉至 恰好转化为 恰好转化为 ②滴加  溶液 溶液 | I.溶液由黄色变成浅绿色 II.溶液无明显变化 |
A.解释现象I的反应: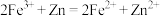 |
| B.若步骤②改为滴入少量氨水,则对应的现象是立即产生红褐色沉淀 |
C.若步骤①中 溶液与锌粉反应后还有锌粉剩余,则对应的现象是溶液由黄色变成无色 溶液与锌粉反应后还有锌粉剩余,则对应的现象是溶液由黄色变成无色 |
D.还原性: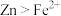 |
您最近一年使用:0次
名校
解题方法
2 . 镍是重要的战略金属资源,一种从某高镁低品位铜镍矿(主要成分为CuFeS2、FeS2、3NiO●4SiO2●H2O、3MgO●4SiO2●H2O等)中回收Cu、Ni的工艺流程如图所示:
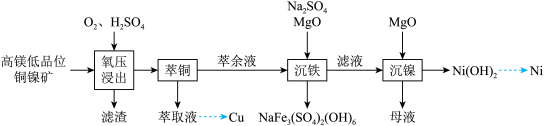
回答下列问题:
(1)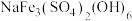 中,
中, 元素的化合价为
元素的化合价为_______ 。
(2)为提高“氧压浸出”的速率,可行的操作有_______ (任填一个)。
(3)“氧压浸出”的滤渣有S和_______ ,该环节中 发生的化学反应方程式为
发生的化学反应方程式为_______ 。
(4)“萃铜”时的反应为: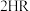 (有机相)
(有机相)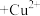 (水相)
(水相)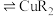 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。
(5)已知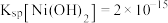 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为_______ ,“沉镍”后的母液,含有的主要溶质为_______ (填化学式)。

回答下列问题:
(1)
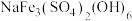 中,
中, 元素的化合价为
元素的化合价为(2)为提高“氧压浸出”的速率,可行的操作有
(3)“氧压浸出”的滤渣有S和
 发生的化学反应方程式为
发生的化学反应方程式为(4)“萃铜”时的反应为:
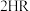 (有机相)
(有机相)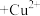 (水相)
(水相)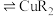 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。A.向萃取液中加入稀硫酸进行“反萃取”,可得到单质 |
B.萃余液中的阳离子为: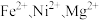 |
C.一定条件下,萃取平衡时,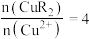 ,则 ,则 的萃取率为80% 的萃取率为80% |
D.为提高 的萃取率,可适当提高溶液 的萃取率,可适当提高溶液 |
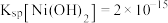 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为
您最近一年使用:0次
2023-02-09更新
|
1329次组卷
|
3卷引用:甘肃省会宁县第一中学2023-2024学年高三下学期第一次月考化学试题
名校
3 . 向仅含有 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。

提示:①不考虑 、
、 与水的反应;
与水的反应;
②不考虑气体的逸出;
③不考虑水电离出的 和
和 。
。
④产物只有 、
、 和
和 。
。
回答下列问题:
(1)
_______ ,曲线I对应的离子方程式为_______ 。
(2)b点溶液中,共含有_______ 种离子,分别为_______ (填离子符号)。
(3)
_______ ,曲线II对应的离子方程式为_______ 。
(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为_______ 。
 、
、 、
、 的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。
提示:①不考虑
 、
、 与水的反应;
与水的反应;②不考虑气体的逸出;
③不考虑水电离出的
 和
和 。
。④产物只有
 、
、 和
和 。
。回答下列问题:
(1)

(2)b点溶液中,共含有
(3)

(4)c点溶液中,阳离子的总物质的量与阴离子的总物质的量之比为
您最近一年使用:0次
2023-02-08更新
|
550次组卷
|
4卷引用:甘肃省白银市2022-2023学年高一下学期开学考(上学期期末)联考化学试题
2023高三·全国·专题练习
4 . 已知Na2SO3具有强还原性,能够被Cl2氧化。某化工厂排出的废水中含0.014mol·L-1 Cl2、0.001mol·L-1 H+,废水排出的速度为10.0mL·s-1,为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的Na2SO3溶液(0.10mol·L-1)和烧碱溶液(0.10mol·L-1)。下列说法错误的是
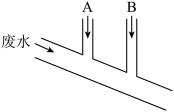

A.排出管A处发生的反应为 +Cl2+H2O= +Cl2+H2O= +2Cl-+2H+ +2Cl-+2H+ |
| B.废水排出管B处发生的反应为Cl2+2OH-=Cl-+ClO-+H2O |
| C.A处溶液的流量为1.4mL·s-1 |
| D.B处溶液的流量为2.8mL·s-1 |
您最近一年使用:0次
2023高三·全国·专题练习
5 . CO2、NO2、SO2是中学常见的非金属氧化物,下列有关三种氧化物的叙述正确的是
| A.它们均可与水反应生成酸,所以都是酸性氧化物 |
| B.它们都是无色、密度比空气大的有毒气体 |
| C.人类活动中过度排放CO2、SO2和NO2,都会引起酸雨 |
| D.它们在反应中都可做氧化剂 |
您最近一年使用:0次
名校
6 . 将1.76g铜镁合金完全溶解于50mL某浓度的硝酸中,得到 和NO的混合气体1120mL(标准状况),当向反应后的溶液中加入
和NO的混合气体1120mL(标准状况),当向反应后的溶液中加入 溶液时,金属离子全部转化为沉淀,测得沉淀的质量为3.12g。下列说法正确的是
溶液时,金属离子全部转化为沉淀,测得沉淀的质量为3.12g。下列说法正确的是
 和NO的混合气体1120mL(标准状况),当向反应后的溶液中加入
和NO的混合气体1120mL(标准状况),当向反应后的溶液中加入 溶液时,金属离子全部转化为沉淀,测得沉淀的质量为3.12g。下列说法正确的是
溶液时,金属离子全部转化为沉淀,测得沉淀的质量为3.12g。下列说法正确的是| A.该合金中铜与镁的物质的量之比是1∶1 |
B.该硝酸中 的物质的量浓度是 的物质的量浓度是 |
C. 和NO的混合气体中, 和NO的混合气体中, 的体积分数是30% 的体积分数是30% |
D.无法计算该硝酸中 的质量分数 的质量分数 |
您最近一年使用:0次
2023-01-14更新
|
1026次组卷
|
4卷引用:甘肃省定西市渭源县第一中学2022-2023学年高一下学期第一次阶段考试化学试题
名校
7 . 钛是航空、军工、电力等领域的重要原材料。地壳中的含钛矿石之一是金红石( ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是_______ (填标号)。
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为_______ ,该反应中氧化剂与还原剂的质量之比为_______ 。
③每转移0.2mol电子,同时生成CO的体积为_______ (标准状况下)。
(2)在反应II中:
①氩气的作用为_______ 。
②该反应的基本反应类型为_______ 。
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
①上述反应的离子方程式为_______ 。
②金属钛的质量分数为_______ (用含m、c、V的代数式表示)。
 ),其是冶炼钛的重要原料。生产钛的工艺流程如图:
),其是冶炼钛的重要原料。生产钛的工艺流程如图:
②加热时,钛可以和常见的非金属单质反应。
(1)在反应I中:
①下列有关CO的说法正确的是
A.属于酸性氧化物 B.摩尔质量为28 C.为可燃性气体 D.具有还原性
②反应I的化学方程式为
③每转移0.2mol电子,同时生成CO的体积为
(2)在反应II中:
①氩气的作用为
②该反应的基本反应类型为
(3)为了测定反应II制得的金属钛(杂质仅含Mg)中的钛元素含量。常温下,取mg反应II制得的金属钛置于烧杯中,往烧杯中逐滴滴入物质的量浓度为
 的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:
的稀硫酸,当不再出现气泡时,共消耗VmL稀硫酸:①上述反应的离子方程式为
②金属钛的质量分数为
您最近一年使用:0次
2023-01-11更新
|
307次组卷
|
7卷引用:甘肃省庆阳市2022-2023学年高一上学期期末考试化学试题
8 . 氧化剂和还原剂在生产生活中应用非常广泛。
(1)我国古代四大发明之一的黑火药是由硫磺粉、硝石(KNO3)、木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。在该反应中,氧化剂是_______ ,还原剂是_______ ,氧化产物是_______ ,还原产物是_______ 。
(2)水是生命之源,在常温常压下为无色无味液体,作为一种化学物质,水也会参与很多化学反应,如:
①2Na+2H2O=2NaOH+H2↑
②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2
④2H2O=2H2↑+O2↑
以上反应中,H2O只作氧化剂的是_______ ;H2O只作还原剂的是_______ ;H2O既作氧化剂,又作还原剂的是_______ ;H2O既不作氧化剂,又不作还原剂的是_______ 。
(3)高锰酸钾和浓盐酸可以发生如下反应制备氯气(Cl2):2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①已知KMnO4和MnCl2皆属于可溶盐,写出该反应的离子方程式_______ ;
②抄写化学方程式,用单线桥法标出电子转移的方向和数目_______ ;
③其中,氧化剂和还原剂的个数比为_______ 。
④在酸性溶液中,氧化性:KMnO4_______ Cl2(填大于或小于)。
(4)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2的化学方程式:_______ 。
(1)我国古代四大发明之一的黑火药是由硫磺粉、硝石(KNO3)、木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。在该反应中,氧化剂是
(2)水是生命之源,在常温常压下为无色无味液体,作为一种化学物质,水也会参与很多化学反应,如:
①2Na+2H2O=2NaOH+H2↑
②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2
④2H2O=2H2↑+O2↑
以上反应中,H2O只作氧化剂的是
(3)高锰酸钾和浓盐酸可以发生如下反应制备氯气(Cl2):2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①已知KMnO4和MnCl2皆属于可溶盐,写出该反应的离子方程式
②抄写化学方程式,用单线桥法标出电子转移的方向和数目
③其中,氧化剂和还原剂的个数比为
④在酸性溶液中,氧化性:KMnO4
(4)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2的化学方程式:
您最近一年使用:0次
9 . 氮元素在自然界的某种转化示意图如图所示( 、
、 、
、 和
和 代表一定比例的
代表一定比例的 和
和 )。下列说法正确的是
)。下列说法正确的是

A.过程①中 体现氧化性 体现氧化性 |
B.过程②中发生反应的离子方程式为 |
C.过程③中c代表的是 |
D.过程④中 参加反应转移 参加反应转移 电子 电子 |
您最近一年使用:0次
2022-12-23更新
|
136次组卷
|
3卷引用:甘肃省白银市会宁县第四中学2023-2024学年高三上学期第三次月考化学试题
名校
10 . 高铁酸钾是一种无机物,具有强氧化性,化学式为K2FeO4,是一种高效多功能的新型非氯绿色消毒剂,可通过次氯酸钾氧化Fe(NO3)3溶液来制备。次氯酸钾的制备装置如图所示。

回答下列问题:
(1)装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为_____ ,将制备的Cl2通过装置B可除去_____ (填化学式)。
(2)Cl2和KOH溶液在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是_____ ,写出制备次氯酸钾的化学方程式:_____ 。
(3)若实验制得的次氯酸钾溶液中n(ClO-):n(ClO )=5:1,则n(Cl⁻):n(ClO⁻)=
)=5:1,则n(Cl⁻):n(ClO⁻)=_____ 。
(4)装置D的作用是_____ 。
(5)在碱性条件下,KClO饱和溶液可将Fe(NO3)3转化为K2FeO4,写出反应的离子方程式:_____ 。
(6)高铁酸钾(K2FeO4)属于_____ (“酸”、“碱”、“盐”或“氧化物”),其中铁的化合价为_____ 价。高铁酸钾处理水过程中所发生的化学反应主要为4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH,该反应中物质的氧化性强弱关系是K2FeO4_____ (填“>”或“<”)O2。

回答下列问题:
(1)装置A中KMnO4与盐酸反应生成MnCl2和Cl2,其离子方程式为
(2)Cl2和KOH溶液在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
(3)若实验制得的次氯酸钾溶液中n(ClO-):n(ClO
 )=5:1,则n(Cl⁻):n(ClO⁻)=
)=5:1,则n(Cl⁻):n(ClO⁻)=(4)装置D的作用是
(5)在碱性条件下,KClO饱和溶液可将Fe(NO3)3转化为K2FeO4,写出反应的离子方程式:
(6)高铁酸钾(K2FeO4)属于
您最近一年使用:0次
2022-12-17更新
|
284次组卷
|
5卷引用:甘肃省庆阳市2022-2023学年高一上学期期末考试化学试题



