名校
1 . 实验室用浓盐酸和 制
制 ,并以干燥的
,并以干燥的 为原料制备
为原料制备 ,装置如下图所示。回答下列问题:
,装置如下图所示。回答下列问题:
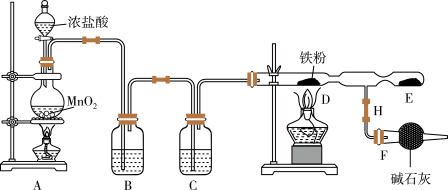
已知: 固体易升华,易吸收水分而潮解变质。请回答下列问题:
固体易升华,易吸收水分而潮解变质。请回答下列问题:
(1)连接好仪器后首先应进行的操作是_______ ;图中盛放碱石灰的仪器是_______ 。
(2)写出装置A中发生的离子方程式_______ 。
(3)装置B中盛放的试剂是_______ 。F装置所起的作用是_______ 。
(4)实验时,先点燃_______ 处的酒精灯,再点燃_______ 处酒精灯,D处发生的现象是_______ 。
(5)已知 与浓盐酸在常温下反应就可制取氯气:_______
与浓盐酸在常温下反应就可制取氯气:_______ _______
_______ (浓)= _______
(浓)= _______ _______
_______ _______
_______ _______
_______
①配平上述化学方程式,并用单线桥标出电子转移的情况。_________
②当生成标准状况下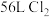 时对应转移的电子数为
时对应转移的电子数为_______ 。
 制
制 ,并以干燥的
,并以干燥的 为原料制备
为原料制备 ,装置如下图所示。回答下列问题:
,装置如下图所示。回答下列问题:
已知:
 固体易升华,易吸收水分而潮解变质。请回答下列问题:
固体易升华,易吸收水分而潮解变质。请回答下列问题:(1)连接好仪器后首先应进行的操作是
(2)写出装置A中发生的离子方程式
(3)装置B中盛放的试剂是
(4)实验时,先点燃
(5)已知
 与浓盐酸在常温下反应就可制取氯气:_______
与浓盐酸在常温下反应就可制取氯气:_______ _______
_______ (浓)= _______
(浓)= _______ _______
_______ _______
_______ _______
_______
①配平上述化学方程式,并用单线桥标出电子转移的情况。
②当生成标准状况下
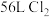 时对应转移的电子数为
时对应转移的电子数为
您最近一年使用:0次
2023-01-09更新
|
344次组卷
|
2卷引用:辽宁省沈阳市第十中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
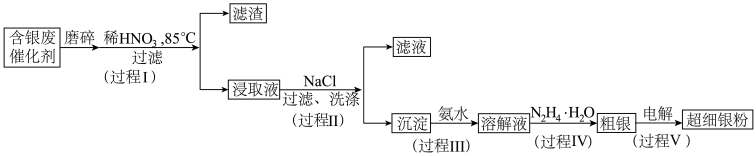
2 . 超细银粉在光学、生物医疗等领域有着广阔的应用前景。由含银废催化剂制备超细银粉的过程如下:
资料:
i.含银废催化剂成分:主要含Ag、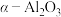 及少量MgO、
及少量MgO、 、
、 、
、 等
等
ii.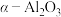 为载体,且不溶于硝酸
为载体,且不溶于硝酸
iii.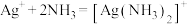
(1)预处理
过程I中,为提高银的浸取速率采取的措施有_______
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的 已洗涤干净的操作是
已洗涤干净的操作是_______ 。
②过程Ⅲ中,请结合平衡移动原理解释沉淀溶解的原因_______ 。
③过程Ⅳ中, 被氧化为
被氧化为 ,同时获得粗银,该反应的离子方程式为
,同时获得粗银,该反应的离子方程式为_______ 。
(3)回收率测定
采用如下方法测定粗银中银的回收率:取m g粗银样品用硝酸溶解,以铁铵矾[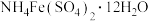 ]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
已知:i. (白色)
(白色) 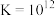
 (红色)
(红色) 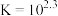
ii. 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8
iii.AgSCN可溶于较浓硝酸判断已达滴定终点时的现象是_______ 。
(4)精炼
①精炼时粗银应连接电源_______ 极;
②电解质溶液中溶质为_______ 。

资料:
i.含银废催化剂成分:主要含Ag、
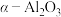 及少量MgO、
及少量MgO、 、
、 、
、 等
等ii.
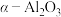 为载体,且不溶于硝酸
为载体,且不溶于硝酸iii.
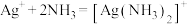
(1)预处理
过程I中,为提高银的浸取速率采取的措施有
(2)分离除杂
①过程Ⅱ中,检验沉淀表面的
 已洗涤干净的操作是
已洗涤干净的操作是②过程Ⅲ中,请结合平衡移动原理解释沉淀溶解的原因
③过程Ⅳ中,
 被氧化为
被氧化为 ,同时获得粗银,该反应的离子方程式为
,同时获得粗银,该反应的离子方程式为(3)回收率测定
采用如下方法测定粗银中银的回收率:取m g粗银样品用硝酸溶解,以铁铵矾[
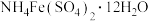 ]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。
]为指示剂,用c mol/L的KSCN标准溶液滴定,消耗标准溶液v mL。已知:i.
 (白色)
(白色) 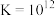
 (红色)
(红色) 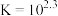
ii.
 开始沉淀的pH为1.5,完全沉淀的pH为2.8
开始沉淀的pH为1.5,完全沉淀的pH为2.8iii.AgSCN可溶于较浓硝酸判断已达滴定终点时的现象是
(4)精炼
①精炼时粗银应连接电源
②电解质溶液中溶质为
您最近一年使用:0次
2023-01-05更新
|
296次组卷
|
2卷引用:辽宁省沈阳市东北育才学校2022-2023学年高二上学期期末测试化学试题
名校
解题方法
3 . 某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[ ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
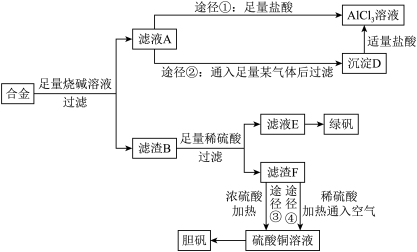
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式_______ 。
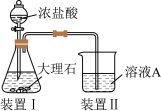
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是_______ (用离子方程式表示);为了避免沉淀D减少,应该在装置Ⅰ和装置Ⅱ之间增加一个盛有_______ 的洗气瓶。
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为_______ (用离子方程式表示)。
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成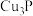 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
①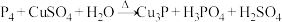
②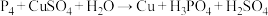
若上述两反应中被氧化的 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为_______ 。
(5)将绿矾加热失去结晶水后的产物 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
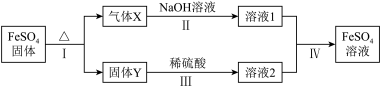
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。
①请写出X使氯水褪色所发生的反应的化学方程式_______ 。
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成 的离子方程式是
的离子方程式是_______ 。
 ]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
]和胆矾晶体,以探索工业废料的再利用。其实验方案如下:
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式
(2)进行途径②时,该小组用下图所示装置及试剂,将制得的
 气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
气体通入滤液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是
(3)通过途径④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、蒸发浓缩、冷却结晶、过滤、自然干燥。其中“加热通氧气”所起的作用为
(4)白磷有剧毒,不慎沾到皮肤上,可取少量胆矾配制成
 溶液冲洗解毒。白磷可与热的
溶液冲洗解毒。白磷可与热的 溶液反应生成
溶液反应生成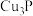 ,与冷溶液则析出Cu,反应方程式分别(均未配平)为:
,与冷溶液则析出Cu,反应方程式分别(均未配平)为:①
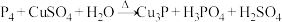
②
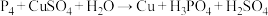
若上述两反应中被氧化的
 的物质的量相等,则消耗的
的物质的量相等,则消耗的 的物质的量之比为
的物质的量之比为(5)将绿矾加热失去结晶水后的产物
 ,进行如下转化(无关物质已略去)
,进行如下转化(无关物质已略去)
已知:X由两种化合物组成,将X通入氯水,溶液褪色;通入
 溶液,产生白色沉淀。Y是红棕色的化合物。
溶液,产生白色沉淀。Y是红棕色的化合物。①请写出X使氯水褪色所发生的反应的化学方程式
②若经反应Ⅰ得到16g固体Y,产生的气体X恰好被0.4L1mol/L NaOH溶液完全吸收,则反应Ⅳ中生成
 的离子方程式是
的离子方程式是
您最近一年使用:0次
名校
解题方法
4 . 某溶液仅含 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
 、
、 、
、 、
、 、
、 、
、 、
、 中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是
中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变。下列说法错误的是| A.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色 |
B.加入稀硫酸发生反应的离子方程式为: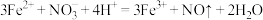 |
C.该溶液中一定有 |
| D.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g |
您最近一年使用:0次
名校
解题方法
5 . 室温下,通过下列实验探究0.01000 mo/L  溶液的性质:
溶液的性质:
实验1:实验测得0.01000 mol/L 溶液pH为8.6
溶液pH为8.6
实验2:向溶液中滴加等体积0.01000 mol/L HCl溶液,pH由8.6降为4.8
实验3:向溶液中加入等体积0.0200 mo/L 溶液,出现白色沉淀
溶液,出现白色沉淀
实验4:向稀硫酸酸化的 溶液中滴加
溶液中滴加 溶液至溶液褪色
溶液至溶液褪色
下列说法不正确的是
 溶液的性质:
溶液的性质:实验1:实验测得0.01000 mol/L
 溶液pH为8.6
溶液pH为8.6实验2:向溶液中滴加等体积0.01000 mol/L HCl溶液,pH由8.6降为4.8
实验3:向溶液中加入等体积0.0200 mo/L
 溶液,出现白色沉淀
溶液,出现白色沉淀实验4:向稀硫酸酸化的
 溶液中滴加
溶液中滴加 溶液至溶液褪色
溶液至溶液褪色下列说法不正确的是
A.0.0100   溶液中满足: 溶液中满足: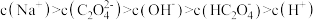 |
B.实验2滴加盐酸过程中存在某一点满足: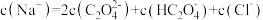 |
C.实验3所得上层清液中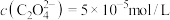 [已知室温时 [已知室温时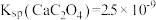 ] ] |
D.实验4发生反应的离子方程式为: |
您最近一年使用:0次
2022-09-02更新
|
601次组卷
|
5卷引用:辽宁省沈阳市五校协作体2021-2022学年高二上学期期末联考化学试题
名校
解题方法
6 . 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。请回答下列问题:
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
II.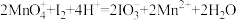
①氧化过程的离子方程式为_______ 。
②根据I2的特性,分离操作X应为_______ 、冷却结晶。
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是_______ 。
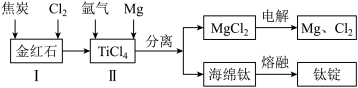
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:_______ 。
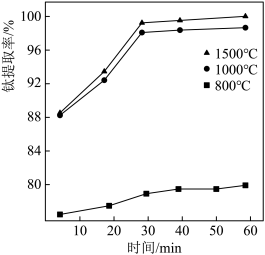
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为_______ ℃。_______ 。
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有_______ (填化学式)。
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
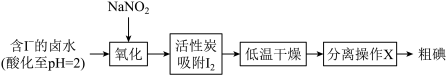
II.
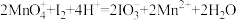
①氧化过程的离子方程式为
②根据I2的特性,分离操作X应为
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是
(2)以金红石(主要成分为TiO2)为原料,制取Ti的工艺流程如图所示:
②II中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为
④海绵钛除杂时得到的MgCl2可以循环使用,在上述工艺流程中可循环使用的物质还有
您最近一年使用:0次
2022-07-12更新
|
708次组卷
|
6卷引用:辽宁省沈阳市新民市第一高级中学2021-2022学年高一下学期期末考试化学试题
辽宁省沈阳市新民市第一高级中学2021-2022学年高一下学期期末考试化学试题辽宁省锦州市2021-2022学年高一下学期期末考试化学试卷黑龙江省齐齐哈尔市八校联考2022-2023学年高一下学期期末考试化学试题安徽省六安第一中学2022-2023学年高一下学期期末考试化学试题(已下线)猜想03 气体的制取、无机实验探究、无机综合应用(考题猜想)-2023-2024学年高一化学下学期期末考点大串讲(人教版2019必修第二册)名校期末好题汇编-化学与可持续发展(非选择题)
7 . 化学上常用标准电极电势数据φθ(氧化型/还原型)比较物质氧化能力。φθ值越高,氧化型物质氧化能力越强,φθ值与体系pH有关。利用表格所给数据分析,以下说法错误的是
| 氧化型/还原型 | φθ(Co3+/Co2+) | φθ(HClO/Cl— |
| 酸性介质 | 1.84V | 1.49V |
| 氧化型/还原型 | φθ[Co(OH)3/Co(OH)2] | φθ(ClO—/Cl—) |
| 碱性介质 | 0.17V | x |
| A.推测:x<1.49V |
| B.Co3O4与浓盐酸发生反应:Co3O4+8H+=Co2++2Co3++4H2O |
| C.若x=0.81V,碱性条件下可发生反应:2Co(OH)2+NaClO+H2O=2Co(OH)3+NaCl |
| D.从图中数据可知氧化型物质的氧化性随着溶液酸性增强而增强 |
您最近一年使用:0次
2022-02-22更新
|
2307次组卷
|
14卷引用:辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题
辽宁省沈阳市回民中学2022-2023学年高一上学期期末线上考试化学试题河北省石家庄二中教育集团2022-2023学年度高一年级上学期期末考试化学试题河南省信阳市2022届高三第二次质量检测化学试题(已下线)专题04氧化还原反应-五年(2018~2022)高考真题汇编(全国卷)(已下线)专题04氧化还原反应-2022年高考真题+模拟题汇编(全国卷)(已下线)专题04氧化还原反应-三年(2020~2022)高考真题汇编(全国卷)湖南省长沙市雅礼中学2021-2022学年高三下学期5月模拟考试(二)化学试题(已下线)专题03 氧化还原反应-备战2023年高考化学母题题源解密(全国通用)江西省新余市第一中学2022-2023学年高三上学期新生入学考试化学试题广东省广州市真光中学2022-2023学年高一上学期期中考化学试题湖南省株洲市九方中学2022-2023学年高一上学期期中考试化学试题河北省衡水中学2023届高三上学期三调考试化学试题辽宁省大连市第二十四中学2023-2024学年高一上学期第二次统测化学试卷 浙江省杭州第十四中学2023-2024学年高一上学期期中阶段性测试化学试题
名校
8 . 某工厂的工业废水中含有大量FeSO4和较多的Cu2+。为了减小污染并变废为宝,工厂计划从该废水中回收FeSO4和金属铜。现根据以下流程图,在实验室模拟该过程,回答下列问题。
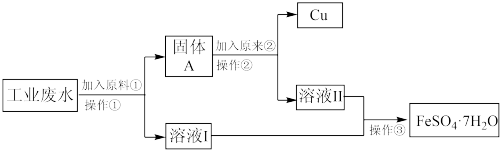
(1)原料①代表的物质为_______ ,原料②代表的物质为_______ 。
(2)实验室模拟操作①和②用到的玻璃仪器有_______ 。
(3)向盛有2mL溶液Ⅱ的试管中,滴入少量过氧化氢溶液,试写出发生反应的离子方程式,并用双线桥标出电子转移的方向和数目_______ ,再向所得溶液中滴加适量的淀粉KI溶液,现象为_______ ,发生反应的离子方程式为_______ ;向另一支盛有2mLKMnO4溶液的试管中,滴入适量溶液Ⅱ,发生反应的离子方程式为_______ 。

(1)原料①代表的物质为
(2)实验室模拟操作①和②用到的玻璃仪器有
(3)向盛有2mL溶液Ⅱ的试管中,滴入少量过氧化氢溶液,试写出发生反应的离子方程式,并用双线桥标出电子转移的方向和数目
您最近一年使用:0次
名校
9 . 随着新型冠状病毒感染的肺炎确诊病例越来越多,消毒已成了人们关注的话题。前不久李兰娟院士说过新冠病毒的几个弱点,比如含氯的消毒剂就可以有效的灭活病毒。某校化学兴趣小组为制备并收集氯气,设计下图装置,装置中的夹持装置和加热装置均已略去。
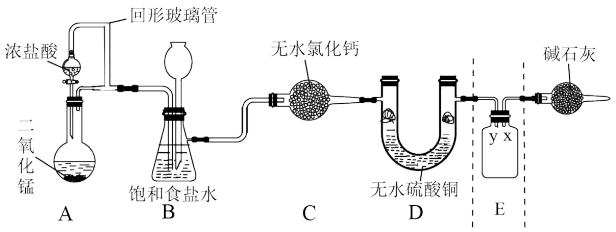
回答下列问题:
(1)写出盛放浓盐酸的仪器名称_______ ,回形玻璃管的作用是_______ 。
(2)写出装置A中发生反应的化学方程式_______ 。
(3)装置C的作用是_______ 。
(4)E装置中导管_______ (填“x”或“y”)应伸至靠近集气瓶底部。
(5)ClO2是目前国际上公认的新一代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面具有广泛的应用。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
①我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
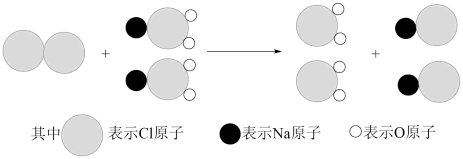
该反应的化学方程式_______ 。
②将ClO2通入酸性淀性粉碘化钾溶液,溶液变成蓝色,ClO2被还原为氯离子,该反应的离子方程式为:_______ 。

回答下列问题:
(1)写出盛放浓盐酸的仪器名称
(2)写出装置A中发生反应的化学方程式
(3)装置C的作用是
(4)E装置中导管
(5)ClO2是目前国际上公认的新一代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面具有广泛的应用。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
①我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:

该反应的化学方程式
②将ClO2通入酸性淀性粉碘化钾溶液,溶液变成蓝色,ClO2被还原为氯离子,该反应的离子方程式为:
您最近一年使用:0次
名校
解题方法
10 . NaNO2是一种食品添加剂,但它也能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式为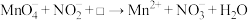 。下列叙述中正确的是
。下列叙述中正确的是
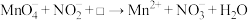 。下列叙述中正确的是
。下列叙述中正确的是A.该反应中 被还原 被还原 | B.Mn2+的还原性强于 |
| C.生成1molNaNO3需消耗0.4molKMnO4 | D.□中的粒子是OH- |
您最近一年使用:0次



