2020·山东·模拟预测
名校
解题方法
1 . 甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法,具有工艺简单、成本低等优点。
回答下列问题:
(1)已知1000 K时,下列反应的平衡常数和反应热:
①CH4(g) C(s)+2H2(g) K1=10.2 ΔH1
C(s)+2H2(g) K1=10.2 ΔH1
②2CO(g) C(s)+CO2(g) K2=0.6 ΔH2
C(s)+CO2(g) K2=0.6 ΔH2
③CO(g)+H2O(g) CO2(g)+H2(g) K3=1.4 ΔH3
CO2(g)+H2(g) K3=1.4 ΔH3
④CH4(g)+2H2O(g) CO2(g)+4H2(g) K4 ΔH4(SMR)
CO2(g)+4H2(g) K4 ΔH4(SMR)
则1000 K时,K4=____________ ;ΔH4=_________ (用ΔH1、ΔH2、ΔH3来表示)。
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5 ppm以下。脱硫的目的为______________ 。
(3)下图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知ΔH4____ 0(填“>”或“<”)。
(4)下图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐____________ (填“增加”“减小”或“不变”),600 ℃时,电流对三种催化剂中的____________ (用图中的催化剂表示式回答)影响效果最为显著,当温度高于750 ℃时,无论电流强度大小,有无催化剂,H2产率趋于相同,其原因是______________ 。
(5)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2–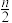 )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+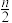 )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______ ②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______ 步,其原因为____________________________ 。
回答下列问题:
(1)已知1000 K时,下列反应的平衡常数和反应热:
①CH4(g)
 C(s)+2H2(g) K1=10.2 ΔH1
C(s)+2H2(g) K1=10.2 ΔH1②2CO(g)
 C(s)+CO2(g) K2=0.6 ΔH2
C(s)+CO2(g) K2=0.6 ΔH2③CO(g)+H2O(g)
 CO2(g)+H2(g) K3=1.4 ΔH3
CO2(g)+H2(g) K3=1.4 ΔH3④CH4(g)+2H2O(g)
 CO2(g)+4H2(g) K4 ΔH4(SMR)
CO2(g)+4H2(g) K4 ΔH4(SMR)则1000 K时,K4=
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5 ppm以下。脱硫的目的为
(3)下图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知ΔH4

(4)下图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐

(5)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2–
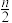 )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+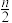 )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①
您最近一年使用:0次
2020-03-07更新
|
796次组卷
|
7卷引用:学科网2020年3月第一次在线大联考(山东卷)化学试题
(已下线)学科网2020年3月第一次在线大联考(山东卷)化学试题学科网2020年3月第一次在线大联考(新课标Ⅰ卷)理科综合化学试题河北省正定中学(实验中学)2020届高三下学期第三次质量检测试卷理综化学试题(已下线)理科综合-学科网3月第一次在线大联考(新课标Ⅱ卷)——化学试题(已下线)理科综合-学科网3月第一次在线大联考(新课标Ⅲ卷)——化学试题黑龙江省大庆实验中学2020届高三5月综合训练(一)理综化学试题(已下线)专题15 化学反应原理大题不丢分-2021年高考化学必做热点专题
解题方法
2 . 铁及其化合物在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。由此产生的CO2、SO2等废气处理意义重大。
(1)将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为CO2(g)+3H2(g)→CH3OH(g)+H2O(g)。如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa、5.0MPa。据图可知,该反应为____ 反应(填“吸热”或“放热”)。

设CO2的初始浓度为c0mol•L-1,根据5.0MPa时的数据计算该反应的平衡常数K(240)=_____ (列式即可)。若4.0Mpa时减小投料比c(CO2):c(H2),则CO2的平衡转化率曲线可能位于II线的____ (填“上方”或“下方”)。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe3O4和CO,发生反应Fe3O4(s)+CO(g) 3FeO(s)+CO2(g) △H1=+19.3kJ•mol-1,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是
3FeO(s)+CO2(g) △H1=+19.3kJ•mol-1,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____ (填写字母)。

a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO2浓度
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应C(s)+CO2(g) 2CO(g) △H3=+172.4kJ•mol-1,平衡时体系中气体体积分数与温度的关系如图2所示:
2CO(g) △H3=+172.4kJ•mol-1,平衡时体系中气体体积分数与温度的关系如图2所示:

①650℃时,该反应达平衡后吸收的热量是____ kJ。
②T℃时,若向平衡体系中再充入V(CO2):V(CO)=4:5的混合气体,平衡____ (填“正向”、“逆向”或“不”)移动。
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10﹣38,此温度下若在实验室中配制100mL5mol•L-1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2mol•L-1的盐酸____ mL(忽略加入盐酸体积)。
(1)将CO2应用于生产清洁燃料甲醇,既能缓解温室效应的影响,又能为能源的制备开辟新的渠道。其合成反应为CO2(g)+3H2(g)→CH3OH(g)+H2O(g)。如图为CO2平衡转化率和温度、压强的关系,其中压强分别为3.0MPa、4.0MPa、5.0MPa。据图可知,该反应为

设CO2的初始浓度为c0mol•L-1,根据5.0MPa时的数据计算该反应的平衡常数K(240)=
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe3O4和CO,发生反应Fe3O4(s)+CO(g)
 3FeO(s)+CO2(g) △H1=+19.3kJ•mol-1,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是
3FeO(s)+CO2(g) △H1=+19.3kJ•mol-1,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO2浓度
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2与足量的碳,发生反应C(s)+CO2(g)
 2CO(g) △H3=+172.4kJ•mol-1,平衡时体系中气体体积分数与温度的关系如图2所示:
2CO(g) △H3=+172.4kJ•mol-1,平衡时体系中气体体积分数与温度的关系如图2所示:
①650℃时,该反应达平衡后吸收的热量是
②T℃时,若向平衡体系中再充入V(CO2):V(CO)=4:5的混合气体,平衡
(4)已知25℃时,Ksp[Fe(OH)3]=4.0×10﹣38,此温度下若在实验室中配制100mL5mol•L-1FeCl3溶液,为使配制过程中不出现浑浊现象,则至少需要加入2mol•L-1的盐酸
您最近一年使用:0次
解题方法
3 . 氯化亚砜(SOCl2)在科研和工业上应用比较广泛。回答下列问题:
I.工业上利用尾气SO2与SCl2、C12反应合成氯化亚砜。发生如下反应:
①C12(g)+SO2(g) SO2C12(g) △H=-471.7kJ·mol-1
SO2C12(g) △H=-471.7kJ·mol-1
②SO2C12(g)+SCl2(g) 2SOC12(g)△H=-5.6kJ·mol-1
2SOC12(g)△H=-5.6kJ·mol-1
567K时,在10L密闭容器中,充入一定量的C12、SO2和SCl2,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化(反应达到平衡时的温度与初始温度相同)如下图所示,起始各组分及达平衡时SO2C12(g)的物质的量如下表。
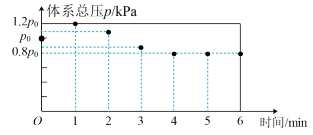
(1)0~1min,图中数据显示体系压强增大的原因是________________ 。
(2)0~4min内,v(C12)=_____ mol·L-1·min-1,5min时SCl2的转化率为________ 。
(3)567K时,上述反应②的KP______ 。
(4)567K下,若扩大容器体积为20L,则平衡时c(SO2)_____ (填“大于”“小于”或“等于”)上述反应平衡时的c(SO2)。
II.Li/SOCl2电池是一种高比能量电池,电解液为非水的LiAlC14的SOCl2溶液。正极为金属酞菁配合物(M-Pe,电池正极催化剂)附着的碳棒。正极催化过程为:SOCl2先与酞菁形成加合物,接着发生加合物的两步快速的电子转移,过程如图所示。
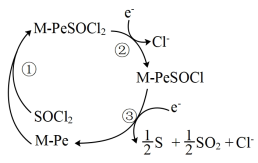
(5)上述正极催化过程M-PeSOCl2为_______ (填“催化剂”或“中间产物”),放电过程中每转移1mol电子生成_____ g硫单质。电池总反应的化学方程式为_______________________________________ 。
I.工业上利用尾气SO2与SCl2、C12反应合成氯化亚砜。发生如下反应:
①C12(g)+SO2(g)
 SO2C12(g) △H=-471.7kJ·mol-1
SO2C12(g) △H=-471.7kJ·mol-1②SO2C12(g)+SCl2(g)
 2SOC12(g)△H=-5.6kJ·mol-1
2SOC12(g)△H=-5.6kJ·mol-1567K时,在10L密闭容器中,充入一定量的C12、SO2和SCl2,测得初始压强为p0,反应过程中容器内总压强(p)随时间(t)变化(反应达到平衡时的温度与初始温度相同)如下图所示,起始各组分及达平衡时SO2C12(g)的物质的量如下表。

| 各分组 | Cl2 | SO2 | SCl2(g) | SO2Cl2(g) | SOCl2(g) |
| 起始/mol | 0.5 | 0.5 | 0.5 | 0 | 0 |
| 平衡/mol | 0.2 |
(2)0~4min内,v(C12)=
(3)567K时,上述反应②的KP
(4)567K下,若扩大容器体积为20L,则平衡时c(SO2)
II.Li/SOCl2电池是一种高比能量电池,电解液为非水的LiAlC14的SOCl2溶液。正极为金属酞菁配合物(M-Pe,电池正极催化剂)附着的碳棒。正极催化过程为:SOCl2先与酞菁形成加合物,接着发生加合物的两步快速的电子转移,过程如图所示。

(5)上述正极催化过程M-PeSOCl2为
您最近一年使用:0次
解题方法
4 . 含氮氧化物与含硫氧化物是大气的主要污染物,NH4NO3是一种水体污染物,有效去除这些污染物是一项重要课题。回答下列问题:
(1)氧化处理:
NO(g)+O3(g) NO2(g)+O2(g) △H1=-200.9kJ•mol-1
NO2(g)+O2(g) △H1=-200.9kJ•mol-1
SO2(g)+O3(g) SO3(g)+O2(g) △H2=-241.6kJ•mol-1
SO3(g)+O2(g) △H2=-241.6kJ•mol-1
2NO2(g) 2NO(g)+O2(g) △H3=+115.2kJ•mol-1
2NO(g)+O2(g) △H3=+115.2kJ•mol-1
2SO2(g)+O2(g) 2SO3(g) △H=
2SO3(g) △H=___ kJ•mol-1
(2)碱吸收处理:
①25℃时,用Na2CO3溶液吸收SO2,含硫微粒的物质的量分数随pH变化如图1所示,pH为4时,发生反应的离子方程式为__ 。

②25℃时,用氨水吸收SO2,脱硫效率η随pH变化如图2所示,pH过大或过小都会导致脱硫效率降低,原因分别是___ 和__ ;pH=7时,吸收液中NH4+与含硫微粒之间的关系是c(NH4+)=___ 。

(3)用电解法除去工业废水中硝酸铵的装置如图3所示,电解后左侧流出的溶液中主要的溶质是__ (填名称)。

(1)氧化处理:
NO(g)+O3(g)
 NO2(g)+O2(g) △H1=-200.9kJ•mol-1
NO2(g)+O2(g) △H1=-200.9kJ•mol-1SO2(g)+O3(g)
 SO3(g)+O2(g) △H2=-241.6kJ•mol-1
SO3(g)+O2(g) △H2=-241.6kJ•mol-12NO2(g)
 2NO(g)+O2(g) △H3=+115.2kJ•mol-1
2NO(g)+O2(g) △H3=+115.2kJ•mol-12SO2(g)+O2(g)
 2SO3(g) △H=
2SO3(g) △H=(2)碱吸收处理:
①25℃时,用Na2CO3溶液吸收SO2,含硫微粒的物质的量分数随pH变化如图1所示,pH为4时,发生反应的离子方程式为

②25℃时,用氨水吸收SO2,脱硫效率η随pH变化如图2所示,pH过大或过小都会导致脱硫效率降低,原因分别是

(3)用电解法除去工业废水中硝酸铵的装置如图3所示,电解后左侧流出的溶液中主要的溶质是

您最近一年使用:0次
5 . 处理工业废液中NH4+的反应为:NH4++2O2=NO3-+H2O+2H+(反应Ⅰ),5NH4++3NO3-=4N2+9H2O+2H+(反应Ⅱ)下列说法正确的是( )
| A.两个反应中,氮元素均只被氧化 |
| B.该处理过程的总反应可表示为4NH4++3O2=2N2+6H2O+4H+ |
| C.反应Ⅰ进行完全后,再加入等量废液发生反应Ⅱ,处理后废液中的NH4+能完全转化为N2 |
| D.标准状况下,生成22.4LN2时反应Ⅱ转移电子3.75mol |
您最近一年使用:0次
名校
解题方法
6 . 乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以IB表示)在催化剂HZSM-5催化下合成ETBE,反应的化学方程式为:C2H5OH(g)+IB(g)⇌ETBE(g)△H.回答下列问题:
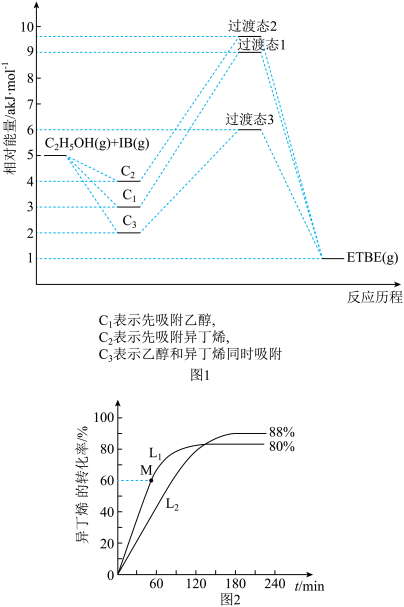
(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图1所示,该反应的△H=______ a kJ•mol-1.反应历程的最优途径是______ (填C1、C2或C3)。
(2)在刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在378K与388K时异丁烯的转化率随时间变化如图2所示。
①378K时异丁烯的转化率随时间变化的曲线为______ (填L1或L2)。
②388K时,以物质的量分数表示的化学平衡常数K=______ 。(物质的量分数为某组分的物质的量与总物质的量的比)
③已知反应速率v=v正-v逆=k正x(C2H5OH)•x(IB)-k逆x(ETBE),其中秒正为正反应速率,v逆为逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数,计算M点 =
=______ (保留到小数点后 1位)。

(1)反应物被催化剂HZSM-5吸附的顺序与反应历程的关系如图1所示,该反应的△H=
(2)在刚性容器中按物质的量之比1:1充入乙醇和异丁烯,在378K与388K时异丁烯的转化率随时间变化如图2所示。
①378K时异丁烯的转化率随时间变化的曲线为
②388K时,以物质的量分数表示的化学平衡常数K=
③已知反应速率v=v正-v逆=k正x(C2H5OH)•x(IB)-k逆x(ETBE),其中秒正为正反应速率,v逆为逆反应速率,k正、k逆为速率常数,x为各组分的物质的量分数,计算M点
 =
=
您最近一年使用:0次
2020-02-13更新
|
222次组卷
|
2卷引用:山东省潍坊市2020届高三上学期期末考试化学试题
名校
7 . 如今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)

下列叙述正确的是

下列叙述正确的是
| A.该流程中只有“电解”、“氯化”涉及氧化还原反应 |
| B.“合成”反应中氧化剂与还原剂的物质的量之比为1:1 |
| C.“氯化”时反应方程式为7Cl2+2FeTiO3+6C=2FeCl3+2TiCl4+6CO(条件省略) |
| D.上述流程中“Mg,Ar"可用“Mg,CO2”代替 |
您最近一年使用:0次
2020-01-18更新
|
428次组卷
|
5卷引用:山东省淄博市第十中学2020届高三上学期期末考试化学试题
山东省淄博市第十中学2020届高三上学期期末考试化学试题滕州一中2020届高三4月份线上化学模拟试题(已下线)第八单元 化学反应与能量测试题-2021年高考化学一轮复习名师精讲练山东省淄博市第十中学2021届高三上学期期末考试化学试题专题4 本专题复习提升-高中化学苏教2019版必修第一册
名校
解题方法
8 . 汽车尾气中排放的NOx和CO污染环境,在汽车尾气系统装置中安装催化转化器,可有效降低NOx和CO的排放。已知:
①2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
②N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
③2NO(g)+O2(g)=2NO2(g) △H=-116.5kJ/mol
请回答下列问题:
(1)若1molN2(g)、1molNO(g)分子中化学键断裂时分别需要吸收946kJ、631.75kJ的能量,则1molO2(g)分子中化学键成键时需释放的能量为___ kJ。
(2)CO与NO2反应生成无毒气体的热化学方程式为___ 。
(3)为了模拟反应2NO(g)+2CO(g) N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
①前2s的平均反应速率v(N2)=___ ;此温度下,该反应的平衡常数K=___ 。
②能说明上述反应达到平衡状态的是____ 。
a.2v正(CO)=v逆(N2)
b.c(CO)=c(CO2)
c.容器内压强不变
d.混合气体密度不变
e.混合气体的平均相对分子质量不变
③当NO与CO初始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如右图所示,则NO的平衡转化率随温度升高而减小的原因___ ,压强(p1,p2,p3)的由大到小的顺序为___ 。

①2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol
②N2(g)+O2(g)=2NO(g) △H=+180.5kJ/mol
③2NO(g)+O2(g)=2NO2(g) △H=-116.5kJ/mol
请回答下列问题:
(1)若1molN2(g)、1molNO(g)分子中化学键断裂时分别需要吸收946kJ、631.75kJ的能量,则1molO2(g)分子中化学键成键时需释放的能量为
(2)CO与NO2反应生成无毒气体的热化学方程式为
(3)为了模拟反应2NO(g)+2CO(g)
 N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:
N2(g)+2CO2(g)在催化转化器内的工作情况,控制一定条件,让反应在恒容密闭容器中进行,用现代传感技术测得不同时间NO和CO的浓度如下表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/(10-4mol・L-1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| c(CO)/(10-3mol・L-1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s的平均反应速率v(N2)=
②能说明上述反应达到平衡状态的是
a.2v正(CO)=v逆(N2)
b.c(CO)=c(CO2)
c.容器内压强不变
d.混合气体密度不变
e.混合气体的平均相对分子质量不变
③当NO与CO初始浓度相等时,体系中NO的平衡转化率与温度、压强的关系如右图所示,则NO的平衡转化率随温度升高而减小的原因

您最近一年使用:0次
2020-01-18更新
|
216次组卷
|
3卷引用:山东省德州市2019-2020学年高二上学期期末考试化学试题
名校
9 . 我国“蓝天保卫战”成果显著,肆虐的雾霾逐渐被遏止。科学家研究发现含氮化合物和含硫化合物在形成雾霾时与大气中的氨有关,转化关系如图所示:
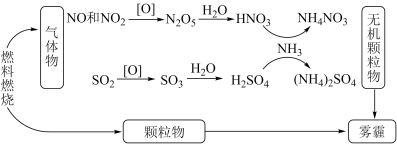
回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有________ (写化学式)。
(2)图中物质溶于水溶液呈碱性的是________ 。
(3)写出SO2转化为SO3的化学方程式________________________ 。
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为________________ 。
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为________________ (用化学方程式表示)。
(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为________________ 。

回答下列问题:
(1)从物质分类的角度看,图中的物质属于酸性氧化物的有
(2)图中物质溶于水溶液呈碱性的是
(3)写出SO2转化为SO3的化学方程式
(4)工业上利用氨气制备一氧化氮,反应的化学方程式为
(5)实验室长期保存浓硝酸,需使用棕色试剂瓶,并放置在阴凉处,其原因为
(6)氨气与一氧化氮(NO)在一定条件下反应可生成对空气无污染的物质,该反应的化学方程式为
您最近一年使用:0次
2020-01-17更新
|
644次组卷
|
8卷引用:山东省潍坊市2019-2020学年高一上学期期末考试化学试题
10 . 氨氮废水超标排放是水体富营养化的重要原因,可用以下流程处理:

下列说法正确的是

下列说法正确的是
| A.过程I中发生的化学反应属于氧化还原反应 |
B.过程Ⅱ中 ,每转化 ,每转化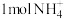 转移的电子数为6NA 转移的电子数为6NA |
| C.过程Ⅲ中CH3OH→CO2,甲醇作还原剂 |
| D.过程Ⅲ中HNO3→N2,转移10mol e-时可生成N2 11.2L(标准状况) |
您最近一年使用:0次
2020-01-17更新
|
337次组卷
|
5卷引用:山东省潍坊市2019-2020学年高一上学期期末考试化学试题
山东省潍坊市2019-2020学年高一上学期期末考试化学试题江苏省淮安市金湖、洪泽等六校2020-2021学年高一下学期联考期中考试(第六次学情调查)化学试题江苏省盐城市华东师范大学盐城实验中学2020-2021学年高一下学期第二次质量监测化学试题河南省南阳市第一中学校2021-2022学年高一上学期第六次月考化学试题(已下线)黑龙江省牡丹江市第一高级中学2022-2023学年高三上学期期末考试变式汇编(11-20)



