名校
解题方法
1 . CO2作为未米的重要碳源,其选择性加氢合成CH3OH一直是研究热点,在CO2加氢合成CH3OH的体系中,同时发生以下反应:
反应i:CO2(g)+3H2(g) CH3OH(g)+H2O(g)∆H1<0
CH3OH(g)+H2O(g)∆H1<0
反应ii:CO2(g)+H2(g) CO(g)+H2O(g)△H2>0
CO(g)+H2O(g)△H2>0
(1)在特定温度下,由稳定态单质生成lmol化合物的焓变叫该物质在此温度下的标准生成焓(△fH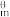 )。表中为几种物质在298K的标准生成焓,则反应ii的∆H2=
)。表中为几种物质在298K的标准生成焓,则反应ii的∆H2=___ kJ·mol−1。
(2)若实验测得反应i:υ正=k正·c(CO2)·c3(H2),υ逆=k逆·c(CH3OH)·c(H2O)(k正、k逆为速率常数)。1899年阿仑尼乌斯指出化学反应速率常数和温度的定量关系为:k=A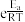 ,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,k正增大的倍数
,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,k正增大的倍数___ (填“>”“<”或“=")k逆增大的倍数。
(3)在CO2加氢合成CH3OH的体系中,下列说法错误的是___ (填标号).
A.增大H2浓度有利于提高CO2的转化率
B.若升高温度,反应i的正反应速率减小:反应ii的正反应速率增大
C.体系达平衡后,若压缩体积,则反应i平衡正向移动,反应ii平衡不移动
D.选用合适的催化剂可以提高CH3OH在单位时间内的产量
(4)某温度下,向容积为1L的密闭容器中通入2molCO2和10molH2,10min后体系达到平衡,此时CO2的转化率为20%,CH3OH的选择性为50%。
已知:CH3OH的选择性X=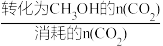 ×100%
×100%
①用CO2表示0~10min内平均反应速率υ(CO2)=___
②反应i的平衡常数K=___ L2/mol2(写出计算式即可)。
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率a(CO2)和甲醇的选择性χ(CH3OH)随温度变化的关系如图所示:
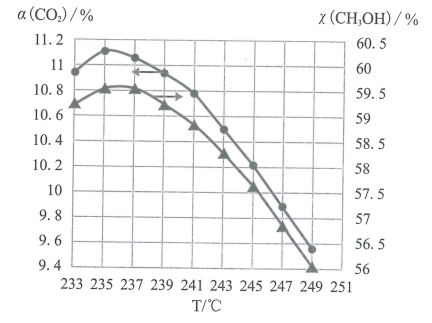
已知催化剂活性受温度影响变化不大,结合反应i和反应ii,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是___ ;
②二氧化碳的转化率随温度升高也在下降的可能原因是___ 。
反应i:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g)∆H1<0
CH3OH(g)+H2O(g)∆H1<0反应ii:CO2(g)+H2(g)
 CO(g)+H2O(g)△H2>0
CO(g)+H2O(g)△H2>0(1)在特定温度下,由稳定态单质生成lmol化合物的焓变叫该物质在此温度下的标准生成焓(△fH
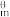 )。表中为几种物质在298K的标准生成焓,则反应ii的∆H2=
)。表中为几种物质在298K的标准生成焓,则反应ii的∆H2=| 物质 | H2(g) | CO2(g) | CO(g) | H2O(g) |
△fH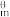 (kJ·mol−1) (kJ·mol−1) | 0 | −394 | −111 | −242 |
(2)若实验测得反应i:υ正=k正·c(CO2)·c3(H2),υ逆=k逆·c(CH3OH)·c(H2O)(k正、k逆为速率常数)。1899年阿仑尼乌斯指出化学反应速率常数和温度的定量关系为:k=A
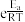 ,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,k正增大的倍数
,其中k为速率常数,A、R为常数,Ea为活化能,T为热力学温度,e为自然对数的底。则达到平衡后,仅加入催化剂,k正增大的倍数(3)在CO2加氢合成CH3OH的体系中,下列说法错误的是
A.增大H2浓度有利于提高CO2的转化率
B.若升高温度,反应i的正反应速率减小:反应ii的正反应速率增大
C.体系达平衡后,若压缩体积,则反应i平衡正向移动,反应ii平衡不移动
D.选用合适的催化剂可以提高CH3OH在单位时间内的产量
(4)某温度下,向容积为1L的密闭容器中通入2molCO2和10molH2,10min后体系达到平衡,此时CO2的转化率为20%,CH3OH的选择性为50%。
已知:CH3OH的选择性X=
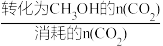 ×100%
×100%①用CO2表示0~10min内平均反应速率υ(CO2)=
②反应i的平衡常数K=
(5)维持压强和投料不变,将CO2和H2按一定流速通过反应器,二氧化碳的转化率a(CO2)和甲醇的选择性χ(CH3OH)随温度变化的关系如图所示:

已知催化剂活性受温度影响变化不大,结合反应i和反应ii,分析235℃后曲线变化的原因。
①甲醇的选择性随温度升高而下降的原因是
②二氧化碳的转化率随温度升高也在下降的可能原因是
您最近一年使用:0次
名校
解题方法
2 . 工业合成氨的反应N2+3H2=2NH3的能量变化如图所示,请回答有关问题:
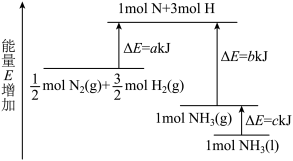
(1)合成1molNH3(l)___________ (填“吸收”或“放出”)___________ kJ的热量。(用字母表示)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为___________ kJ。
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)___________ (填“吸收”或“放出”)的热量___________ (填“多”或“少”)。

(1)合成1molNH3(l)
(2)已知:拆开1molH—H键、1molN—H键、1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则1molN2(g)完全反应生成NH3(g)产生的能量变化为
(3)推测反应2NH3(l)=N2(g)+3H2(g)比反应2NH3(g)=N2(g)+3H2(g)
您最近一年使用:0次
2021-05-03更新
|
300次组卷
|
8卷引用:黑龙江省齐齐哈尔市第八中学校2020-2021学年高一下学期期中考试化学试题
黑龙江省齐齐哈尔市第八中学校2020-2021学年高一下学期期中考试化学试题江西省南昌市八一中学、洪都中学等七校2020-2021学年高一下学期期中联考化学试题安徽省滁州市定远县育才学校2020-2021学年高一下学期期中考试化学试题江西省赣州市南康区第三中学2020-2021学年高一下学期期中考试化学试题山西省朔州市应县第一中学校2019-2020学年高一下学期期中考试化学试题(已下线)练习3 化学反应热的计算-2020-2021学年【补习教材·寒假作业】高二化学(人教版)云南省昌宁县第一中学2021-2022学年高一 3月月考化学试题陕西省渭南市华州区咸林中学2022-2023学年高一下学期期中考试化学试题
名校
3 . 利用磷石膏废渣(主要成分为CaSO4)生产硫酸可实现硫资源的循环利用。回答下列问题:
(1)硫黄分解磷石膏工艺涉及的主要反应为:
(I)S2(g)+CaSO4(s) CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1
CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1
(II)CaS(s)+3CaSO4(s) 4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1
4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1
①反应S2(g)+4CaSO4(s) 4CaO(s)+6SO2(g)的∆H=
4CaO(s)+6SO2(g)的∆H=_______ kJ·mol-1;
②在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是_______ (填字母)。
A. v正(SO2)=2 v正(S2) B.气体中含硫原子总数不随时间变化
C.容器内固体总质量不再随时间变化D.容器内气体总压强不再随时间变化
③在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中(CaS、CaSO4、CaO均足量)再充入少量SO2,达到新平衡后,与原平衡相比c(SO2)_______ (填“增大”“减小”或“不变”),原因为_______ 。
(2)有效除去废气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5气体在一体积固定的容器中发生如下反应:2N2O5(g)=4NO2(g)+O2(g)(慢反应) ∆H<0,2NO2(g) N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
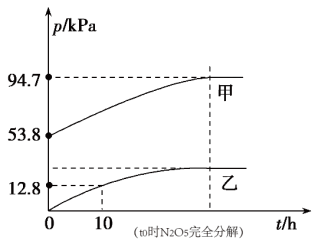
①图中表示O2压强变化的曲线是_______ (填“甲”或“乙")
②已知N2O5分解的反应速率v=0.12p(N2O5)(kPa·h-1),t=10h时,p(N2O5)=_______ kPa,v=_______ kPa•h-1。
③该温度下反应2NO2(g) N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=_______ kPa-1(结果保留两位小数)。
(1)硫黄分解磷石膏工艺涉及的主要反应为:
(I)S2(g)+CaSO4(s)
 CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1
CaS(s)+2SO2(g) ∆H= +240.4 kJ·mol-1(II)CaS(s)+3CaSO4(s)
 4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1
4CaO(s)+4 SO2(g) ∆H2= +1047.9 kJ·mol-1①反应S2(g)+4CaSO4(s)
 4CaO(s)+6SO2(g)的∆H=
4CaO(s)+6SO2(g)的∆H=②在恒温恒容密闭容器中只进行反应(I),能说明其已达到平衡状态的是
A. v正(SO2)=2 v正(S2) B.气体中含硫原子总数不随时间变化
C.容器内固体总质量不再随时间变化D.容器内气体总压强不再随时间变化
③在恒温恒容密闭容器中进行的反应(II)达到平衡时,向容器中(CaS、CaSO4、CaO均足量)再充入少量SO2,达到新平衡后,与原平衡相比c(SO2)
(2)有效除去废气中的SO2和氮氧化物,是打赢蓝天保卫战的重中之重。某温度下,N2O5气体在一体积固定的容器中发生如下反应:2N2O5(g)=4NO2(g)+O2(g)(慢反应) ∆H<0,2NO2(g)
 N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
N2O4(g)(快反应)∆H<0,体系的总压强p总和p(O2)随时间的变化如图所示。。
①图中表示O2压强变化的曲线是
②已知N2O5分解的反应速率v=0.12p(N2O5)(kPa·h-1),t=10h时,p(N2O5)=
③该温度下反应2NO2(g)
 N2O4(g)的平衡常数Kp=
N2O4(g)的平衡常数Kp=
您最近一年使用:0次
名校
4 . 已知25℃、101kPa时,以下反应的热化学方程式为:
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH1=+489kJ·mol-1
2CO(g)+O2(g)=2CO2(g)ΔH2=-564kJ·mol-1
C(s)+O2(g)=CO2(g)ΔH3=-393kJ·mol-1
则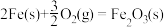 的ΔH为
的ΔH为
Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)ΔH1=+489kJ·mol-1
2CO(g)+O2(g)=2CO2(g)ΔH2=-564kJ·mol-1
C(s)+O2(g)=CO2(g)ΔH3=-393kJ·mol-1
则
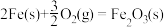 的ΔH为
的ΔH为| A.-822kJ·mol-1 | B.-468kJ·mol-1 | C.-186kJ·mol-1 | D.+468kJ·mol-1 |
您最近一年使用:0次
2021-04-23更新
|
1020次组卷
|
11卷引用:黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题
黑龙江省大庆市铁人中学2020-2021学年高一下学期期中考试化学试题河北省2021届高三普通高中学业水平选择性模拟考试化学试题第34届(2021年)高中化学奥林匹克竞赛浙江省预赛试题(已下线)课时29 盖斯定律及反应热计算-2022年高考化学一轮复习小题多维练(全国通用)(已下线)考点20 化学能与热能-备战2022年高考化学一轮复习考点帮(全国通用)黑龙江省佳木斯市建三江第一中学2021-2022学年高一下学期期末测试化学试题黑龙江省双鸭山市第一中学2023-2024学年高二上学期开学考试化学试题(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)(已下线)专题09 化学反应的热效应-2023年高考化学一轮复习小题多维练(全国通用)湖北省武汉市第四十九中学2023-2024学年高二上学期10月月考化学试题(已下线)寒假作业01 化学反应的热效应-【寒假分层作业】2024年高二化学寒假培优练(人教版2019)
名校
解题方法
5 . 甲醇是重要的化工原料。回答下列问题:
(1)以甲醇为原料制备甲醛,同时生成副产物H2等,已知以下热化学方程式:
I.CH3OH(g) CO(g)+2H2(g) △H1=a kJ·mol-1
CO(g)+2H2(g) △H1=a kJ·mol-1
II.CO(g)+H2(g) HCHO(g) △H2=b kJ·mol-1
HCHO(g) △H2=b kJ·mol-1
III.CH3OH(g) HCHO(g)+H2(g) △H3=c kJ·mol-1
HCHO(g)+H2(g) △H3=c kJ·mol-1
则b=___________ (用含有a、c的代数式表示)。
(2)以Na2CO3固体为催化剂,甲醇脱氢可制得甲醛。反应机理如下:
(i)CH3OH(g) ·H(g)+·CH2OH(g);
·H(g)+·CH2OH(g);
(ii)·CH2OH(g) HCHO(g)+·H(g);
HCHO(g)+·H(g);
(iii)·H(g)十·H(g) H2(g)
H2(g)
①(i)中反应物的总能量___________ (填“>”“=”或“<”)生成物的总能量。
②某温度时反应(i)、(ii)、(ii)的平衡常数依次为K1、K2、K3,CH3OH(g) H2(g)+HCHO(g)的平衡常数为K,则K=
H2(g)+HCHO(g)的平衡常数为K,则K=___________ (用含K1、K2、K3的代数式表示)。
(3)向体积为1 L恒容反应器中加入2 mol CH3OH及适量催化剂,发生反应CH3OH(g) HCHO(g)+H2(g) △H,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
HCHO(g)+H2(g) △H,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
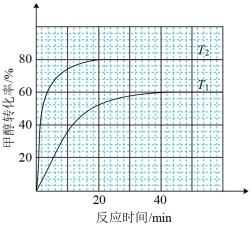
①T2温度下,20min时甲醇的体积分数为___________ %(保留三位有效数字),前20min平均反应速率 (HCHO)=
(HCHO)=___________ mol·L-1·min-1。
②T1温度下该反应的平衡常数Kp=___________ kPa(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,反应器内的初始压强为103kPa)。
(4)固体氧化物甲醇燃料电池是能效高、环境友好地转化成电能的全固态电源,工作原理如图所示。
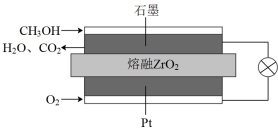
①石墨极上的反应式为___________ 。
②若通过用电器的电子的物质的量为1.2 mol,则消耗标准状况下O2的体积为___________ L。
(1)以甲醇为原料制备甲醛,同时生成副产物H2等,已知以下热化学方程式:
I.CH3OH(g)
 CO(g)+2H2(g) △H1=a kJ·mol-1
CO(g)+2H2(g) △H1=a kJ·mol-1II.CO(g)+H2(g)
 HCHO(g) △H2=b kJ·mol-1
HCHO(g) △H2=b kJ·mol-1III.CH3OH(g)
 HCHO(g)+H2(g) △H3=c kJ·mol-1
HCHO(g)+H2(g) △H3=c kJ·mol-1则b=
(2)以Na2CO3固体为催化剂,甲醇脱氢可制得甲醛。反应机理如下:
(i)CH3OH(g)
 ·H(g)+·CH2OH(g);
·H(g)+·CH2OH(g);(ii)·CH2OH(g)
 HCHO(g)+·H(g);
HCHO(g)+·H(g);(iii)·H(g)十·H(g)
 H2(g)
H2(g)①(i)中反应物的总能量
②某温度时反应(i)、(ii)、(ii)的平衡常数依次为K1、K2、K3,CH3OH(g)
 H2(g)+HCHO(g)的平衡常数为K,则K=
H2(g)+HCHO(g)的平衡常数为K,则K=(3)向体积为1 L恒容反应器中加入2 mol CH3OH及适量催化剂,发生反应CH3OH(g)
 HCHO(g)+H2(g) △H,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
HCHO(g)+H2(g) △H,在T1、T2(T1<T2)时,CH3OH转化率与时间关系如图所示。
①T2温度下,20min时甲醇的体积分数为
 (HCHO)=
(HCHO)=②T1温度下该反应的平衡常数Kp=
(4)固体氧化物甲醇燃料电池是能效高、环境友好地转化成电能的全固态电源,工作原理如图所示。

①石墨极上的反应式为
②若通过用电器的电子的物质的量为1.2 mol,则消耗标准状况下O2的体积为
您最近一年使用:0次
2021-04-22更新
|
293次组卷
|
2卷引用:黑龙江省齐齐哈尔市2021届高三第二次模拟考试理综化学试题
6 . 为了节能减排,提高资源的利用率,可以用 和
和 与
与 反应合成乙醇。已知:
反应合成乙醇。已知:
①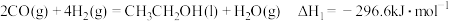
②
③ 液态水变为气态水的焓变为
液态水变为气态水的焓变为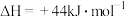
则由 和
和 反应生成
反应生成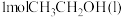 和
和 的
的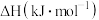 为
为
 和
和 与
与 反应合成乙醇。已知:
反应合成乙醇。已知:①
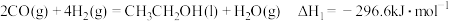
②

③
 液态水变为气态水的焓变为
液态水变为气态水的焓变为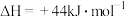
则由
 和
和 反应生成
反应生成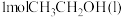 和
和 的
的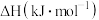 为
为A.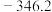 | B. | C.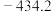 | D.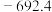 |
您最近一年使用:0次
2021-04-19更新
|
318次组卷
|
3卷引用:黑龙江省齐齐哈尔市第八中学2021-2022学年高二上学期期中考试化学试题
名校
解题方法
7 . 生产生活中的化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
(1)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。在 下,
下,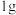 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出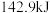 的热量,
的热量,
①请写出表示氢气燃烧热的热化学方程式____ 。
②将上述反应设计成下图所示的原电池,其中Y为___ 极(填“正”或“负”),该极电极反应式为___ 。
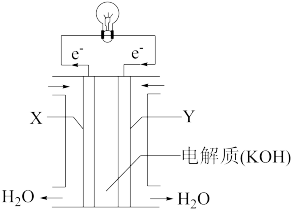
(2)最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇 。
。
①该法利用 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下:
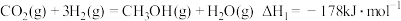
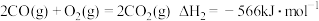
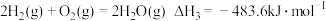
已知:i.断开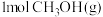 中的化学键共吸收
中的化学键共吸收 的能量
的能量
ii.反应①中部分化学键键能数据如下:
由此计算断开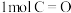 需要吸收
需要吸收____ kJ的能量,
____  。
。
②甲醇燃烧时发生如下反应(a、b、c、d均大于0):
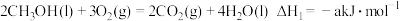
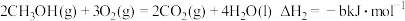
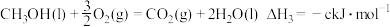
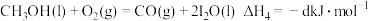
由此知,a、b、c、d由小到大排序为_______ 。
③将甲醇完全燃烧生成液态水的反应设计成原电池,以 为电解质。工作时负极的电极反应式
为电解质。工作时负极的电极反应式__ 。
(1)有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源。在
 下,
下,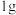 氢气完全燃烧生成液态水放出
氢气完全燃烧生成液态水放出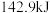 的热量,
的热量,①请写出表示氢气燃烧热的热化学方程式
②将上述反应设计成下图所示的原电池,其中Y为

(2)最新一期国际学术期刊《自然·纳米技术》介绍了我国科学家曾杰团队的成果:在含铂高效催化剂作用下把二氧化碳高效转化清洁液态燃料——甲醇
 。
。①该法利用
 制取甲醇的有关化学反应如下:
制取甲醇的有关化学反应如下: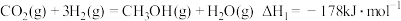
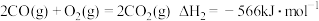
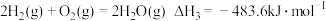
已知:i.断开
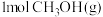 中的化学键共吸收
中的化学键共吸收 的能量
的能量ii.反应①中部分化学键键能数据如下:
| 化学键 | H-H | H-O |
键能/( ) ) | 436 | 463 |
由此计算断开
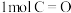 需要吸收
需要吸收
 。
。②甲醇燃烧时发生如下反应(a、b、c、d均大于0):
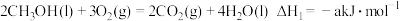
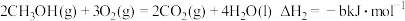
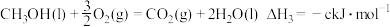
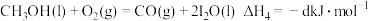
由此知,a、b、c、d由小到大排序为
③将甲醇完全燃烧生成液态水的反应设计成原电池,以
 为电解质。工作时负极的电极反应式
为电解质。工作时负极的电极反应式
您最近一年使用:0次
名校
解题方法
8 . 用 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。
已知:①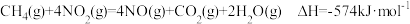
②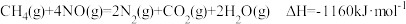
若在一定条件下,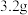 的
的 恰好与一定量的
恰好与一定量的 反应生成
反应生成 、
、 和
和 ,则整个过程中放出的热量为
,则整个过程中放出的热量为
 催化还原
催化还原 可以消除氮氧化物的污染。
可以消除氮氧化物的污染。已知:①
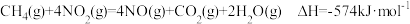
②
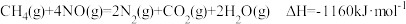
若在一定条件下,
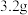 的
的 恰好与一定量的
恰好与一定量的 反应生成
反应生成 、
、 和
和 ,则整个过程中放出的热量为
,则整个过程中放出的热量为A. | B. | C. | D.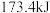 |
您最近一年使用:0次
名校
9 . 室温下,将 溶于水会使溶液温度降低,热效应为
溶于水会使溶液温度降低,热效应为 ,将
,将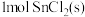 溶于水会使溶液温度升高,热效应为
溶于水会使溶液温度升高,热效应为 ;
;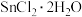 受热分解的化学方程式为
受热分解的化学方程式为 ,热效应为
,热效应为 。则下列判断正确的是
。则下列判断正确的是
 溶于水会使溶液温度降低,热效应为
溶于水会使溶液温度降低,热效应为 ,将
,将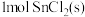 溶于水会使溶液温度升高,热效应为
溶于水会使溶液温度升高,热效应为 ;
;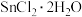 受热分解的化学方程式为
受热分解的化学方程式为 ,热效应为
,热效应为 。则下列判断正确的是
。则下列判断正确的是A. | B. | C. | D. |
您最近一年使用:0次
名校
解题方法
10 . 在食品行业中,N2O 可用作发泡剂和密封剂。
(1)N2O 在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) ΔH
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) ΔH1=-1010 kJ•mol-1
4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=-1531 kJ•mol-1
则 ΔH=_______ 。
(2)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应 N2O(g)+CO(g)⇌CO2(g)+N2(g)的能量变化及反应历程如图所示。
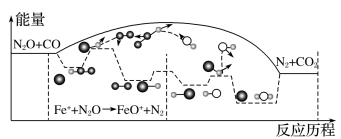
两步反应分别为:反应①Fe++N2O⇌FeO++N2,反应②_______ 。由图可知两步反应均为_______ (填“放热”或“吸热”)反应,由_______ (填“反应①”或“反应②”)决定反应达到平衡所用时间。
(3)在固定体积的密闭容器中,发生反应 N2O(g)+CO(g) ⇌CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能不同,也可能相同),测定 N2O 的平衡转化率。部分实验结果如图所示。
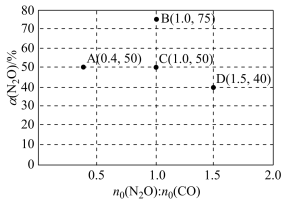
①如果要将图中 C 点的平衡状态改变为B 点的平衡状态,应采取的措施是_______ 。
②图中 C、D 两点对应的实验温度分别为 Tc和TD,通过计算判断Tc_______ (填“>”“=”或“<”)TD
(4)在某温度下,向1 L 密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g)⇌CO2(g)+N2(g),随着反应的进行,容器内 CO 的物质的量分数变化如表所示:
则该温度下反应的平衡常数 K=_______ 。
(1)N2O 在金粉表面发生热分解反应:2N2O(g)=2N2(g)+O2(g) ΔH
已知:2NH3(g)+3N2O(g)=4N2(g)+3H2O(l) ΔH1=-1010 kJ•mol-1
4NH3(g)+3O2(g)=2N2(g)+6H2O(l) ΔH2=-1531 kJ•mol-1
则 ΔH=
(2)N2O和CO是环境污染性气体,研究表明,CO与N2O在Fe+作用下发生反应 N2O(g)+CO(g)⇌CO2(g)+N2(g)的能量变化及反应历程如图所示。

两步反应分别为:反应①Fe++N2O⇌FeO++N2,反应②
(3)在固定体积的密闭容器中,发生反应 N2O(g)+CO(g) ⇌CO2(g)+N2(g),改变原料气配比进行多组实验(各次实验的温度可能不同,也可能相同),测定 N2O 的平衡转化率。部分实验结果如图所示。

①如果要将图中 C 点的平衡状态改变为B 点的平衡状态,应采取的措施是
②图中 C、D 两点对应的实验温度分别为 Tc和TD,通过计算判断Tc
(4)在某温度下,向1 L 密闭容器中充入CO与N2O,发生反应:N2O(g)+CO(g)⇌CO2(g)+N2(g),随着反应的进行,容器内 CO 的物质的量分数变化如表所示:
| 时间/min | 0 | 2 | 4 | 6 | 8 | 10 |
| 物质的量分数 | 50.0% | 40.25% | 32.0% | 26.2% | 24.0% | 24.0% |
则该温度下反应的平衡常数 K=
您最近一年使用:0次



